| Numéro |
Med Sci (Paris)
Volume 41, Numéro 6-7, Juin-Juillet 2025
Réfléchir le vivant
|
|
|---|---|---|
| Page(s) | 607 - 610 | |
| Section | Forum | |
| DOI | https://doi.org/10.1051/medsci/2025081 | |
| Publié en ligne | 7 juillet 2025 | |
La chimiolithotrophie, ce métabolisme fréquent trop ignoré
Chemolithotrophy, an overlooked but common metabolism
Professeur du Muséum national d’histoire naturelle, Institut de systématique, évolution, biodiversité, membre de l’Institut Universitaire de France

Vignette (© Marc Selosse).
Si vous avez déjà vu couler de l’eau ferrugineuse, laissant un dépôt orangé sur le fond du ruisseau, ou simplement de la rouille, vous avez observé des eubactéries capables de chimiolithotrophie. Ce troisième, grand métabolisme du vivant, à côté de la photosynthèse et des métabolismes hétérotrophes (respiration et fermentation), est souvent le plus terrifiant et le moins clair pour les étudiants… voire les enseignants. Pourtant, il n’est pas si sorcier. Le grand microbiologiste ukrainien Sergueï Winogradsky1 l’avait découvert en étudiant des eubactéries des sources sulfureuses de l’Oberland bernois, en Suisse, capables de fixer du CO2 pour fabriquer de la matière organique en l’absence de lumière : c’est le mécanisme de la photosynthèse… mais sans lumière. D’où vient donc l’énergie requise ? Dans la chimiolithotrophie, point besoin d’énergie lumineuse : une réaction d’oxydo-réduction entre deux composés minéraux2, un réducteur et un oxydant, libère l’énergie requise sous forme d’ATP3. Ainsi, dans la rouille, le fer métallique Fe0 est oxydé en fer ferrique (Fe3+) en présence d’oxygène (O2) ; dans l’eau ferrugineuse, le fer ferreux (Fe2+), soluble dans l’eau à l’abri de l’oxygène, tant que l’eau est souterraine, s’oxyde en fer ferrique à l’air libre. Dans les deux cas, le fer ferrique, peu soluble, se dépose. Les eubactéries des sources sulfureuses bernoises oxydent le sulfure d’hydrogène (H2S) par l’oxygène – générant du sulfate ou du soufre natif S0. Les réducteurs sont variés : de nombreux composés minéraux réduits peuvent servir à des eubactéries ou des archées en présence d’oxygène.
Un autre exemple avait été découvert en 1877 par les chimistes français Jean-Jacques Schlœsing (1824-1919) et Achille Müntz (1846-1917) : la nitrification. Ils avaient observé dans des boues d’égouts la conversion d’ammonium (NH4+) en nitrate (NO3-) en présence d’oxygène, et remarqué que cette conversion disparaissait après stérilisation des boues : toutefois, ils n’avaient pas montré qu’elle alimentait le métabolisme d’êtres vivants, ce que découvrira Sergueï Winogradsky peu après4. Des réducteurs comme l’hydrogène (H2), ou encore le méthane (CH4) chez les bactéries dites méthanotrophes, peuvent aussi être utilisés.
L’oxygène n’est pas le seul oxydant possible, même si c’est le plus puissant : son utilisation dégage donc le plus d’énergie et il est utilisé en priorité quand il est disponible. En son absence, le nitrate (par exemple au fond des océans), le sulfate, le fer ferrique ou d’autres composés oxydants peuvent servir, si leur réaction avec le réducteur disponible libère effectivement de l’énergie. Une chimiolithotrophie anaérobie bien connue explique la production du méthane dans les méthaniseurs ou dans le tube digestif des bovins5 [1] (→): des archées dites méthanogènes font réagir l’hydrogène H2 avec du CO2 comme oxydant, dégageant leur énergie de cette réaction et produisant du méthane comme déchet. Certaines espèces chimiolithotrophes changent d’ailleurs d’oxydant ou de réducteur selon ce que le milieu leur offre. Par exemple, l’eubactérie Alcaligenes eutrophus peut oxyder l’hydrogène avec l’oxygène (cette réaction libère 3 molécules d’ATP) ou à défaut avec du sulfite (ce qui libère « seulement » 2,5 molécules d’ATP). Les eubactéries du genre Thiobacillus peuvent utiliser le sulfure d’hydrogène H2S, le soufre natif S0 ou le thiosulfate (S2O32-) comme réducteurs et l’oxygène O2 ou le nitrate NO3- comme oxydants : une plasticité écologique existe parfois.
(→) Voir m/s n° 11, 2024, page 866
Comme Winogradsky l’avait établi, l’énergie libérée sert à convertir du CO2 en matière organique : tout comme les organismes photosynthétiques, les chimiolithotrophes sont des autotrophes au carbone6. Les voies biochimiques impliquées dans cette conversion proprement dite sont d’ailleurs souvent les mêmes que pour la photosynthèse. Certains utilisent le cycle de Calvin-Benson, qui opère dans les cyanobactéries et les chloroplastes. D’autres utilisent des voies moins connues qu’on retrouve chez certaines eubactéries photosynthétiques non cyanobactériennes [2] : le cycle inversé de Krebs (qui comme son nom l’indique est un cycle de Krebs fonctionnant à l’envers, donc incorporant du CO2) ou le cycle du 3-hydroxypropionate, par exemple. Ainsi, le module métabolique de fixation de CO2 proprement dit, chez les procaryotes, est indépendant de celui produisant l’énergie, par la réception de la lumière ou par la chimiolithotrophie, et diverses configurations associant ces modules existent. Aucun eucaryote n’est chimiolithotrophe, sauf par symbiotise avec des procaryotes [3]. Près des sources hydrothermales océaniques, de telles symbioses nourrissent des vers tubicoles géants (Riftia pachyptila) avec des eubactéries oxydant le H2S et des moules géantes (du genre Bathymodiolus) avec les eubactéries précédentes ou des archées méthanotrophes, selon que les fluides sont, respectivement, riches en H2S ou en CH4.
Revenons à la fixation du CO2 : qui se rappelle le cycle de Calvin-Benson et qui imagine un cycle de Krebs fonctionnant à l’envers voit bien qu’il faut injecter de l’ATP, mais aussi des électrons (du pouvoir réducteur). Simplifions. D’abord, la carboxylation7 n’est pas thermodynamiquement favorisée (c’est la décarboxylation qui l’est) : il faut de l’ATP pour forcer la carboxylation. Ensuite, cette carboxylation d’un composé organique RH conduit à une fonction acide organique (aussi dite carboxylique) :
RH + CO2 > RCOOH
C’est par exemple la fonction acide organique de l’acide 3-phosphoglycérique produit dans le cycle de Calvin-Benson. Or, le carbone du vivant porte surtout des fonctions cétoniques, alcooliques – voire aucun oxygène : il est plus réduit. Il faut donc des électrons pour réduire la fonction acide organique, produit brut de fixation du CO2. D’où proviennent ces électrons ? Ils sont porté par des cofacteurs, NADH,H+ ou NADPH,H+ - mais qu’est-ce qui réduit ces cofacteurs ?
Le plus souvent, trop souvent en fait, la chimiolithotrophie est résumée à la réaction d’oxydoréduction produisant de l’ATP :
Réducteur 1 + Oxydant 2 > Oxydant 1 + Réducteur 2 + ATP (1)
Mais une petite fraction du réducteur est utilisée pour réduire le NAD+ en NADH,H+, sans autre oxydant cette fois, ce qui est la source d’électrons pour réduire la fonction acide organique issue de la fixation du CO2 :
Réducteur 1 + NAD+ > Oxydant 1 + NADH,H+ (2)
Le bilan exact est (1) + i X (2), où le facteur i varie selon les besoins métaboliques respectifs en ATP et en électrons :
(1+i) Réducteur 1 + Oxydant 2 + i NAD+ >
(1+i) Oxydant 1 + Réducteur 2 + i NADH,H+ + ATP
On peut résumer la chimiolithotrophie par un « diagramme en V renversé » (Figure 1), tout comme il existe un « diagramme en Z » pour les réactions d’oxydo-réduction de la photosynthèse. Une première voie produit l’énergie : sorte de « respiration minérale », elle fait intervenir des transports d’électrons entre cytochromes enchâssés dans une membrane et engendre un gradient de protons transmembranaire (Figure 1, flèche verte). C’est lui qui, au niveau d’ATPases transmembranaires, produit de l’ATP. Une seconde voie entraîne les électrons vers le NAD+ (Figure 1, flèche bleue) : si ce transfert ne peut être spontané parce que le réducteur 1 n’est pas assez puissant, une partie de l’énergie issue de la première voie est utilisée pour forcer des oxydo-réductions thermodynamiquement interdites (cas de la Figure 1). On parle de « chaîne de transfert inverse » puisque les électrons circulent à l’envers du sens spontané, grâce à l’énergie apportée. Cette chaîne inverse implique des cytochromes de mêmes membranes, et le gradient transmembranaire de protons est directement dissipé pour apporter l’énergie souhaitée.
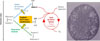 |
Figure 1 Diagramme en V renversé récapitulant la chimiolithotrophie dans le cas type des eubactéries. Les potentiels redox vont croissant vers le bas : les flux d’électrons allant vers le bas sont autorisés thermodynamiquement et produisent de l’énergie. Tous les flux d’électrons se font par passage de cytochrome en cytochrome, au sein d’une membrane (membrane plasmique ou vésicule intracellulaire). Une première voie, forme de respiration minérale (en vert), libère de l’énergie qui sert à former un gradient transmembranaire de protons (en jaune). Celui-ci peut, au niveau d’ATPases, former de l’ATP. Une seconde voie, la chaîne de transfert inverse (en bleu), porte des électrons vers les cofacteurs des réductions cellulaire, le NADH,H+ (ou le NADPH,H+, selon l’espèce) : elle consomme une partie du gradient de protons nécessaire à permettre cette oxydo-réduction si elle est thermodynamiquement défavorisée. Insert en bas à droite : bactérie oxydant le nitrate par l’oxygène, Nitrosobacter winogradskyi, en microscopie électrique. ATP : adénosine triphosphate ; CC-O : couplage chimio-osmotique, transférant de l’énergie d’une réaction d’oxydo-réduction à un gradient, ou l’inverse ; e- : électrons. |
Il arrive plus rarement que la source d’électrons utilisés pour le NAD+ soit distincte de celle des électrons, comme dans les planctomycètes (eubactéries) qui réalisent l’oxydation anaérobie de l’ammonium (ou « anammoxes », pour anaerobic ammonium oxidation) [4]. L’énergie provient de l’oxydation de l’ammonium par du nitrite :
NH4+ + NO2- > N2 + 2 H2O + ATP
Les électrons, quant à eux, proviennent de l’oxydation du nitrite par le NAD+, et non pas de l’ammonium :
NO2- + H2O + NAD+ > NO3- + NADH,H+
Les cellules des chimiolithotrophes contiennent souvent d’abondantes membranes où se trouvent les cytochromes intervenant dans les transferts d’électrons : celles-ci sont sous forme de vésicules dans la cellule (comme pour les thylakoïdes des plastes ; voir insert de la Figure 1) ou de replis de la membrane interne des bactéries Gram négatif8 (comme pour les crêtes membranaires des mitochondries).
Les nombreuses conversions énergétiques sous-jacentes à la chimiolithotrophie ne se font pas avec 100 % d’efficacité. Ces déperditions énergétiques successives, ajoutées à la nécessité d’une grande quantité de réducteurs, laissent souvent penser que la chimiolithotrophie reste limité aux zones sombres (où la photosynthèse n’est pas possible) et pauvres en matière organique (où l’hétérotrophie9 est impossible). De fait, les chimiolithotrophes abondent dans les sols ou au fond des océans. Mais pas seulement ! La chimiolithotrophie peut être compétitive à la lumière du jour, par exemple dans les eaux ferrugineuses ou la rouille, car le fer réducteur requis est très abondant. Montez au microscope le revêtement rouge des ruisseaux ferrugineux et vous verrez la paroi rougie de dépôts ferriques des eubactéries, souvent allongées. La chimiolithotrophie existe aussi dans la matière organique, par exemple les archées méthanogènes des méthaniseurs. Vous l’observez aussi au fond d’eaux où croupissent des feuilles mortes ou sur les marées d’algues vertes en Bretagne, où un voile blanchâtre couvre la matière organique morte : c’est un biofilm d’eubactéries chimiolithotrophes oxydant à l’oxygène le H2S issu de la matière organique en décomposition et déposant des sulfates. La chimiolithotrophie n’est pas qu’un dernier recours, rare et peu compétitif : elle existe autour de nous !
Une autre idée reçue est que la chimiolithotrophie aurait pu être l’un des premiers processus métaboliques sur Terre. Mais à bien y regarder, la plupart des oxydants que les chimiolithotrophes utilisent aujourd’hui étaient quasi absents de la Terre initiale : oxygène, fer ferrique, nitrate, sulfate, etc. Toutes ces substances oxydantes ne sont apparues qu’après l’émergence de la photosynthèse cyanobactérienne, productrice d’oxygène qui, de là, oxyda le fer, l’azote, le soufre pour produire le fer ferrique, le nitrate ou le sulfate ! La plupart des réactions d’oxydo-réduction actuellement utilisées ne furent donc possibles qu’après la mise en place de la photosynthèse. Une exception, toutefois, est la méthanogenèse utilisant du CO2 et du H2 d’origine géologique (par exemple issu de la réaction de l’eau avec les pyroxènes, des minéraux abondants dans la croûte terrestre : le fer ferreux qu’ils contiennent est oxydé par l’eau, en libérant du H2). De telles réactions ont pu exister avant toute photosynthèse… et produire très tôt du méthane sur Terre. Imaginer que la chimiolithotrophie soit ancestrale renvoie à l’impression erronée que ce métabolisme est « devenu marginal ». Il l’est souvent dans nos enseignements de biochimie. Or il ne l’est pas ! Il est à l’origine de l’essentiel du méthane sur Terre, réalise la nitrification, porte le métabolisme des anammoxes (cités plus haut) qui recyclent 50 à 70 % de l’azote soluble dans les océans ! Dans la biosphère profonde, au cœur des roches cristallines de la croûte terrestre, quelle que soit la pression et jusqu’à 120 °C, la chimiolithotrophie est sans doute l’un des métabolismes majeurs : or cette vie profonde, dispersée faute de ressources, représente quand même de 1 à 10 tonnes de microbes par km3 de roche et… plus de 70 % des microbes terrestres. De nos manuels d’enseignement à notre vision du monde, peut-on encore négliger ou mythifier la chimiolithotrophie ?
Liens d’intérêt
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Nous l’avons évoqué dans la chronique de novembre [1] : deux chimiolithotrophes successifs réalisent ce travail, l’un convertissant l’ammonium en nitrite (NO2-) puis l’autre convertissant le nitrite en nitrate.
Nous l’avons évoqué dans la chronique de novembre [1] également : le H2 provient alors de fermentations de la matière organique par des eubactéries.
Références
- Selosse MA. Les déchets, outils du mutualisme parfait ? Med Sci (Paris) 2024 ; 40 : 866–68 [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Garritano AN, Song W, Thomas T. Carbon fixation pathways across the bacterial and archaeal tree of life. PNAS Nexus 2022 ; 1 : pgac226. [CrossRef] [Google Scholar]
- Selosse MA. Jamais seul. Ces microbes qui construisent les plantes, les animaux et les civilisations, (chapitre 5). Actes Sud : Arles, 2017. [Google Scholar]
- Kuenen JG. Anammox and beyond. Environ Microbiol 2020 ; 22 : 525–36. [CrossRef] [PubMed] [Google Scholar]
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1 Diagramme en V renversé récapitulant la chimiolithotrophie dans le cas type des eubactéries. Les potentiels redox vont croissant vers le bas : les flux d’électrons allant vers le bas sont autorisés thermodynamiquement et produisent de l’énergie. Tous les flux d’électrons se font par passage de cytochrome en cytochrome, au sein d’une membrane (membrane plasmique ou vésicule intracellulaire). Une première voie, forme de respiration minérale (en vert), libère de l’énergie qui sert à former un gradient transmembranaire de protons (en jaune). Celui-ci peut, au niveau d’ATPases, former de l’ATP. Une seconde voie, la chaîne de transfert inverse (en bleu), porte des électrons vers les cofacteurs des réductions cellulaire, le NADH,H+ (ou le NADPH,H+, selon l’espèce) : elle consomme une partie du gradient de protons nécessaire à permettre cette oxydo-réduction si elle est thermodynamiquement défavorisée. Insert en bas à droite : bactérie oxydant le nitrate par l’oxygène, Nitrosobacter winogradskyi, en microscopie électrique. ATP : adénosine triphosphate ; CC-O : couplage chimio-osmotique, transférant de l’énergie d’une réaction d’oxydo-réduction à un gradient, ou l’inverse ; e- : électrons. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




