| Numéro |
Med Sci (Paris)
Volume 41, Numéro 6-7, Juin-Juillet 2025
|
|
|---|---|---|
| Page(s) | 578 - 584 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2025096 | |
| Publié en ligne | 7 juillet 2025 | |
La peste à l’ère moderne, comprendre la transmission de la bactérie Yersinia pestis par les puces
Plague in the modern era, understanding the transmission of Yersinia pestis by fleas
Univ. Lille, Inserm, CNRS, CHU Lille, Institut Pasteur de Lille, U1019 — UMR 9017 – CIIL — Center for Infection and Immunity of Lille, Lille, France
La peste, causée par la bactérie Yersinia pestis, demeure une maladie mortelle à l’échelle mondiale. Ce pathogène est transmis principalement par les puces, dans lesquelles il s’adapte à l’environnement hostile de leur tube digestif, s’y multiplie et forme alors un biofilm dense qui obstrue l’entrée de sang. Cette obstruction favorise la transmission de la bactérie par régurgitation lors d’un repas sanguin. Ce processus repose sur un programme moléculaire initié chez le rongeur et prolongé chez l’insecte. Dans cette synthèse, nous décrivons l’environnement dans lequel Y. pestis évolue pour infecter les puces, ainsi que les modes de transmission et les mécanismes moléculaires impliqués, tout en adoptant une approche critique pour mieux comprendre les interactions entre Y. pestis et son vecteur, et explorer de nouvelles stratégies de lutte contre la propagation de l’agent de la peste.
Abstract
Plague, caused by the bacterium Yersinia pestis, remains a deadly disease on a global scale. This pathogen is primarily transmitted by fleas, in which it adapts to the hostile environment of the digestive tract, multiplies, and forms a dense biofilm that obstructs the entry of blood. This obstruction promotes bacterial transmission through regurgitation during a blood meal. This process relies on a molecular program initiated in the rodent and sustained within the insect. In this review, we describe the environment in which Y. pestis evolves to infect fleas, as well as the modes of transmission and the molecular mechanisms involved, while adopting a critical perspective to better understand the interactions between Y. pestis and its vector, and to explore new strategies to control the spread of the plague agent.
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Florent Sebbane).
Maladie mortelle, la peste reste profondément ancrée dans l’inconscient collectif et inspire, encore aujourd’hui, une peur parfois irrationnelle [1]. Cette empreinte sociétale résulte des ravages de trois pandémies1 ayant frappé l’humanité, de l’Antiquité aux temps modernes, causant environ 200 millions de morts. Cette mortalité anormalement élevée, conjuguée à sa rapidité de propagation, a bouleversé les sphères religieuse, culturelle, politique, économique et sanitaire. Par exemple, la mise en quarantaine est une mesure concrète héritée de ces épidémies. Aujourd’hui, la peste est considérée comme une simple curiosité historique en Europe. Pourtant, elle n’a pas disparu. En effet, cette maladie reste endémique dans plusieurs pays d’Afrique, d’Asie et des Amériques, comme l’Algérie, la République démocratique du Congo, Madagascar, la Russie, la Chine, le Pérou ou encore les États-Unis [2].
C’est en 1894, à Hong Kong, qu’Alexandre Yersin réalisa une première avancée majeure dans la compréhension de la peste en isolant son agent causal à partir d’un ganglion infecté (dit bubon) prélevé sur un pestiféré. Il s’agit de la bactérie Yersinia pestis, ainsi nommée en son honneur [3]. Quatre ans plus tard, en 1898, à Karachi, Paul-Louis Simond démontra que la transmission du bacille entre mammifères dépendait d’un insecte hématophage strict : la puce [4]. Il était désormais établi que Y. pestis affecte principalement les rongeurs sauvages, parmi lesquels il circule, et qu’il se transmet entre rongeurs ainsi qu’aux humains par l’intermédiaire des puces. Pourtant, le rôle des puces dans la transmission de la bactérie, et l’étude des mécanismes associés, n’ont suscité que peu d’intérêt. Plus d’un siècle de recherches, intensifiées ces vingt dernières années, ont considérablement amélioré notre compréhension des mécanismes à l’origine des infections transmissibles par les puces. Toutefois, de nombreuses zones d’ombre subsistent.
Les contraintes physiologiques du tube digestif de la puce pour Yersinia pestis
Lorsqu’une puce prend un repas sanguin, le bol alimentaire traverse successivement l’œsophage, le proventricule (une valve hérissée d’épines de chitine orientées vers le lumen) et l’estomac, composé d’un épithélium simple (Figures 1A et B). Immédiatement après la prise sanguine, l’osmolarité du tube digestif est réduite de moitié et certaines molécules plasmatiques facilement assimilables, tel que le lipoate (cofacteur enzymatique essentiel), sont absorbées [5–7]. Simultanément, les mouvements péristaltiques2 et antipéristaltiques de l’estomac, combinés aux pulsations continues du proventricule (dont la région antérieure reste fermée après la prise sanguine) propulsent le bol alimentaire contre les épines de chitine du proventricule. Ce mécanisme provoque une hémolyse complète du sang, libérant son contenu intracellulaire. L’osmolarité du tube digestif est ensuite rétablie à son niveau initial. La digestion s’accompagne également d’une légère acidification du contenu digestif et d’une protéolyse progressive, conduisant à l’accumulation puis à l’absorption des peptides libérés [5–7]. La durée du processus digestif varie selon les espèces de puces et le type de sang ingéré [8]. Quelle que soit cette durée, Y. pestis reste confinée dans le lumen du tube digestif pour être transmise au mammifère, et doit affronter les variations des conditions physico-chimiques, le manque de certains éléments nutritifs, et la réponse immunitaire de la puce (peptides antimicrobiens, lysozyme, stress oxydatif et augmentation des niveaux de cuivre).
 |
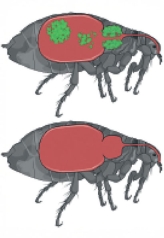
Figure 1 Obstruction du proventricule de la puce par Y. pestis. A et B. Photographie d’une puce saine immédiatement après un repas sanguin et représentation schématique de son tube digestif. Lors de l’ingestion, le sang passe par l’œsophage (E), traverse le proventricule (PV) et atteint l’estomac (Es), tandis que les tubes de Malpighi (M) et le rectum (R) participent à l’excrétion. C et D. Photographies en lumière blanche (à gauche) et en fluorescence (à droite) d’une puce « bloquée » immédiatement après une tentative de prise de repas et de son proventricule. L’insecte, déshydraté en raison de son incapacité à s’alimenter (ce qui explique sa plus petite taille), a réalisé une prise sanguine infructueuse, comme l’indique la présence de sang frais dans la partie supérieure du tube digestif (signalée par les traits noirs), tandis que l’estomac, contenant les restes d’un ancien repas, reste de couleur noire. Ceci est lié à la capacité de Y. pestis (en bleu) à former un biofilm obstruant la lumière du proventricule (auto-fluorescent en vert). Cette obstruction favorise la transmission de Y. pestis par régurgitation. |
Modes et dynamiques de transmission de Yersinia pestis par les puces
Parmi les 2 575 espèces et sous-espèces de puces recensées, plus de 80 peuvent transmettre Y. pestis, avec des efficacités et des durées variables. Certaines espèces, comme la puce du chat, Ctenocephalides felis, transmettent le bacille quelques heures ou quelques jours après un repas sanguin infectieux, mais perdent rapidement cette capacité en l’absence de nouveaux repas contaminés [9, 10]. Ce mode de transmission, appelé « transmission précoce », est relativement peu efficace, car il requiert qu’un grand nombre de puces infectées se nourrissent sur le même hôte. En revanche, d’autres espèces, comme la puce du rat, Xenopsylla cheopis, conservent leur capacité de transmission pendant plus d’un mois, même après l’ingestion de repas non infectés [11–14]. Cette persistance caractérise le mode de transmission dit « par puce bloquée », qui requiert une période d’incubation extrinsèque d’au moins 4 à 5 jours. La puce bloquée se caractérise par sa capacité à aspirer du sang frais dans la partie supérieure de son tube digestif, mais pas dans son estomac (Figure 1C).
Dans les deux modes de transmission, la régurgitation des bactéries depuis la lumière du tube digestif est le mécanisme clé de la transmission de Y. pestis. Cependant, l’origine des bactéries régurgitées lors de la transmission précoce fait l’objet de débats. Une hypothèse initiale propose que des bactéries retenues dans l’œsophage après un repas infectieux sont ensuite évacuées par la salivation lors des premières piqûres suivant le repas infecté [15]. Des études récentes suggèrent, en revanche, que le proventricule pourrait être la principale source des bactéries régurgitées. En effet, dès les premières heures suivant un repas infecté, le lumen de la valve proventriculaire est scellé par une masse molle d’origine inconnue, renfermant de nombreux bacilles concentrés dans sa partie antérieure ainsi que des protéines et des lipides issus du repas sanguin [14, 16, 17]. Chez certains individus, cette masse pourrait entraver l’ingestion de sang sain, entraînant sa contamination et son reflux au point de piqûre. Dans ce modèle, la puce, gênée par cette obstruction, tente à nouveau de se nourrir, déplaçant définitivement vers l’estomac la masse molle contenant les bactéries, ce qui empêche toute transmission prolongée en l’absence de nouveaux repas infectieux.
Pour d’autres espèces, comme X. cheopis, l’infection n’est pas éliminée et se maintient dans le temps. Dans leur cas, la masse molle proventriculaire, formée peu après l’infection, est remplacée par une nouvelle masse enrichie en bactéries à chaque repas sain qui la déloge [14, 16]. Ce cycle de formation, d’évacuation et de remplacement de la masse se répète à chaque repas, jusqu’à ce que les bactéries la colonisent complètement et la durcissent si fortement qu’elle devient indélogeable par le flux sanguin [11, 12, 14] (Figures 1 et 2). À ce stade, la puce, dite « puce bloquée », devient incapable de se nourrir et finit par mourir de faim. Cependant, avant sa mort, la puce multiplie ses tentatives frénétiques de nourrissage, ce qui accroît la probabilité de régurgiter un sang contaminé au point de piqûre et de transmettre ainsi le bacille au mammifère. Ce mécanisme explique pourquoi la transmission par puce bloquée est nettement plus efficace que la transmission précoce.
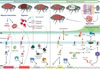 |
Figure 2 Mécanismes moléculaires conduisant à la transmission de Y. pestis par les puces. Schéma illustrant les mécanismes moléculaires employés par Y. pestis dans le tube digestif de la puce pour résister aux stress environnementaux, croître, obstruer définitivement le proventricule et être régurgité dans le derme d’un mammifère, soit dans la partie extravasculaire, soit dans la partie intravasculaire. Le site de régurgitation des bactéries détermine la forme clinique de l’infection : la peste bubonique en cas d’inoculation extravasculaire, et la peste septicémique primaire en cas d’inoculation intravasculaire. ME, membrane externe ; MI, membrane interne ; PAMs, peptides antimicrobiens ; ROS, espèces réactives de l’oxygène ; R5P, ribose-5-phosphate ; Ru5P, ribulose-5-phosphate. Schéma créé avec BioRender. |
Les modèles de transmission dite « précoce » et par « puce bloquée » sont souvent considérés comme distincts, principalement en raison de leur temporalité. Toutefois, s’ils reposent tous deux sur la régurgitation des bactéries depuis le proventricule, leur principale différence tient à la dureté de la masse qui l’obstrue. Autrement dit, quel que soit le mode de transmission, le proventricule est toujours obstrué, mais par une masse dont la résistance au flux sanguin varie. Ainsi, la transmission par puce bloquée s’inscrirait dans un continuum évolutif de la transmission précoce, où un scellement proventriculaire progressif entraînerait une régurgitation accrue et une transmission plus efficace. Un tel modèle met donc en lumière un principe clé : plus la masse se durcit, plus la transmission devient efficace, renforçant l’idée d’un continuum entre « transmission précoce » et transmission par « puce bloquée ».
Les causes du blocage définitif de l’entrée proventriculaire, un phénomène observé uniquement chez certaines espèces de puces, restent encore mal comprises. L’une d’elles est le comportement alimentaire de l’insecte. En effet, chez les puces nécessitant des repas sanguins fréquents – comme la puce du chat (C. felis) – le proventricule ne peut pas être obstrué, car les repas rapprochés éliminent les bactéries avant qu’elles n’aient le temps de consolider une masse obstructive [9]. Par ailleurs, des différences anatomiques entre les proventricules des espèces pourraient également expliquer ces disparités, bien que cette hypothèse reste à confirmer [18]. Enfin, l’obstruction définitive du proventricule suit une distribution gaussienne au sein de la population d’insectes [19]. Il est dès lors possible que différentes capacités de transmission, corrélées à des degrés variés d’obstruction proventriculaire, coexistent dans le temps. Ainsi, un même animal ou groupe d’animaux parasité par plusieurs puces pourrait héberger une puce hautement contagieuse, dont le proventricule est définitivement scellé, aux côtés de puces faiblement contagieuses, dont le proventricule reste obstrué par une masse trop molle pour permettre une transmission efficace du bacille.
Outre le débat sur le continuum entre transmission précoce et transmission par puce bloquée, l’origine des bactéries colonisant le proventricule reste controversée. Un modèle propose que des agrégats bactériens, initialement formés dans l’estomac, remontent vers le proventricule sous l’effet combiné des pulsations proventriculaires et des mouvements péristaltiques, où ils favoriseraient son obstruction [18]. Une autre hypothèse suggère que seules les bactéries piégées dans la partie antérieure du proventricule lors de la dernière gorgée de sang seraient responsables de son scellement définitif [14, 16]. Des études in vivo et ex vivo sont nécessaires pour trancher cette controverse.
Stratégies moléculaires favorisant la transmission de Yersinia pestis par les puces
Les études transcriptomiques, qui analysent l’expression de l’ensemble des gènes, sont couramment employées pour explorer les mécanismes moléculaires impliqués. Il n’est donc pas étonnant qu’elles aient été utilisées pour étudier les interactions entre les puces et Y. pestis. Cette approche a permis de formuler des hypothèses sur la réponse de la puce à l’infection et sur l’adaptation du bacille après ingestion. Plus précisément, les études montrent que la puce déclenche une réponse immunitaire intense dès le début de la phase infectieuse avant de la réduire, probablement pour éviter des dommages irréversibles [20, 21]. Cette réponse implique l’activation des voies de défense IMD (immune deficiency, nom dérivé du gène imd) et Duox-ROS (dual oxidase — reactive oxygen species) ainsi que la stimulation de l’expression des gènes codant des peptides antimicrobiens, le lysozyme et de la production d’espèces réactives de l’oxygène. En accord avec ce scénario, l’analyse transcriptomique de Y. pestis révèle une activation de gènes impliqués dans la gestion du stress membranaire ainsi que dans l’importation de pentoses et d’acides aminés du groupe glutamate [22, 23]. En somme, ces expressions génétiques apparaissent essentielles à l’adaptation et à la multiplication du bacille dans le tube digestif de la puce.
Bien que séduisants, les scénarios fondés sur les données transcriptomiques nécessitent impérativement des validations fonctionnelles. Celles-ci consistent à inactiver les gènes ou voies identifiés afin de confirmer leur rôle dans le processus infectieux. En pratique, ces approches viennent souvent nuancer, voire remettre en question, les hypothèses initiales. Par exemple, le criblage d’une banque de mutants de Y. pestis, dans laquelle chaque mutant est dépourvu d’un gène identifié comme activé dans la puce par une étude transcriptomique, a révélé que seulement 14 mutants sur 164 présentaient un défaut de colonisation dans l’insecte [7, 14]. De plus, les gènes essentiels à l’infection identifiés par ce criblage différaient de ceux suggérés par l’étude transcriptomique. Toutefois, les fonctions supposées de ces 14 mutants soutiennent l’idée que Y. pestis exprime, dans l’insecte, des gènes impliqués dans la résistance aux peptides antimicrobiens ainsi qu’au stress oxydatif et osmotique [7]. Parmi eux, seuls quatre gènes ont fait l’objet d’analyses fonctionnelles approfondies dans le contexte de l’infection chez l’insecte [7, 14].
Finalement, les résultats d’analyses fonctionnelles, aussi cohérents soient-ils avec les scénarios transcriptomiques, doivent être confirmés par des expériences de complémentation. C’est-à-dire qu’il faut systématiquement déterminer si la réintroduction d’une version fonctionnelle du gène supprimé restaure le phénotype sauvage. Cette étape est essentielle pour exclure l’hypothèse d’une mutation secondaire ou d’un effet polaire (c’est-à-dire une modification involontaire de l’expression d’autres gènes causée par l’interruption ou la perturbation d’une unité transcriptionnelle) et ainsi confirmer le rôle spécifique du gène étudié. Dans les faits, les études in vivo avec des mutants complémentés de Y. pestis restent limitées. Ainsi, sur les 32 gènes supposés requis pour une infection transmissible par la puce, seuls 17 ont été confirmés par complémentation [5, 7, 12, 14, 21, 23–38]. Ces derniers ont permis de construire le modèle actuellement proposé (Figure 2), mais leur nombre limité souligne combien notre compréhension des mécanismes de transmission de Y. pestis reste partielle. Cette lacune est d’autant plus marquée que 7 de ces 17 gènes codent des régulateurs dont les programmes d’expression dans l’insecte demeurent largement méconnus.
Quoi qu’il en soit, le modèle actuel (Figure 2) suggère que Y. pestis active chez le rongeur un programme moléculaire lui conférant une résistance à un ou plusieurs éléments nocifs (encore inconnus) présents dans la masse molle proventriculaire de la puce. Ce programme de préadaptation reste encore mal compris, car seuls deux acteurs en ont été identifiés, leur rôle exact restant à préciser. Ces deux gènes, rpiA1 et rpiA2, codent chacun une ribose-phosphate isomérase A, une enzyme catalysant la conversion réversible du ribulose-5-phosphate en ribose-5-phosphate [14]. Cette enzyme pourrait contribuer à la formation d’éléments structuraux essentiels à une membrane capable de résister aux peptides antimicrobiens produits par la puce. Par ailleurs, Y. pestis produit la protéine Ymt (Yersinia murine toxin) qui neutralise un composé toxique issu de la digestion du sang [36]. Cependant, l’efficacité de Ymt varie selon l’origine du sang ingéré : il est indispensable lorsque la puce se nourrit du sang d’une souris ou d’un rat noir, mais elle est dispensable en présence de sang de rat brun [39]. Ainsi, l’acquisition du gène Ymt aurait favorisé la dissémination de Y. pestis en lui permettant d’infecter un plus large éventail d’hôtes. En plus des gènes impliqués dans la résistance immédiate à l’environnement hostile du tube digestif de l’insecte, Y. pestis active un programme moléculaire lui permettant de résister aux composés toxiques issus de la digestion du sang, contrer la réponse immunitaire et acquérir les nutriments nécessaires à sa réplication. Ce programme d’adaptation à l’environnement est orchestré par plusieurs régulateurs, parmi lesquels OxyR (oxidative stress regulator), RovM (regulator of virulence M), CsrA (carbon storage regulator A), YfbA (Yersinia pestis flea biofilm A), PhoP (phosphate regulon protein), CpxR (conjugative plasmid expression regulator) et OmpR (outer membrane protein regulator), qui sont activés en réponse à des stimuli environnementaux [5, 21, 24, 25, 31, 32, 37, 40]. Les trois derniers régulateurs appartiennent à des systèmes à deux composants. Ces systèmes reposent sur un capteur (PhoQ, CpxA, EnvZ), qui s’active par autophosphorylation suite à un stimulus environnemental et transfère ensuite le groupement phosphate à son régulateur (PhoP, CpxR, OmpR).
Aucun stimulus activant ces régulateurs n’a été démontré in vivo, et la plupart des gènes qu’ils contrôlent ainsi que leur rôle dans l’infection restent hypothétiques. Les modèles proposés reposent exclusivement sur des données obtenues in vitro, dont on ne peut affirmer qu’elles reproduisent fidèlement celles rencontrées dans l’insecte. Néanmoins, il est suggéré que les systèmes OxyR, PhoP/PhoQ et CpxA/CpxR aident Y. pestis à échapper à l’immunité de la puce en réponse à des stimuli spécifiques tels que les composés réactifs de l’oxygène pour OxyR, l’acidité du tube digestif pour PhoP/PhoQ, et l’augmentation de la concentration en cuivre pour CpxA/CpxR [21, 24, 32, 40]. Plus précisément, OxyR et CpxA/CpxR participeraient à la résistance au stress oxydatif, associé à la voie Duox-ROS, amplifié par l’augmentation du cuivre et la dégradation de l’hème après un repas. Quant à PhoP/PhoQ, il protégerait la bactérie des peptides antimicrobiens, probablement en favorisant l’ajout d’aminoarabinose3 à sa membrane. Cette modification impliquerait les protéines GalU (UTP-glucose-1-phosphate uridylyltransferase) et ArnB (UDP-4-amino-4-deoxy-L-arabinose aminotransferase), bien que l’impact réel de cet ajout sur la résistance n’ait pas encore été démontré in vivo [33].
En plus du programme de résistance aux défenses immunitaires de la puce, Y. pestis active également celui favorisant sa réplication. Pour cela, elle détecte l’appauvrissement du milieu environnant dû à l’absorption et à l’excrétion du repas sanguin, et en tire parti pour optimiser sa croissance dans l’insecte. Cette situation conduit à l’activation du gène codant le régulateur transcriptionnel RovM, dont le produit stimule l’expression de gènes (non encore identifiés) nécessaires à la croissance dans l’insecte [31]. Par ailleurs, les loci métaboliques lipA (lipoyl synthase), lipB (lipoyl(octanoyl) transferase) et lplA (lipoate-protein ligase A) sont également essentiels à la reproduction bactérienne, car ils assurent la liaison covalente d’un groupement lipoate à des protéines. Ce cofacteur est indispensable au fonctionnement d’enzymes du métabolisme central [7, 41]. Plus particulièrement, LipA et LipB synthétisent le lipoate en deux étapes dans le cytoplasme bactérien. Fait intéressant, la réaction catalysée par LipB serait également réalisée par LplA dans le proventricule, mais pas dans l’estomac. Par ailleurs, LplA catalyse aussi l’attachement direct du lipoate aux enzymes après son acquisition depuis le lumen digestif. Toutefois, LplA utilise uniquement le lipoate lié à des peptides issus de la protéolyse digestive, plutôt que le lipoate libre présent dans le sang du mammifère. En effet, la puce élimine très rapidement la forme libre du lipoate de son tube digestif, la rendant ainsi inutilisable pour la bactérie. Ainsi, LplA ne peut utiliser les peptides lipoylés qu’après la digestion des protéines sanguines, mais avant leur absorption par la puce. Surtout, cela révèle que la bactérie exploite activement la protéolyse de son hôte pour optimiser son infection [7].
Survivre et se multiplier dans le tube digestif de la puce ne suffit pas à assurer une transmission efficace et durable de Y. pestis. C’est pourquoi la bactérie exprime un programme visant à obstruer durablement le tube digestif de l’insecte, favorisant ainsi sa régurgitation lors d’une prise sanguine par une puce infectée. Le processus serait déclenché par la détection d’une carence en nutriments, en particulier par la baisse des sources de carbone comme le glucose, activant le régulateur posttranscriptionnel CsrA. Celui-ci interagit avec la protéine de liaison aux ARN Hfq qui séquestre l’ARNm transcrit à partir du gène hmsT (hemin storage T), empêchant ainsi sa traduction. Une fois cette inhibition levée, l’enzyme HmsT (une diguanylate cyclase) est produite et catalyse la conversion du guanosine triphosphate (GTP) en guanosine monophosphate cyclique dimérique (c-di-GMP), une molécule de signalisation clé dans l’obstruction du tube digestif [25]. Parallèlement, la diminution des nutriments activerait le capteur membranaire EnvZ, qui phosphoryle son régulateur transcriptionnel associé, OmpR [5]. Une fois phosphorylé, OmpR stimule la transcription du gène ompF, favorisant l’absorption de nutriments. Ceux-ci seraient ensuite convertis en xylulose-5-phosphate, puis en ribulose-5-phosphate et en ribose-5-phosphate par les enzymes Rpe (ribulose-5-phosphate-3-epimerase) et RpiA (ribose 5-phosphate isomerase A), respectivement, fournissant ainsi les précurseurs nécessaires à la synthèse du GTP, substrat de HmsT pour la production du c-di-GMP [14]. Y. pestis utilise également une deuxième diguanylate cyclase, HmsD, appartenant au complexe HmsCDE, pour produire du c-di-GMP dans la puce [27]. Finalement, le c-di-GMP synthétisé par HmsT et HmsD active le complexe HmsHFRS, responsable de la production et de l’exportation d’un polysaccharide (le poly-β-1,6-N-acetyl-D-glucosamine) à la surface bactérienne. En s’accumulant autour des cellules bactériennes, ce polymère favorise leur agrégation et consolide la masse molle proventriculaire qui piège Y. pestis aux premières étapes de l’infection. Ainsi, au fil du temps, la masse initialement molle se rigidifie progressivement jusqu’au point de devenir indélogeable par le sang aspiré [12, 14, 16]. La puce est alors dite « bloquée ».
Conséquences cliniques de la transmission de Yersinia pestis par les puces
La puce « bloquée », affamée, pique à de multiples reprises son hôte pour tenter d’assouvir sa faim. Ses tentatives infructueuses de prise de sang érodent la masse bactérienne obstruant l’entrée de son proventricule, si bien que des bactéries (un nombre médian de 80 par puce) finissent par être délogées puis régurgitées généralement dans la matrice extracellulaire du derme, mais parfois directement dans un vaisseau sanguin [13, 42–44] (Figure 2). Depuis le derme, les bactéries migrent vers le ganglion drainant le site d’inoculation, où leur prolifération entraîne un gonflement inflammatoire accompagné de nécrose, d’hémorragie et d’œdème. Cette inflammation caractéristique, appelée bubon, donne son nom à la forme clinique la plus fréquente de la maladie : la peste bubonique. Depuis le ganglion infecté, Y. pestis envahit la circulation sanguine, entraînant une peste septicémique mortelle. Celle-ci se distingue de la peste septicémique primaire, mortelle également, qui survient lorsque la puce inocule directement Y. pestis dans un vaisseau sanguin et se caractérise par l’absence de formation de bubon. Dans les deux cas, la septicémie entraîne une bactériémie massive (> 107 bactéries / mL de sang), un seuil critique pour que le bacille puisse être transmis à la puce et produire une infection transmissible par la puce, assurant ainsi la pérennité du cycle infectieux [13, 45].
Conclusion et perspectives
Depuis les travaux de Paul-Louis Simond en 1898 établissant le rôle des puces dans la transmission de Y. pestis, les recherches ont considérablement amélioré notre compréhension de la progression de l’infection chez l’insecte et des mécanismes moléculaires associés. Chez la puce, l’infection se manifeste par l’obstruction du proventricule par une masse bactérienne, entraînant la régurgitation de sang contaminé au point de piqûre. Ce phénomène repose sur une stratégie adaptative initiée chez le rongeur, qui se prolonge chez l’insecte et permet à Y. pestis de survivre à l’environnement hostile du tube digestif, de se multiplier et de consolider la masse molle qui la piège dans le proventricule aux premières étapes de l’infection. Cependant, cette compréhension reste incomplète. Il demeure incertain pourquoi certaines espèces de puces transmettent Y. pestis plus efficacement que d’autres et quelles sont les différences précises entre la transmission précoce et celle par puce « bloquée ». De plus, bien que des mécanismes moléculaires, notamment ceux impliquant des régulateurs transcriptionnels et des voies métaboliques, aient été identifiés, leur validation fonctionnelle reste encore limitée. Une autre question essentielle concerne les événements précoces suivant l’inoculation du bacille. En effet, la majorité des études reposent sur des modèles expérimentaux où Y. pestis est injectée artificiellement à l’aide d’une aiguille, ignorant ainsi les spécificités du phénotype bactérien dans la puce. Or, les données récentes suggèrent que la bactérie exprime, dans l’insecte, un programme transcriptionnel distinct favorisant sa transmission et son implantation dans l’hôte mammifère. Les recherches futures devront donc s’attacher à décrypter ces processus en intégrant des méthodes physiologiquement plus pertinentes, en adoptant une démarche interdisciplinaire, et en exploitant les technologies de pointe. Finalement, l’élucidation des signaux environnementaux déclenchant ces adaptations chez Y. pestis dans la puce, ainsi que des mécanismes mis en place dans l’insecte pour l’infecter et infecter le rongeur, pourraient non seulement affiner notre compréhension du cycle de transmission du bacille, mais aussi ouvrir la voie à de nouvelles stratégies de lutte contre la peste. En effet, mieux comprendre ces interactions permettrait d’identifier des cibles potentielles pour entraver la transmission du bacille par les puces, réduisant ainsi le risque d’épidémies chez les mammifères, y compris l’humain.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Nous remercions Sébastien Bontemps-Gallo pour la lecture critique du manuscrit. FS et AD ont été en partie soutenus par le projet ERC Synergy-Plague (101118880). Ce travail a bénéficié d’une aide de l’État gérée par l’ANRS MIE au titre de France 2030 portant la référence « ANRS-23-PEPR-MIE 0002 – DEBS Plague ». A. Baillez a bénéficié d’une bourse doctorale de l’École graduée Biologie-Santé de l’Université de Lille.
Références
- Pollitzer R. Plague studies: 10. Control and prevention. Bull World Health Organ 1953 ; 9 : 457–551. [Google Scholar]
- Yang R, Atkinson S, Chen Z, et al. Yersinia pestis and plague: some knowns and unknowns. Zoonoses (Burlingt) 2023 ; 3. [Google Scholar]
- Yersin A. La peste bubonique à Hong-Kong. Ann Inst Pasteur 1894 ; 8: 662–7. [Google Scholar]
- Simond P. La propagation de la peste. Ann Inst Pasteur 1898 ; 12 : 625–87. [Google Scholar]
- Bontemps-Gallo S, Fernandez M, Dewitte A, et al. Nutrient depletion may trigger the Yersinia pestis OmpR-EnvZ regulatory system to promote flea-borne plague transmission. Mol Microbiol 2019 ; 112 : 1471–82. [CrossRef] [PubMed] [Google Scholar]
- Bontemps-Gallo S, Lacroix JM, Sebbane F. What do we know about osmoadaptation of Yersinia pestis? Arch Microbiol 2021 ; 204 : 11. [Google Scholar]
- Bouvenot T, Dewitte A, Bennaceur N, et al. Interplay between Yersinia pestis and its flea vector in lipoate metabolism. ISME J 2021 ; 15 : 1136–49. [CrossRef] [PubMed] [Google Scholar]
- Krasnov BR. Functional and evolutionary ecology of fleas: a model for ecological parasitology (English Edition). Cambridge University Press 2008. [Google Scholar]
- Bland DM, Hinnebusch BJ. Feeding behavior modulates biofilm-mediated transmission of Yersinia pestis by the cat flea, Ctenocephalides felis. PLoS Negl Trop Dis 2016 ; 10 : e0004413. [CrossRef] [PubMed] [Google Scholar]
- Eisen RJ, Borchert JN, Holmes JL, et al. Early-phase transmission of Yersinia pestis by cat fleas (Ctenocephalides felis) and their potential role as vectors in a plague-endemic region of Uganda. Am J Trop Med Hyg 2008 ; 78 : 949–56. [CrossRef] [Google Scholar]
- Bacot AW, Martin CJ. Observations on the mechanism of the transmission of plague by fleas. J Hyg 1914; Plague 13 (Plague Suppl. 3) : 423–39. [Google Scholar]
- Hinnebusch BJ, Perry RD, Schwan TG. Role of the Yersinia pestis hemin storage (hms) locus in the transmission of plague by fleas. Science 1996 ; 273 : 367–70. [CrossRef] [PubMed] [Google Scholar]
- Lorange EA, Race BL, Sebbane F, et al. Poor vector competence of fleas and the evolution of hypervirulence in Yersinia pestis. J Infect Dis 2005 ; 191 : 1907–12. [CrossRef] [PubMed] [Google Scholar]
- Dewitte A, Bouvenot T, Pierre F, et al. A refined model of how Yersinia pestis produces a transmissible infection in its flea vector. PLoS Pathog 2020 ; 16 : e1008440. [CrossRef] [PubMed] [Google Scholar]
- Chouikha I, Hinnebusch BJ. Yersinia-flea interactions and the evolution of the arthropod-borne transmission route of plague. Curr Opin Microbiol 2012 ; 15 : 239–46. [CrossRef] [Google Scholar]
- Dewitte A, Werkmeister E, Pierre F, et al. A widefield light microscopy-based approach provides further insights into the colonization of the flea proventriculus by Yersinia pestis. Appl Environ Microbiol 2023 ; 89 : e0209122. [CrossRef] [Google Scholar]
- Jarrett CO, Leung JM, Motoshi S, et al. Role of the Yersinia pestis phospholipase D (Ymt) in the initial aggregation step of biofilm formation in the flea. mBio 2024 ; 15 : e0012424. [CrossRef] [PubMed] [Google Scholar]
- Hinnebusch BJ, Jarrett CO, Bland DM. “Fleaing” the plague: adaptations of Yersinia pestis to its insect vector that lead to transmission. Annu Rev Microbiol 2017 ; 71 : 215–32. [CrossRef] [Google Scholar]
- Hinnebusch BJ, Bland DM, Bosio CF, J, et al. Comparative ability of Oropsylla montana and Xenopsylla cheopis fleas to transmit Yersinia pestis by two different mechanisms. PLoS Negl Trop Dis 2017 ; 11 : e0005276. [CrossRef] [PubMed] [Google Scholar]
- Bland DM, Martens CA, Virtaneva K, et al. Transcriptomic profiling of the digestive tract of the rat flea, Xenopsylla cheopis, following blood feeding and infection with Yersinia pestis. PLoS Negl Trop Dis 2020 ; 14 : e0008688. [CrossRef] [PubMed] [Google Scholar]
- Zhou W, Russell CW, Johnson KL, et al. Gene expression analysis of Xenopsylla cheopis (Siphonaptera: Pulicidae) suggests a role for reactive oxygen species in response to Yersinia pestis infection. J Med Entomol 2012 ; 49 : 364–70. [CrossRef] [PubMed] [Google Scholar]
- Vadyvaloo V, Jarrett C, Sturdevant D, et al. Analysis of Yersinia pestis gene expression in the flea vector. Adv Exp Med Biol 2007 ; 603 : 192–200. [CrossRef] [Google Scholar]
- Vadyvaloo V, Jarrett C, Sturdevant DE, et al. Transit through the flea vector induces a pretransmission innate immunity resistance phenotype in Yersinia pestis. PLoS Pathog 2010 ; 6 : e1000783. [CrossRef] [PubMed] [Google Scholar]
- Robin B, Dewitte A, Alaimo V, et al. The CpxAR signaling system confers a fitness advantage for flea gut colonization by the plague bacillus. J Bacteriol 2024 ; 206 : e0017324. [CrossRef] [PubMed] [Google Scholar]
- Silva-Rohwer AR, Held K, Sagawa J, et al. CsrA enhances cyclic-di-GMP biosynthesis and Yersinia pestis biofilm blockage of the flea foregut by alleviating Hfq-dependent repression of the hmsT mRNA. mBio 2021 : e0135821. [CrossRef] [PubMed] [Google Scholar]
- Rempe KA, Hinz AK, Vadyvaloo V. Hfq regulates biofilm gut blockage that facilitates flea-borne transmission of Yersinia pestis. J Bacteriol 2012 ; 194 : 2036–40. [CrossRef] [PubMed] [Google Scholar]
- Bobrov AG, Kirillina O, Vadyvaloo V, et al. The Yersinia pestis HmsCDE regulatory system is essential for blockage of the oriental rat flea (Xenopsylla cheopis), a classic plague vector. Environ Microbiol 2015 ; 17 : 947–59. [CrossRef] [PubMed] [Google Scholar]
- Bobrov AG, Kirillina O, Ryjenkov DA, et al. Systematic analysis of cyclic di-GMP signalling enzymes and their role in biofilm formation and virulence in Yersinia pestis. Mol Microbiol 2011 ; 79 : 533–51. [CrossRef] [PubMed] [Google Scholar]
- Sun YC, Koumoutsi A, Jarrett C, et al. Differential control of Yersinia pestis biofilm formation in vitro and in the flea vector by two c-di-GMP diguanylate cyclases. PLoS One 2011 ; 6 : e19267. [CrossRef] [PubMed] [Google Scholar]
- Ren GX, Yan HQ, Zhu H, et al. HmsC, a periplasmic protein, controls biofilm formation via repression of HmsD, a diguanylate cyclase in Yersinia pestis. Environ Microbiol 2014 ; 16 : 1202–16. [CrossRef] [PubMed] [Google Scholar]
- Vadyvaloo V, Hinz AK. A LysR-type transcriptional regulator, RovM, senses nutritional cues suggesting that it is involved in metabolic adaptation of Yersinia pestis to the flea gut. PLoS One 2015 ; 10 : e0137508. [CrossRef] [PubMed] [Google Scholar]
- Rebeil R, Jarrett CO, Driver JD, et al. Induction of the Yersinia pestis PhoP-PhoQ regulatory system in the flea and its role in producing a transmissible infection. J Bacteriol 2013 ; 195 : 1920–30. [CrossRef] [PubMed] [Google Scholar]
- Aoyagi KL, Brooks BD, Bearden SW, et al. LPS modification promotes maintenance of Yersinia pestis in fleas. Microbiology (Reading) 2015 ; 161 : 628–38. [CrossRef] [PubMed] [Google Scholar]
- Darby C, Ananth SL, Tan L, et al. Identification of gmhA, a Yersinia pestis gene required for flea blockage, by using a Caenorhabditis elegans biofilm system. Infect Immun 2005 ; 73 : 7236–42. [CrossRef] [PubMed] [Google Scholar]
- Earl SC, Rogers MT, Keen J, et al. Resistance to innate immunity contributes to colonization of the insect gut by Yersinia pestis. PLoS One 2015 ; 10 : e0133318. [CrossRef] [PubMed] [Google Scholar]
- Hinnebusch BJ, Rudolph AE, Cherepanov P, et al. Role of Yersinia murine toxin in survival of Yersinia pestis in the midgut of the flea vector. Science 2002 ; 296 : 733–5. [CrossRef] [PubMed] [Google Scholar]
- Tam C, Demke O, Hermanas T, et al. YfbA, a Yersinia pestis regulator required for colonization and biofilm formation in the gut of cat fleas. J Bacteriol 2014 ; 196 : 1165–73. [CrossRef] [PubMed] [Google Scholar]
- Price SL, Vadyvaloo V, DeMarco JK, et al. Yersiniabactin contributes to overcoming zinc restriction during Yersinia pestis infection of mammalian and insect hosts. Proc Natl Acad Sci U S A 2021 ; 118 : e2104073118. [CrossRef] [PubMed] [Google Scholar]
- Bland DM, Miarinjara A, Bosio CF, et al. Acquisition of yersinia murine toxin enabled Yersinia pestis to expand the range of mammalian hosts that sustain flea-borne plague. PLoS Pathog 2021 ; 17 : e1009995. [CrossRef] [PubMed] [Google Scholar]
- Vadyvaloo V, Viall AK, Jarrett CO, et al. Role of the PhoP-PhoQ gene regulatory system in adaptation of Yersinia pestis to environmental stress in the flea digestive tract. Microbiology (Reading) 2015 ; 161 : 1198–210. [CrossRef] [PubMed] [Google Scholar]
- Cronan JE. Lipoic acid attachment to proteins: stimulating new developments. Microbiol Mol Biol Rev 2024 ; 88 : e0000524. [CrossRef] [PubMed] [Google Scholar]
- Sebbane F, Jarrett C, Gardner D, et al. The Yersinia pestis caf1M1A1 fimbrial capsule operon promotes transmission by flea bite in a mouse model of bubonic plague. Infect Immun 2009 ; 77 : 1222–9. [CrossRef] [PubMed] [Google Scholar]
- Sebbane F, Jarrett C, Gardner D, et al. Role of the Yersinia pestis yersiniabactin iron acquisition system in the incidence of flea-borne plague. PLoS One 2010 ; 5 : e14379. [CrossRef] [PubMed] [Google Scholar]
- Sebbane F, Jarrett CO, Gardner D, et al. Role of the Yersinia pestis plasminogen activator in the incidence of distinct septicemic and bubonic forms of flea-borne plague. Proc Natl Acad Sci U S A 2006 ; 103 : 5526–30. [CrossRef] [PubMed] [Google Scholar]
- Sebbane F, Gardner D, Long D, et al. Kinetics of disease progression and host response in a rat model of bubonic plague. Am J Pathol 2005 ; 166 : 1427–39. [CrossRef] [Google Scholar]
Liste des figures
 |
Figure 1 Obstruction du proventricule de la puce par Y. pestis. A et B. Photographie d’une puce saine immédiatement après un repas sanguin et représentation schématique de son tube digestif. Lors de l’ingestion, le sang passe par l’œsophage (E), traverse le proventricule (PV) et atteint l’estomac (Es), tandis que les tubes de Malpighi (M) et le rectum (R) participent à l’excrétion. C et D. Photographies en lumière blanche (à gauche) et en fluorescence (à droite) d’une puce « bloquée » immédiatement après une tentative de prise de repas et de son proventricule. L’insecte, déshydraté en raison de son incapacité à s’alimenter (ce qui explique sa plus petite taille), a réalisé une prise sanguine infructueuse, comme l’indique la présence de sang frais dans la partie supérieure du tube digestif (signalée par les traits noirs), tandis que l’estomac, contenant les restes d’un ancien repas, reste de couleur noire. Ceci est lié à la capacité de Y. pestis (en bleu) à former un biofilm obstruant la lumière du proventricule (auto-fluorescent en vert). Cette obstruction favorise la transmission de Y. pestis par régurgitation. |
| Dans le texte | |
 |
Figure 2 Mécanismes moléculaires conduisant à la transmission de Y. pestis par les puces. Schéma illustrant les mécanismes moléculaires employés par Y. pestis dans le tube digestif de la puce pour résister aux stress environnementaux, croître, obstruer définitivement le proventricule et être régurgité dans le derme d’un mammifère, soit dans la partie extravasculaire, soit dans la partie intravasculaire. Le site de régurgitation des bactéries détermine la forme clinique de l’infection : la peste bubonique en cas d’inoculation extravasculaire, et la peste septicémique primaire en cas d’inoculation intravasculaire. ME, membrane externe ; MI, membrane interne ; PAMs, peptides antimicrobiens ; ROS, espèces réactives de l’oxygène ; R5P, ribose-5-phosphate ; Ru5P, ribulose-5-phosphate. Schéma créé avec BioRender. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




