| Issue |
Med Sci (Paris)
Volume 40, Number 3, Mars 2024
|
|
|---|---|---|
| Page(s) | 229 - 231 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024005 | |
| Published online | 22 March 2024 | |
La chaperédoxine CnoX et le contrôle-qualité rédox des substrats du systèmede repliement de protéines GroEL/ES
A molecular assistant for redox quality control of GroEL/ES substrates
1
Département WELBIO, WEL research institute, Wavre, Belgique
2
Institut de Duve, Université catholique de Louvain, Bruxelles, Belgique
Les protéines sont constituées de chaînes linéaires d’acides aminés formant des polypeptides qui adoptent une conformation tridimensionnelle (3D) précise (forme « native ») leur permettant de devenir fonctionnels [1]. Lors de leur synthèse ou en réponse à divers stress, les polypeptides peuvent former des interactions toxiques avec différentes macromolécules, conduisant à leur agrégation ou à leur dégradation. Ces phénomènes sont associés à des pertes de fonctions potentiellement létales pour la cellule. Pour s’en prémunir, les cellules possèdent des réseaux complexes de chaperons moléculaires pour stabiliser et assister certaines protéines dans l’obtention et la préservation de leur forme native.
Parmi ces chaperons, les chaperonines Hsp60 (heat shock protein 60) constituent une classe unique présente dans tous les types de cellules du monde vivant. Leur activité essentielle, dépendante de l’adénosine triphosphate (ATP), est de lutter contre les interactions non productives qui peuvent s’établir entre polypeptides [2]. Les chaperonines se distinguent des autres chaperons par leur architecture : elles forment un complexe de deux anneaux heptamériques adossés l’un à l’autre, contenant chacun une cavité cylindrique. Chaque sous-unité de Hsp60 comporte un domaine de liaison à l’ATP, situé dans la région équatoriale, un domaine intermédiaire, et un domaine apical de liaison aux protéines substrats (Figure 1A). La fonction de Hsp60 est intrinsèquement liée à celle de la protéine essentielle Hsp10. Cette dernière, qui fonctionne comme co-chaperon, adopte une forme de dôme composé de sept sous-unités. En présence de nucléotides, Hsp10 s’associe avec le domaine apical de Hsp60, en agissant comme un couvercle recouvrant un anneau de Hsp60, créant ainsi une cage de repliement (ou cage de Anfinsen). L’association de Hsp10 avec Hsp60 provoque le déplacement de la protéine substrat à l’intérieur de la cage de repliement, où elle bénéficie de quelques secondes pour se replier dans un environnement protégé des interactions extérieures. Le mécanisme de repliement des substrats par les chaperonines est étudié depuis plus d’un demi-siècle. La plupart des études utilisent comme modèle GroEL (homologue de Hsp60) et GroES (homologue de Hsp10) de la bactérie Escherichia coli [3].
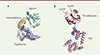 |
Figure 1. A. Structure de l’une des 14 sous-unités composant le complexe GroEL de la bactérie Escherichia coli (PDB 1SS8). Le domaine apical est représenté en cyan, le domaine intermédiaire en marron clair, et le domaine équatorial en bleu. B. Structure du CnoX de E. coli (PDB 3QOU). Le domaine thiorédoxine est représenté en rouge bordeaux, le domaine TPR en rose. Les deux résidus cystéine de CnoX (Cys38 et Cys63) sont représentés en jaune. Cys38 fait partie du motif catalytique typique des thiorédoxines (SXXC chez E. coli), tandis que Cys63 est impliqué dans la formation de complexes disulfures mixtes avec les protéines du substrat, les protégeant ainsi d’une oxydation irréversible. |
Il y a quelques années, des travaux de recherche sur la protéine bactérienne CnoX ont permis sa caractérisation comme chaperon capable de transférer ses substrats à GroEL et GroES pour repliement. Cette découverte inattendue suggérait que des liens fonctionnels entre la chaperonine GroEL et des co-facteurs additionnels restaient à découvrir [4, 5]. CnoX est composée d’un domaine de type thiorédoxine [6] à l’extrémité amino-terminale et d’un domaine tétratricopeptide à l’extrémité carboxy-terminale [7] (Figure 1B). C’est une « chaperédoxine », combinant une fonction de protection rédox de ses substrats — en empêchant l’oxydation irréversible des résidus cystéines — et une activité de chaperon, qui les protège de l’agrégation. CnoX est cependant incapable de replier ses substrats : elle les transfère à des systèmes comme GroEL et GroES, qui utilisent l’énergie fournie par l’ATP pour leur permettre d’atteindre leur état natif [4, 8]. Nous avons cherché à comprendre les mécanismes moléculaires de cette coopération fonctionnelle, et nous avons pu montrer que CnoX interagissait directement avec GroEL afin de contrôler l’état d’oxydation des protéines substrats de cette chaperonine [9]. Nous suggérons que si une cystéine d’un substrat est oxydée (par exemple, formant un acide sulfénique) ou impliquée dans un pont disulfure, CnoX déclenche sa réduction par l’établissement d’un pont disulfure mixte entre CnoX et le substrat, ce qui permettra au substrat de retrouver un état réduit compatible avec son repliement dans la cavité de GroEL. L’existence d’homologues structuraux de CnoX chez certains eucaryotes [9] est en faveur de la conservation de ce mécanisme au cours de l’évolution des espèces.
Nous avons d’abord découvert que CnoX forme un complexe stable avec GroEL dans des bactéries en phase exponentielle de croissance, même en l’absence de stress [9]. Nous avons pu montrer que CnoX et GroEL interagissent physiquement, en utilisant des approches expérimentales complémentaires, telles que la co-immunoprécipitation et la co-purification, et l’affinité de CnoX pour GroEL a été mesurée (Kd = 310 nM). Nous avons ensuite étudié l’impact de GroES sur l’interaction entre GroEL et CnoX : en présence de nucléotides, l’ajout de GroES provoque le détachement de CnoX de la surface de GroEL.
L’imagerie du complexe entre GroEL et CnoX, reconstitué in vitro à partir des protéines purifiées, par cryo-microscopie électronique, a permis d’obtenir la structure de ce complexe avec une résolution de 3,7 Å. Elle a révélé que c’est le domaine carboxy-terminal de CnoX, avec son motif tétratricopeptide, qui interagit avec GroEL (Figure 2). Le domaine thiorédoxine, quant à lui, n’a pas pu être localisé par cette technique, vraisemblablement à cause d’une trop grande flexibilité. Nous avons constaté que l’extrémité C-terminale de CnoX se lie à des résidus appartenant aux hélices K et J du domaine apical de GroEL, à proximité de l’entrée de la cavité de GroEL. Cette zone d’interaction ne correspond pas à celle impliquée dans la liaison de GroEL avec son co-chaperon GroES et les substrats, qui se lient à des acides aminés appartenant aux hélices H et I de GroEL [10]. Nous avons confirmé ces informations structurales en montrant que l’introduction, dans CnoX et GroEL, de certaines mutations affectant des acides aminés situés dans la zone d’interaction entre ces deux protéines empêchait la formation du complexe CnoX-GroEL.
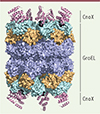 |
Figure 2. Vue latérale de la structure du complexe GroEL-CnoX de Escherichia coli (PDB 7YWY). Les domaines équatorial, intermédiaire et apical de GroEL sont représentés respectivement en bleu, marron clair et cyan, et CnoX est représenté en rose. CnoX se lie à GroEL par l’intermédiaire de son hélice α C-terminale. |
Quelle est donc la fonction biologique de ce complexe ? La détection de complexes covalents entre CnoX et certains substrats de GroEL impliquant la formation d’un pont disulfure inter-protéines conduit à penser que ces ponts disulfures reflètent l’activité de CnoX. En effet, certains substrats de GroEL et de GroES nécessitent plusieurs minutes pour parvenir à la chaperonine et atteindre leur état natif [11], ce qui interroge sur la façon dont leurs acides aminés sont protégés de l’oxydation, notamment les résidus cystéines, qui sont très sensibles à l’action des molécules oxydantes présentes dans la cellule, même en absence de stress oxydant [12] : le groupement thiol de la cystéine est rapidement oxydé en acide sulfénique (-SOH), un dérivé instable qui peut rapidement réagir avec une autre cystéine pour former un pont disulfure, ou qui peut être oxydé irréversiblement en acide sulfinique et sulfonique. Or, pour que les substrats de GroEL puissent se replier dans la cage de repliement, ils ne peuvent présenter des cystéines oxydées ; la présence d’un pont disulfure, par exemple, est incompatible avec le repliement. Notre hypothèse est donc que CnoX, qui combine une activité chaperon à une fonction de protection rédox, sert de système de contrôle et de protection de l’état rédox des substrats de GroEL, avant qu’ils soient « encapsulés » par GroES.
Il conviendra de confirmer la présence, chez les eucaryotes, de modules moléculaires similaires à CnoX associés aux protéines de la famille Hsp60. Ces modules, pourraient remplir une fonction rédox, ou jouer un autre rôle crucial dans le fonctionnement des systèmes de chaperonines.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Anfinsen CB. Principles that govern the folding of protein chains. Science 1973 ; 181 : 223–230. [CrossRef] [PubMed] [Google Scholar]
- Horwich AL, Fenton WA. Chaperonin-assisted protein folding : a chronologue. Q Rev Biophys 2020; 53 : e4. [CrossRef] [PubMed] [Google Scholar]
- Hayer-Hartl M, Bracher A, Hartl FU. The GroEL-GroES chaperonin machine : A nano-cage for protein folding. Trends Biochem Sci 2016 ; 41 : 62–76. [CrossRef] [PubMed] [Google Scholar]
- Goemans CV, Vertommen D, Agrebi R, et al. CnoX is a chaperedoxin : A holdase that protects its substrates from irreversible oxidation. Mol Cell 2018 ; 70 : 614–27.e7. [CrossRef] [PubMed] [Google Scholar]
- Goemans CV, Beaufay F, Arts IS, et al. The chaperone and redox properties of CnoX chaperedoxins are tailored to the proteostatic needs of bacterial species. mBio 2018; 9 : e01541–18. [CrossRef] [PubMed] [Google Scholar]
- Caldas T, Malki A, Kern R, et al. The Escherichia coli thioredoxin homolog YbbN/Trxsc is a chaperone and a weak protein oxidoreductase. Biochem and Biophys Res Commun 2006 ; 343 : 780–786. [CrossRef] [Google Scholar]
- Lin J, Wilson MA. Escherichia coli thioredoxin-like protein YbbN contains an atypical tetratricopeptide repeat motif and is a negative regulator of GroEL. J Biol Chem 2011 ; 286 : 19 459–469. [Google Scholar]
- Dupuy E, Collet J-F. Fort CnoX : protecting bacterial proteins from misfolding and oxidative damage. Front Mol Biosci 2021; 8 : 681 932. [CrossRef] [Google Scholar]
- Dupuy E, der Verren SEV, Lin J, et al. A molecular device for the redox quality control of GroEL/ES substrates. Cell 2023 ; 186 : 1 039-49.e17. [Google Scholar]
- Xu Z, Horwich AL, Sigler PB. The crystal structure of the asymmetric GroEL-GroES- (ADP) 7 chaperonin complex. Nature 1997 ; 388 : 741–50. [CrossRef] [PubMed] [Google Scholar]
- Ewalt KL, Hendrick JP, Houry WA, et al. In vivo observation of polypeptide flux through the bacterial chaperonin system. Cell 1997 ; 90 : 491–500. [CrossRef] [PubMed] [Google Scholar]
- Imlay JA. Cellular defenses against superoxide and hydrogen peroxide. Annu Rev Biochem 2008 ; 77 : 755–776. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. A. Structure de l’une des 14 sous-unités composant le complexe GroEL de la bactérie Escherichia coli (PDB 1SS8). Le domaine apical est représenté en cyan, le domaine intermédiaire en marron clair, et le domaine équatorial en bleu. B. Structure du CnoX de E. coli (PDB 3QOU). Le domaine thiorédoxine est représenté en rouge bordeaux, le domaine TPR en rose. Les deux résidus cystéine de CnoX (Cys38 et Cys63) sont représentés en jaune. Cys38 fait partie du motif catalytique typique des thiorédoxines (SXXC chez E. coli), tandis que Cys63 est impliqué dans la formation de complexes disulfures mixtes avec les protéines du substrat, les protégeant ainsi d’une oxydation irréversible. |
| Dans le texte | |
 |
Figure 2. Vue latérale de la structure du complexe GroEL-CnoX de Escherichia coli (PDB 7YWY). Les domaines équatorial, intermédiaire et apical de GroEL sont représentés respectivement en bleu, marron clair et cyan, et CnoX est représenté en rose. CnoX se lie à GroEL par l’intermédiaire de son hélice α C-terminale. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




