Figure 1.
Télécharger l'image originale
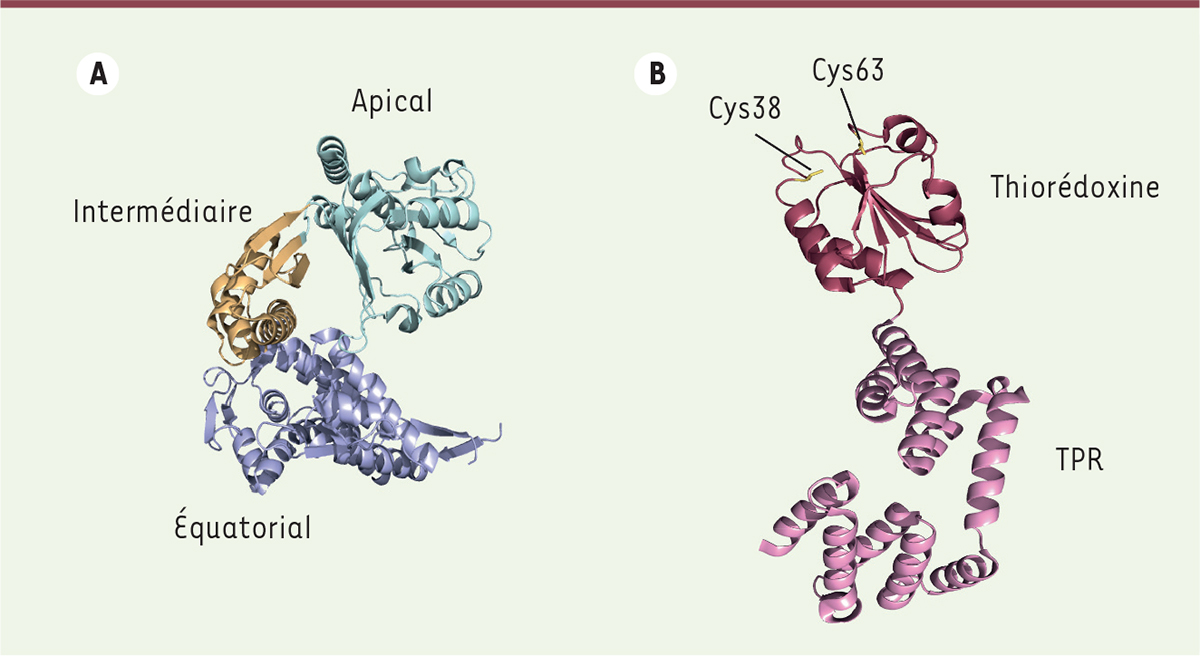
A. Structure de l’une des 14 sous-unités composant le complexe GroEL de la bactérie Escherichia coli (PDB 1SS8). Le domaine apical est représenté en cyan, le domaine intermédiaire en marron clair, et le domaine équatorial en bleu. B. Structure du CnoX de E. coli (PDB 3QOU). Le domaine thiorédoxine est représenté en rouge bordeaux, le domaine TPR en rose. Les deux résidus cystéine de CnoX (Cys38 et Cys63) sont représentés en jaune. Cys38 fait partie du motif catalytique typique des thiorédoxines (SXXC chez E. coli), tandis que Cys63 est impliqué dans la formation de complexes disulfures mixtes avec les protéines du substrat, les protégeant ainsi d’une oxydation irréversible.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




