| Issue |
Med Sci (Paris)
Volume 40, Number 3, Mars 2024
|
|
|---|---|---|
| Page(s) | 231 - 234 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024008 | |
| Published online | 22 March 2024 | |
Maladie du foie gras et stress de réplication de l’ADN
Fatty liver disease and DNA replication stress
1
Centre de recherche des Cordeliers, Sorbonne université, Inserm, Université Paris Cité, Paris, France
2
Laboratoire « Instabilité génomique, métabolisme, immunité et tumorigenèse hépatique », Équipe labellisée par la Ligue nationale contre le cancer, Paris, France
La stéatose hépatique non alcoolique (non-alcoholic fatty liver disease, NAFLD), également connue sous le nom de « maladie du foie gras », désigne l’accumulation anormale de graisse (lipides) dans le foie en l’absence d’une consommation excessive d’alcool. Cette maladie est devenue en quelques années un problème majeur de santé publique à l’échelle internationale [1]. Elle s’accompagne souvent d’un syndrome métabolique incluant obésité, diabète de type 2, hypertension artérielle et dyslipidémie. La prévalence de la stéatose hépatique est estimée entre 25 % et 35 % dans la population générale, à 50 % chez les personnes présentant un diabète de type 2, et jusqu’à 90 % chez celles présentant une obésité morbide. Les lipides qui s’accumulent anormalement dans le foie sont majoritairement des triglycérides [2]. Les acides gras utilisés pour leur synthèse proviennent non seulement du stock plasmatique d’acides gras non estérifiés (issus de la lipolyse dans le tissu adipeux), mais également des acides gras néosynthétisés dans le foie à partir du glucose. Le terme NAFLD englobe un spectre de maladies hépatiques allant de la stéatose hépatique simple à la présence concomitante de lésions hépatocellulaires, telles que les corps de Mallory-Denk1 et la nécro-inflammation lobulaire, définissant la stéatohépatite non alcoolique (non-alcoholic steatohepatitis, NASH). La NASH est un facteur favorisant la formation d’une fibrose [3]. La stéatose hépatique simple est considérée comme une maladie bénigne, mais l’accumulation de lésions hépatiques chroniques dans la NASH augmente considérablement le risque d’évolution vers des maladies hépatiques graves, telles que la cirrhose et le carcinome hépatocellulaire [4, 5]. La stéatose est généralement détectée par des analyses de sang pour évaluer la fonction hépatique, une ultrasonographie, une tomodensitométrie ou une imagerie par résonance magnétique qui évalue l’accumulation de lipides dans le foie. À un stade plus avancé de la maladie, certains tests sanguins permettent de mesurer la progression de la fibrose hépatique (e.g., FibroMètre©, FibroTest©). Par ailleurs, la mesure de la dureté du foie avec un appareil d’élastométrie (e.g., FibroScan©) est décisive pour l’indication d’une biopsie hépatique, dont l’objectif est de déterminer la gravité de l’atteinte hépatique. Cependant, il n’existe pas actuellement de traitement spécifique pour prévenir la progression de la maladie. La meilleure option thérapeutique reste l’adoption d’un mode de vie sain associé à une perte de poids en cas d’obésité, des exercices physiques réguliers, une alimentation équilibrée et la limitation de la consommation d’alcool. Pour les patients diabétiques, le maintien de la glycémie à une valeur optimale est essentiel. Les patients doivent donc être suivis médicalement pour évaluer la progression de la maladie et détecter d’éventuelles complications [1].
L’effet de la stéatose sur l’intégrité génomique
Les hépatocytes sont les premières cellules affectées par la surcharge du foie en lipides. Cette lipotoxicité cellulaire est majoritairement associée à certaines classes de lipides, notamment les acides gras libres saturés (palmitate, stéarate), les diacylglycérols et les céramides [6]. Elle entraîne une défaillance des organelles (e.g., mitochondries, réticulum endoplasmique) et une activation des voies de signalisation pro-apoptotiques, pro-inflammatoires et fibrogéniques. Ce processus induit un cercle vicieux de lyse-régénération des hépatocytes [7]. Le micro-environnement inflammatoire, les anomalies du métabolisme et l’hyperplasie hépatique compensatrice peuvent tous contribuer à la progression de la NAFLD vers des stades plus avancés de la maladie et à la survenue d’un carcinome hépatocellulaire. Les mécanismes précis par lesquels ces facteurs interagissent pour contribuer à une instabilité génomique et au développement tumoral ne sont pas entièrement élucidés. Cependant, on sait que l’accumulation de lipides a un effet délétère sur la prolifération des hépatocytes [8, 9]. Ainsi, chez les personnes ayant un foie stéatosique, les hépatocytes expriment des marqueurs de sénescence, tels que la protéine P21, un raccourcissement des télomères et de nombreux dommages à l’ADN [10]. L’accumulation de lésions d’oxydation de l’ADN (principalement dues aux espèces réactives de l’oxygène) affecte également la division des hépatocytes. Ces lésions d’oxydation sont plus nombreuses dans le foie des personnes présentant une NASH et qui développent un carcinome hépatocellulaire que dans le foie de celles qui n’ont pas de carcinome [11, 12]. Par ailleurs, la comparaison des transcriptomes hépatiques de patients NASH ayant développé ou non un carcinome hépatocellulaire a révélé l’existence d’une altération des voies de réparation de l’ADN dans le tissu hépatique pré-tumoral [13]. Des travaux de recherche antérieurs avaient d’ailleurs permis de montrer, dans des modèles murins de NASH, que le stress oxydant dans les hépatocytes en division active la réponse aux lésions de l’ADN (DNA damage-response) [14, 15]. La prolifération compensatoire des hépatocytes et la réponse aux dommages de l’ADN semblent être déterminants pour le développement du cancer du foie chez les personnes atteintes d’une maladie hépatique chronique, notamment dans un contexte de NAFLD [16]. Nous avons cherché à déterminer les principaux évènements moléculaires qui sous-tendent l’activation de la réponse aux lésions de l’ADN au cours de la NAFLD.
Reprogrammation métabolique, stress de réplication et activation de la voie cGAS-STING dans la NAFLD
La biopsie hépatique étant un geste invasif, l’étude des mécanismes moléculaires et cellulaires de la NAFLD s’effectue principalement dans des modèles murins de la maladie [4]. Les modèles couramment utilisés sont fondés sur des régimes alimentaires riches en lipides (high-fat diet), qui miment le comportement alimentaire humain (alimentation riche en graisses et en sucres, et apport additionnel de sucres par les sodas), et induisent une obésité et une insulino-résistance. Les principaux régimes alimentaires utilisés pour obtenir ces modèles contiennent 40 % de graisses, 0 à 0,2 % de cholestérol, et du saccharose comme principale source de sucre [17]. Après quelques mois d’un tel régime, le foie de ces souris reproduit les caractères histologiques de la maladie hépatique humaine, à savoir la stéatose, puis l’inflammation et la fibrose : leur présence et leur degré permettent d’établir un score d’activité de la maladie (NAFLD activity score) [18].
À partir de foies sains de souris témoins (sous régime alimentaire standard) et de foies stéatosiques de souris NAFLD (Figure 1), nous avons établi des cultures primaires d’hépatocytes et analysé la division de ces cellules. Les hépatocytes stéatosiques présentaient d’une part, un stress de réplication qui entrave la progression des fourches de réplication lors de la phase S du cycle cellulaire, et d’autre part, une activation de la voie de signalisation des lésions de l’ADN [19]. Ces lésions de l’ADN étaient plus graves dans les hépatocytes provenant de souris au stade NASH (cassures double-brin) que dans ceux provenant des souris NAFLD (cassures simple-brin) [19]. Il est à noter que le stress de réplication est l’une des principales causes d’instabilité génomique dans les cellules cancéreuses [19]. La NAFLD s’accompagnant d’une reprogrammation métabolique des hépatocytes, qui joue un rôle majeur dans l’aggravation de la maladie, nous avons recherché si des perturbations métaboliques interféraient avec la machinerie de réplication de l’ADN. Des analyses métabolomiques ont révélé que la stéatose hépatique déstabilise les stocks de désoxynucléotides triphosphates (dNTP), qui sont les précurseurs métaboliques de la molécule d’ADN, et nous avons montré que l’ajout de dNTP dans les cultures d’hépatocytes murins stéatosiques atténue le stress de réplication et l’accumulation de lésions de l’ADN [20]. Enfin, nous avons mis en évidence un lien entre les lésions de l’ADN induites par le stress de réplication dans les hépatocytes NAFLD et l’activation de la voie cGAS-STING2 [20, 21] (→).
(→) Voir la Nouvelle de H. Bacar et M.C. Michallet, m/s n° 6-7, juin-juillet 2021, page 677
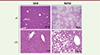 |
Figure 1. Coupes histologiques de foie de souris C57BL/6 J placées sous régime alimentaire standard (foie sain) ou sous régime riche en gras et en sucre (foie NAFLD). Coloration à l’hématoxyline-éosine-Safran. La stéatose dans le foie NAFLD est mixte : les hépatocytes ont un aspect tantôt macrovésiculaire (majoritaire), tantôt microvésiculaire (minoritaire), en rapport avec l’accumulation de lipides dans leur cytoplasme. Grossissement original × 4 ou × 20. |
Ces résultats ont été validés dans un modèle cellulaire humain, puisqu’un traitement d’hépatocytes humains par des acides gras saturés a suffi à induire un stress de réplication, des lésions de l’ADN et l’accumulation de la protéine STING [20].
Conclusion
La stéatose hépatique non alcoolique (NAFLD) est une maladie multifactorielle complexe, qui peut évoluer vers une inflammation chronique du foie, la stéatohépatite (NASH), accompagnée de différents stress des organelles hépatocytaires. La prolifération compensatoire des hépatocytes et les lésions de l’ADN sont des déterminants clés de la survenue d’un cancer du foie chez les personnes ayant une maladie hépatique chronique, notamment dans le contexte de la NAFLD. Nos résultats expérimentaux éclairent les mécanismes par lesquels la présence des lésions de l’ADN dans les hépatocytes stéatosiques pourrait favoriser la progression de la maladie (Figure 2).
 |
Figure 2. Dans un foie stéatosique, la surcharge en graisses induit un stress de réplication lors de la division des hépatocytes. Le déséquilibre du pool de nucléotides est à l’origine de ce stress, et conduit à l’accumulation de lésions de l’ADN, ce qui pourrait favoriser la progression de la maladie du foie gras (Crédit Vanessa Maillet). |
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Cette voie de signalisation est activée notamment par la présence anormale d’ADN cytosolique provenant de fragments d’ADN libérés des fourches de réplication bloquées. La voie cGAS-STING est un médiateur clé de l’inflammation en cas d’infection, de stress cellulaire et de lésions tissulaires [21].
Références
- Younossi Z, Anstee QM, Marietti M, et al. Global burden of NAFLD and NASH : trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol 2018 ; 15 : 11–20. [CrossRef] [PubMed] [Google Scholar]
- Friedman SL, Neuschwander-Tetri BA, Rinella M, et al. Mechanisms of NAFLD development and therapeutic strategies. Nat Med 2018 ; 24 : 908–922. [CrossRef] [PubMed] [Google Scholar]
- Brunt EM, Kleiner DE. Challenges in the hepatic histopathology in non-alcoholic fatty liver disease. Gut 2017 ; 66 : 1539–1540. [CrossRef] [PubMed] [Google Scholar]
- Anstee QM, Reeves HL, Kotsiliti E, et al. From NASH to HCC : current concepts and future challenges. Nat Rev Gastroenterol Hepatol 2019 ; 16 : 411–428. [CrossRef] [PubMed] [Google Scholar]
- Donné R, Lujambio A. The liver cancer immune microenvironment : Therapeutic implications for hepatocellular carcinoma. Hepatology 2023; 77 : 1773–96. [CrossRef] [PubMed] [Google Scholar]
- Marra F, Svegliati-Baroni G. Lipotoxicity and the gut-liver axis in NASH pathogenesis. J Hepatol 2018 ; 68 : 280–295. [CrossRef] [PubMed] [Google Scholar]
- Park EJ, Lee JH, Yu G-Y, et al. Dietary and genetic obesity promote liver inflammation and tumorigenesis by enhancing IL-6 and TNF expression. Cell 2010 ; 140 : 197–208. [CrossRef] [PubMed] [Google Scholar]
- Collin de l’Hortet A, Zerrad-Saadi A, Prip-Buus C, et al. GH administration rescues fatty liver regeneration impairment by restoring GH/EGFR pathway deficiency. Endocrinology 2014 ; 155 : 2545–2554. [CrossRef] [PubMed] [Google Scholar]
- Leclercq IA, Vansteenberghe M, Lebrun VB, et al. Defective hepatic regeneration after partial hepatectomy in leptin-deficient mice is not rescued by exogenous leptin. Lab Invest 2006 ; 86 : 1161–1171. [CrossRef] [PubMed] [Google Scholar]
- Aravinthan A, Scarpini C, Tachtatzis P, et al. Hepatocyte senescence predicts progression in non-alcohol-related fatty liver disease. J Hepatol 2013 ; 58 : 549–556. [CrossRef] [PubMed] [Google Scholar]
- Nishida N, Yada N, Hagiwara S, et al. Unique features associated with hepatic oxidative DNA damage and DNA methylation in non-alcoholic fatty liver disease. J Gastroenterol Hepatol 2016 ; 31 : 1646–1653. [CrossRef] [PubMed] [Google Scholar]
- Tanaka S, Miyanishi K, Kobune M, et al. Increased hepatic oxidative DNA damage in patients with nonalcoholic steatohepatitis who develop hepatocellular carcinoma. J Gastroenterol 2013 ; 48 : 1 249–258. [Google Scholar]
- Pinyol R, Torrecilla S, Wang H, et al. Molecular characterisation of hepatocellular carcinoma in patients with non-alcoholic steatohepatitis. J Hepatol 2021; 75 : 865–878. [CrossRef] [PubMed] [Google Scholar]
- Gentric G, Maillet V, Paradis V, et al. Oxidative stress promotes pathologic polyploidization in nonalcoholic fatty liver disease. J Clin Invest 2015 ; 125 : 981–992. [CrossRef] [PubMed] [Google Scholar]
- Donné R, Saroul-Aïnama M, Cordier P, et al. Polyploidy in liver development, homeostasis and disease. Nat Rev Gastroenterol Hepatol 2020; 17 : 391–405. [CrossRef] [PubMed] [Google Scholar]
- Boege Y, Malehmir M, Healy ME, et al. A Dual role of caspase-8 in triggering and sensing proliferation-associated DNA damage, a key determinant of liver cancer development. Cancer Cell 2017 ; 32 : 342–59.e10. [CrossRef] [PubMed] [Google Scholar]
- Verbeek J, Lannoo M, Pirinen E, et al. Roux-en-Y gastric bypass attenuates hepatic mitochondrial dysfunction in mice with non-alcoholic steatohepatitis. Gut 2015 ; 64 : 673–683. [CrossRef] [PubMed] [Google Scholar]
- Kleiner DE, Brunt EM, Van Natta M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005 ; 41 : 1 313–321. [Google Scholar]
- Ragu S, Matos-Rodrigues G, Lopez BS. Replication stress, DNA damage, inflammatory cytokines and innate immune response. Genes (Basel) 2020; 11 : 409. [CrossRef] [PubMed] [Google Scholar]
- Donné R, Saroul-Ainama M, Cordier P, et al. Replication stress triggered by nucleotide pool imbalance drives DNA damage and cGAS-STING pathway activation in NAFLD. Dev Cell 2022 ; 57 : 1 728-41.e6. [CrossRef] [PubMed] [Google Scholar]
- Bacar H, Michallet MC. La voie cGAS-STING : une nouvelle arme « innée » contre le cancer. Med Sci (Paris) 2021 ; 37 : 677–80. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Coupes histologiques de foie de souris C57BL/6 J placées sous régime alimentaire standard (foie sain) ou sous régime riche en gras et en sucre (foie NAFLD). Coloration à l’hématoxyline-éosine-Safran. La stéatose dans le foie NAFLD est mixte : les hépatocytes ont un aspect tantôt macrovésiculaire (majoritaire), tantôt microvésiculaire (minoritaire), en rapport avec l’accumulation de lipides dans leur cytoplasme. Grossissement original × 4 ou × 20. |
| Dans le texte | |
 |
Figure 2. Dans un foie stéatosique, la surcharge en graisses induit un stress de réplication lors de la division des hépatocytes. Le déséquilibre du pool de nucléotides est à l’origine de ce stress, et conduit à l’accumulation de lésions de l’ADN, ce qui pourrait favoriser la progression de la maladie du foie gras (Crédit Vanessa Maillet). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




