| Issue |
Med Sci (Paris)
Volume 31, Number 6-7, Juin–Juillet 2015
|
|
|---|---|---|
| Page(s) | 638 - 646 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20153106017 | |
| Published online | 07 July 2015 | |
Regard à travers le danio pour mieux comprendre les interactions hôte/pathogène
Looking through zebrafish to study host-pathogen interactions
1
Centre d’étude des pathogènes pour la biotechnologie et la santé (CPBS), CNRS FRE3689, 1919, route de Mende, 34293
Montpellier Cedex 05, France
2
Inserm, CPBS, 1919, route de Mende, 34293
Montpellier Cedex 05, France
3
Laboratoire de dynamique des interactions membranaires normales et pathologiques, CNRS UMR5235, université de Montpellier, place Eugène Bataillon, Montpellier, France
Le danio (zebrafish, poisson zèbre) offre de nombreux avantages qui ont motivé et validé son utilisation récente pour étudier la virulence de plusieurs pathogènes humains. Son système immunitaire, homologue à celui des mammifères, ainsi que la transparence de ses embryons, adaptée au suivi en temps réel des infections via l’utilisation de techniques d’imagerie, en font un modèle d’étude particulièrement innovant. Ses propriétés uniques permettent d’observer et de décrypter les interactions hôte-pathogène au niveau cellulaire, de décrire les événements physiopathologiques propres à chaque pathogène et les mécanismes de défense de l’hôte. Outre ces avantages en recherche fondamentale, ce modèle est également porteur d’applications médicales potentielles dans la découverte de nouvelles molécules anti-infectieuses.
Abstract
The zebrafish offers many advantages that motivated and validated its use to study the virulence of numerous human pathogens, including viruses, bacteria and fungi. Its immune system is homologous to the one of mammals. The optical transparency of zebrafish embryos allows non-invasive and real-time monitoring of the infection processes through the use of imaging techniques. The zebrafish is therefore a useful and powerful model to study host-pathogen interactions at a cellular level. It may be used to describe pathophysiological events and subversion mechanisms that are specific to each pathogen. In addition to increasing our understanding of the host immune defense, this model is of high potential for medical application, being particularly amenable to high-throughput screening for the discovery of new anti-infective molecules.
© 2015 médecine/sciences – Inserm
Dès l’aube de la microbiologie médicale, les scientifiques tels que Louis Pasteur (1822–1895) ont souligné l’« importance de connaître le mode de vie des microorganismes afin de les domestiquer et de contrer leurs éventuels effets néfastes », et ce grâce à l’analyse des relations hôte-pathogène au sein d’un organisme modèle. Les lignées cellulaires, qui permettent de travailler selon des normes méthodologiques et éthiques peu contraignantes, sont souvent utilisées pour démêler quelques étapes importantes de ces interactions hôte-pathogène. Néanmoins, une cellule ne peut reproduire la complexité d’un organisme entier, et l’utilisation des animaux reste à l’heure actuelle incontournable. Ainsi, les modèles mammifères, de la souris au primate, considérés comme hôtes les plus appropriés afin de reproduire fidèlement la réponse immunitaire de l’homme, sont largement exploités. Cependant, dans de nombreux cas, leur utilisation ne permet pas de répondre aux attentes. Ces dernières années ont vu le développement de modèles alternatifs [1]. Parmi ces derniers, la drosophile Drosophila melanogaster [2], le papillon Galleria mellonella [3], le nématode Caenorhabditis elegans [4] et la planaire Dugesia japonica [5] ont permis l’identification de facteurs de virulence et l’analyse de la réponse immunitaire innée au cours d’un processus infectieux. Cette panoplie de « nouveaux » hôtes s’est élargie avec le développement récent du modèle Danio rerio.
Un poisson nommé danio
Très prisé des aquariophiles, le danio (Danio rerio ou zebrafish, poisson zèbre) est un petit poisson téléostéen tropical d’eau douce originaire de l’est de l’Inde. Initialement exploité comme modèle génétique pour l’étude du développement des vertébrés [6], ses nombreux avantages lui ont valu de s’imposer progressivement comme un modèle de choix pour l’étude des maladies infectieuses.
Les avantages du modèle danio
La petite taille du danio permet de maintenir ces poissons au sein d’une population de forte densité. De plus, son temps de génération (âge moyen de reproduction) relativement court et ses excellentes capacités reproductives permettent un élevage en laboratoire aisé et à moindre coût. Contrairement aux modèles mammifères, son développement embryonnaire est externe. De plus, ses embryons sont transparents, ce qui facilite grandement la manipulation de ce modèle animal et un suivi spatiotemporel non invasif du processus infectieux in vivo sur un même animal, à l’aide de techniques d’imagerie. Le séquençage complet de son génome a révélé de nombreuses homologies avec le système immunitaire de l’homme [7]. Comme tous les vertébrés à mâchoires, ce poisson est doté d’un système immunitaire inné et d’un système immunitaire adaptatif, dont la plupart des types et médiateurs cellulaires, ainsi que leurs fonctions, activités et profils d’expression, sont largement conservés [8] (Tableau I). Ainsi, le danio détecte les pathogènes par le biais de l’expression de différents récepteurs qui, une fois activés, induisent des voies de transduction du signal avec la synthèse de facteurs de transcription comme NF-κB, déclenchent la production de chimiokines/cytokines pro-inflammatoires et conditionnent la réponse immunitaire afin d’éliminer les agents infectieux [9]. Alors que la réponse adaptative n’est fonctionnelle qu’après 4 à 6 semaines de développement, la branche innée est la seule composante fonctionnelle au stade embryonnaire précoce, avec la présence dans la circulation sanguine de macrophages actifs dès 25 hpf (heures post-fécondation) et de granulocytes dès 30 hpf (Figure 1). Il apparaît dès lors possible de découpler les deux systèmes, et d’en étudier la contribution propre au cours d’un processus infectieux [10]. Le zebrafish offre aujourd’hui de nombreux outils pour des études de biologie cellulaire, moléculaire et génétique, dont les informations sont regroupées dans des bases de données publiques1. Différentes techniques d’inactivation génique ont été développées, telles que la technologie antisens morpholinos, qui permet d’éteindre transitoirement l’expression d’un gène durant les premiers jours de développement embryonnaire. Son application s’avère très utile pour évaluer la contribution spécifique de cellules ou de gènes impliqués dans la mise en place de la réponse immunitaire innée. Par exemple, l’obtention d’embryons dont on a éliminé les macrophages via l’injection de morpholinos pu.1, gène nécessaire au développement des lignées myéloïdes, a permis de souligner le rôle majeur de ces phagocytes professionnels dans le contrôle des infections à différents pathogènes [11, 12]. De nombreuses lignées transgéniques permettent également d’induire l’expression d’une protéine d’intérêt sous le contrôle d’un promoteur spécifique d’un tissu ou d’un type cellulaire. Ainsi, les lignées exprimant différents fluorochromes sous le contrôle de promoteurs spécifiques des macrophages ou des polynucléaires neutrophiles sont particulièrement remarquables pour l’étude des interactions hôte-pathogène in vivo [12, 13]. En exploitant la transparence des embryons, l’utilisation de bactéries fluorescentes, combinée aux lignées transgéniques, permet de déchiffrer avec une grande précision les interactions hôte-pathogène à l’échelle cellulaire (Figure 2).
 |
Figure 1. Mise en place de l’immunité au cours du développement du zebrafish. hpf : heure post-fécondation ; dpf : jour post-fécondation. |
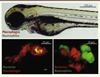 |
Figure 2. Le zebrafish : un formidable outil pour l’étude des interactions hôte-pathogène. L’utilisation d’un embryon transgénique marquant les neutrophiles (vert) et les macrophages (rouge) permet d’étudier in vivo le comportement des leucocytes durant un processus infectieux (haut). Il est par exemple possible d’observer ces cellules immunes phagocytant des bactéries exprimant différents fluorochromes (imagerie confocale, bas). |
Acteurs impliqués dans la réponse immune du zebrafish. TCR : T cell receptor ; TLR : toll-like receptor ; NOD : nucleotide oligomerization domain receptor ; NET : neutrophil extracellular trap ; NITR : novel immune-type receptor ; * : spécifique du zebrafish ; DC-SIGN : dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin ; IFN : interféron ; PRR : pattern recognition receptor.
Les limites du modèle danio
À bien des égards, le danio se positionne comme un hybride entre les modèles invertébrés et mammifères. En tant que vertébré, il est, en termes d’évolution, plus proche de l’homme que le nématode ou la drosophile, et il tolère des études moins coûteuses et laborieuses que le modèle murin. Néanmoins, il présente aussi des inconvénients pouvant entraver l’étude des interactions hôte-pathogène. Bien que ce modèle soit utilisé dans de nombreux laboratoires en complément ou en remplacement des études menées chez la souris, certains outils d’analyses biologiques et génétiques restent inopérants ou limités, tels que l’absence quasi totale d’anticorps monoclonaux dirigés contre des marqueurs de surface, ou de tests ELISA pour le dosage de cytokines. Par ailleurs, alors qu’un des atouts majeurs du danio réside dans sa transparence, rendant possible l’imagerie in vivo à haute résolution, celle-ci ne persiste que 5 à 6 jours, limitant ainsi certaines observations microscopiques dans le temps. L’immunité adaptative n’apparaît qu’à partir d’un mois, il n’est donc pas possible d’examiner le rôle du système immunitaire complet au cours d’un processus infectieux dans l’embryon. Toutefois, ces études peuvent être réalisées chez des mutants dépourvus de pigmentation (comme Casper).
Les danios sont maintenus généralement à une température entre 26 et 29°C, et des températures plus élevées peuvent avoir un effet sur leur viabilité ou leur développement. Or, l’activité de nombreux facteurs de virulence de pathogènes de mammifères est adaptée à la température de leur hôte, soit 37°C. Cette limitation peut affecter les interactions hôte-pathogène et limiter l’extrapolation des données à l’homme. Cependant, plusieurs exemples ont montré que de nombreux pathogènes humains pouvaient être testés dans ce modèle, et que l’expression des gènes de virulence était similaire à celle qui est observée dans le modèle murin. Il existe également d’importantes différences anatomiques entre le danio et les mammifères : la présence de branchies au lieu de poumons, des sites hématopoïétiques différents chez l’embryon et l’adulte, un manque de ganglions lymphatiques discernables, et un système reproducteur très différent. Néanmoins, comme nous le verrons, ce modèle s’est révélé particulièrement adapté à l’analyse et à la compréhension de certains mécanismes de virulence de plusieurs pathogènes pulmonaires humains.
Le danio comme modèle d’infection : étude des relations hôte-pathogène
Méthodes d’infection
Plusieurs pathogènes bactériens ou viraux, connus pour infecter naturellement les poissons et être à l’origine de zoonoses dans les élevages piscicoles, ont été étudiés dans le danio [14]. En conditions naturelles, ils pénétreraient par voie oro-intestinale, par les branchies ou par effraction cutanée suite à une blessure, mais pourraient également être transmis par l’intermédiaire de certains parasites. Des méthodes d’infection visant à reproduire l’histoire naturelle de la contamination, en incubant les poissons adultes/embryons (avec ou sans abrasion dermique préalable) dans une suspension bactérienne, se révèlent peu reproductibles et peu homogènes, en raison de la grande variabilité individuelle dans la réponse à l’infection. Afin de contrôler les doses infectantes, ces pathogènes sont injectés directement dans le poisson anesthésié. Les adultes sont généralement infectés par voie intrapéritonéale ou intramusculaire, tandis que les embryons le sont par micro-injection intraveineuse. Pour l’observation de certains phénomènes tels que le recrutement des phagocytes professionnels au site d’infection, des compartiments clos comme la cavité otique, le ventricule cérébral postérieur ou le muscle sont directement infectés. Une autre voie d’infection est l’injection dans le sac vitellin, particulièrement appropriée pour certaines applications de criblage à haut débit [15].
Aperçu des réponses de l’hôte à différents pathogènes humains dans le modèle danio
Le danio a été utilisé avec succès au cours de ces dernières années pour modéliser les infections causées par plusieurs agents infectieux incriminés dans des pathologies humaines, incluant virus, champignons et bactéries (Tableau II). De nombreuses équipes ont tiré parti de la transparence optique des embryons pour décrire en temps réel les interactions entre ces pathogènes et les phagocytes professionnels du poisson, ainsi que les mécanismes de survie de ces différents agents infectieux [16], dont nous présentons quelques exemples pertinents (Figure 3).
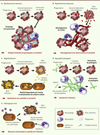 |
Figure 3. Exemples d’interactions zebrafish/pathogène. A. L’injection intraveineuse de M. marinum dans l’embryon entraîne un recrutement rapide des macrophages, lesquels phagocytent les bacilles, traversent l’endothélium vasculaire et transportent le pathogène dans les tissus profonds de l’hôte. Suite à la multiplication intracellulaire du pathogène, les macrophages infectés meurent et sont phagocytés par des neutrophiles, et d’autres macrophages, nouvellement recrutés, permettant aux bacilles d’accéder à de nouvelles cellules hôtes pour s’y multiplier, lesquelles mourront à leur tour et seront prises en charge par des phagocytes toujours plus nombreux, entraînant la formation d’un granulome « primaire ». Certains macrophages infectés peuvent également quitter le granulome primaire pour former un granulome « secondaire » et participeraient donc à l’expansion et à la dissémination du pathogène. B. M. abscessus, injectée par voie intraveineuse, est phagocytée par les macrophages au niveau du site d’injection. Une fois infectés, ces derniers traversent la barrière endothéliale et transportent les bactéries dans les tissus du système nerveux central, soulignant leur rôle clé dans la dissémination du pathogène. Implantés au sein du tissu nerveux, les macrophages infectés entrent en apoptose, libérant ainsi le pathogène dans le milieu extracellulaire ; celui-ci prolifère alors sous la forme de structures en cordes qui, du fait de leur taille (1) protègent les bacilles des phagocytes professionnels, et (2) entraînent le développement d’abcès volumineux. C. L’infection par S. flexneri se caractérise initialement par la prise en charge rapide des bactéries par les macrophages. Dans ces cellules, le pathogène est capable de s’échapper du phagosome puis de se multiplier dans le cytosol jusqu’à provoquer la mort du phagocyte malgré un contrôle partiel de l’infection (autophagie). Parallèlement, la bactérie va envahir les cellules non immunes grâce à la formation de comètes d’actine et provoquer leur apoptose. L’infection non contrôlée génère une bactériémie conduisant à la mort du poisson. D. Dans l’infection par A. fumigatus, les spores sont rapidement prises en charge par les macrophages et détruites, alors que les neutrophiles contrôlent la prolifération des hyphes. Ainsi, l’action conjointe des macrophages et des neutrophiles permet d’endiguer l’infection. E. Suite à l’injection, le CHIKV va infecter de façon non spécifique les cellules de l’embryon. À l’exception de cellules du cerveau, les cellules infectées vont mourir d’apoptose. De ce fait, le cerveau constitue un réservoir viral. La forte réponse interféron (IFN) oriente les cellules encore non infectées vers un état antiviral empêchant la propagation de l’infection. |
Pathogènes humains étudiés dans le modèle zebrafish (adulte et embryon). Modèles : A, adulte ; E, embryon. Voies d’infection : iv, intraveineuse ; im, intramusculaire ; v, vitellus ; ip, intrapéritonéale. NOS : nitric oxide synthase ; TNFa : tumor necrosis factor a ; IL- : interleukine ; IFN : interféron.
Mycobacterium marinum
C’est un pathogène naturel des poissons qui est étroitement apparenté à Mycobacterium tuberculosis, l’agent de la tuberculose. Il développe chez son hôte des caractéristiques physiopathologiques très proches de celles observées dans la tuberculose humaine, en particulier le développement de granulomes tuberculeux [17]. La description des mécanismes cellulaires et moléculaires impliqués dans la formation des granulomes est cruciale pour mieux comprendre la physiopathologie de la tuberculose, et concevoir des traitements efficaces. Or, le modèle murin se révèle peu adapté au décryptage des événements conduisant à la formation des granulomes, soulignant la nécessité de développer des modèles alternatifs. Avec la possibilité d’observer et d’analyser in vivo les premières étapes de la formation des granulomes dans le temps et dans l’espace, le couple M. marinum/danio a permis des avancées considérables dans la compréhension de la pathogénie tuberculeuse, offrant une nouvelle vision du rôle de la réponse granulomateuse. Ainsi, alors que la mobilisation de l’immunité adaptative a longtemps été considérée comme le prérequis indispensable pour la formation et le maintien du granulome tuberculeux, chez l’embryon de danio, une infection par M. marinum est associée au développement de structures granulomateuses, montrant que le système immunitaire inné est suffisant pour induire la formation de granulomes précoces. De plus, alors que le granulome était traditionnellement perçu comme un système défensif de l’hôte visant à contenir l’infection, sa mise en place se ferait en fait au bénéfice du pathogène. Les études du couple M. marinum/danio révèlent en effet que le bacille exploite les macrophages et les granulomes pour favoriser son expansion et sa dissémination [18] (Figure 3A). M. marinum reste à l’heure actuelle le pathogène le mieux caractérisé dans le zebrafish.
Mycobacterium abscessus
Mycobacterium abscessus est un pathogène émergent responsable d’un large spectre de symptômes chez l’homme et en particulier de graves atteintes pulmonaires chez les patients souffrant de mucoviscidose. Il n’existe actuellement aucun vaccin contre ce pathogène, et l’utilisation d’antibiotiques se heurte à la multirésistance naturelle de cette bactérie. Ces infections sont associées au développement de lésions granulomateuses pseudotuberculeuses. Cependant, les déterminants de virulence requis pour le développement de la maladie demeurent inconnus, en raison du nombre restreint de modèles expérimentaux disponibles, modèles par ailleurs peu pertinents - notamment la souris -, les souches immunocompétentes n’étant pas permissives à l’infection [19]. La description de certaines caractéristiques physio- et immunopathologiques de ces infections a néanmoins été possible grâce au développement du danio comme nouveau modèle d’étude de la virulence de M. abscessus [12]. La bactérie induit une infection létale caractérisée par le développement d’abcès au niveau du système nerveux central. Ces premiers résultats remarquables corroborent les données cliniques récentes identifiant le pathogène dans des lésions du cerveau chez certains patients. Parallèlement, ces études ont montré le rôle jusqu’alors insoupçonné de structures appelées « cordes » mycobactériennes comme nouveau mécanisme d’échappement au système immunitaire [20]. La taille démesurée de ces cordes par rapport à celle des macrophages ou des neutrophiles représenterait un moyen pour la bactérie d’échapper à la phagocytose, de promouvoir sa multiplication extracellulaire et d’assurer la progression létale du processus infectieux (Figure 3B).
Shigella flexneri
Shigella flexneri est une bactérie responsable de la dysenterie chez l’homme. Elle affecte essentiellement le tube digestif où les bactéries se multiplient au sein des cellules épithéliales et se propagent de cellules en cellules grâce à leur motilité dépendant de l’actine, provoquant une inflammation de la muqueuse intestinale. La prise en charge des bactéries par les macrophages résidents de l’épithélium intestinal permet au pathogène d’optimiser son infiltration dans le tissu et d’envahir plus efficacement les cellules de l’intestin. Cette niche de survie et de réplication dans les macrophages est fondamentale pour permettre la diffusion et la colonisation massive de l’épithélium intestinal. Les stades avancés peuvent conduire à une bactériémie se traduisant par une septicémie. L’utilisation du modèle danio pour l’étude de S. flexneri a montré que les bactéries sont capables de survivre au sein de leur hôte en se répliquant à la fois dans les macrophages et les cellules non phagocytaires, par le biais notamment de la formation de comètes d’actine, conduisant à une bactériémie non contrôlée et à la mort rapide du poisson (Figure 3C). Le modèle s’est révélé également particulièrement puissant pour mettre en évidence l’importance de l’autophagie dans le contrôle de cette infection [21].
Aspergillus fumigatus
Aspergillus fumigatus est actuellement le champignon pathogène le plus fréquemment incriminé dans les cas d’aspergillose chez l’homme [22]. La contamination se fait par voie aérienne via l’absorption de spores fongiques qui prolifèrent dans les poumons sous la forme d’hyphes. La maladie s’attaque en particulier aux patients immunodéprimés, et peut entraîner des dommages pulmonaires irréversibles en l’absence de traitement, conduisant à une issue fatale dans les cas les plus graves. Bien que l’immunité innée représente la défense prédominante de l’hôte face au champignon, sa contribution exacte au contrôle de l’infection reste mal évaluée. Le modèle danio a permis d’établir le rôle crucial des macrophages et des neutrophiles dans le contrôle de l’infection. À l’instar des infections chez l’homme, seul l’embryon immunocompétent est en mesure de contenir la prolifération d’A. fumigatus grâce à l’action combinée de ces deux phagocytes professionnels. Chez le poisson, ces populations phagocytaires innées montrent par ailleurs des préférences pour l’une ou l’autre des morphologies fongiques (Figure 3D). La possibilité de visualiser les symptômes particulièrement marqués chez le danio infecté par A. fumigatus ouvre la voie à une meilleure compréhension du rôle majeur du système immunitaire inné dans le contrôle de ces infections [23].
Le virus du chikungunya
Le virus du chikungunya (CHIKV), transmis à l’homme par l’intermédiaire du moustique tigre, provoque chez les patients des douleurs articulaires aiguës fortement invalidantes et une réponse inflammatoire marquée. Bien que ces infections se caractérisent par un tropisme tissulaire et cellulaire non spécifique, des formes neurologiques graves, se déclinant sous forme de méningoencéphalites et d’atteintes des nerfs périphériques, principalement rencontrées chez des personnes immunodéprimées et chez des nouveau-nés, ont également été décrites. Aujourd’hui, les traitements existants sont uniquement symptomatiques, soulignant la nécessité de mieux comprendre le cycle de vie du virus. L’utilisation de l’embryon de danio s’est révélée particulièrement prometteuse pour l’étude du virus, avec des observations similaires à celles qui sont rapportées chez l’homme (Figure 3E). En effet, l’injection du CHIKV dans le poisson se caractérise par une infection cellulaire non spécifique et la formation d’un réservoir viral dans le cerveau. Malgré une forte apoptose cellulaire, le déclenchement d’une importante réponse interféron par les neutrophiles conditionne la survie des embryons infectés [24].
Vers de nouvelles perspectives thérapeutiques ?
Grâce à l’apport du danio, la compréhension approfondie des stratégies mises en place par les pathogènes afin de persister chez l’hôte et de contourner les défenses immunitaires de ce dernier pourrait conduire à l’identification de nouvelles cibles thérapeutiques et offrir des possibilités de développements thérapeutiques innovants. Alors que les modèles pharmacologiques et pharmacocinétiques mammifères sont très onéreux et nécessitent l’utilisation de grandes quantités de composés, l’embryon de danio est très attractif pour la découverte de nouvelles molécules actives à visée thérapeutique [25]. Sa petite taille, permettant un maintien en volumes réduits et sa perméabilité facilitant l’assimilation de petites molécules, avec l’avantage de pouvoir directement administrer le traitement dans le milieu d’incubation, rendent ce modèle particulièrement avantageux pour le criblage à haut débit de composés anti-infectieux. Grâce à la transparence des danios, il est possible de visualiser et quantifier les éventuels effets toxiques ou tératogènes survenant à la suite du traitement, ainsi que l’efficacité microbicide ou microbiostatique des composés sur des embryons infectés ; ceci grâce à un suivi de la mortalité et de la progression de l’infection via l’utilisation de bactéries fluorescentes. Ces dernières années ont vu le succès grandissant du danio pour tester l’efficacité de différents composés antimicrobiens [19, 26, 27] avec notamment le développement de plates-formes automatisées propices au criblage à haut débit [28]. En testant rapidement de larges chimiothèques2, il est dorénavant possible d’identifier de nouvelles molécules antimicrobiennes, première étape vers de futurs traitements.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Les auteurs remercient l’Agence nationale de la recherche (DIMYVIR ANR-13-BSV3-007-01) ainsi que la communauté européenne (FP7-PEOPLE-2011-ITN) dans le cadre du projet FishForPharma pour leur soutien à ce projet.
International resource center (http://zebrafish.org/zirc/home/guide.php) et Zebrafish Information Network Zebrafish (http://zfin.org/).
Références
- López Hernández Y, Yero D, Pinos-Rodríguez JM, et al. Animals devoid of pulmonary system as infection models in the study of lung bacterial pathogens. Front Microbiol 2015 ; 6 : 38. [CrossRef] [PubMed] [Google Scholar]
- Lemaitre B, Reichhart JM, Hoffmann JA. Drosophila host defense: differential induction of antimicrobial peptide genes after infection by various classes of microorganisms. Proc Natl Acad Sci USA 1997 ; 94 : 14614–14619. [CrossRef] [Google Scholar]
- Sprynski N, Valade E, Neulat-Ripoll F. Galleria mellonella as an infection model for select agents. Methods Mol Biol 2014 ; 1197 : 3–9. [CrossRef] [PubMed] [Google Scholar]
- Tan MW, Mahajan-Miklos S, Ausubel FM. Killing of Caenorhabditis elegans by Pseudomonas aeruginosa used to model mammalian bacterial pathogenesis. Proc Natl Acad Sci USA 1999 ; 96 : 715–720. [CrossRef] [Google Scholar]
- Abnave P, Mottola G, Gimenez G, et al. Screening in planarians identifies MORN2 as a key component in LC3-associated phagocytosis and resistance to bacterial infection. Cell Host Microbe 2014 ; 16 : 338–350. [CrossRef] [PubMed] [Google Scholar]
- Streisinger G, Walker C, Dower N, et al. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature 1981 ; 291 : 293–296. [CrossRef] [PubMed] [Google Scholar]
- Howe K, Clark MD, Torroja CF, et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature 2013 ; 496 : 498–503. [CrossRef] [PubMed] [Google Scholar]
- Levraud JP, Boudinot P. Arche de Noé immunologique - Le système immunitaire des poissons téléostéens. Med Sci (Paris) 2009 ; 25 : 405–411. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Vaart M van der, Spaink HP, Meijer AH. Pathogen recognition and activation of the innate immune response in zebrafish. Adv Hematol 2012 ; 2012 : 159807. [PubMed] [Google Scholar]
- Lam SH, Chua HL, Gong Z, et al. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev Comp Immunol 2004 ; 28 : 9–28. [CrossRef] [PubMed] [Google Scholar]
- Clay H, Davis JM, Beery D, et al. Dichotomous role of the macrophage in early Mycobacterium marinum infection of the zebrafish. Cell Host Microbe 2007 ; 2 : 29–39. [CrossRef] [PubMed] [Google Scholar]
- Bernut A, Herrmann J-L, Kissa K, et al. Mycobacterium abscessus cording prevents phagocytosis and promotes abscess formation. Proc Natl Acad Sci USA 2014 ; 111 : E943–E952. [CrossRef] [Google Scholar]
- Renshaw SA, Loynes CA, Trushell DMI, et al. A transgenic zebrafish model of neutrophilic inflammation. Blood 2006 ; 108 : 3976–3978. [CrossRef] [PubMed] [Google Scholar]
- Rowe HM, Withey JH, Neely MN. Zebrafish as a model for zoonotic aquatic pathogens. Dev Comp Immunol 2014 ; 46 : 96–107. [CrossRef] [PubMed] [Google Scholar]
- Benard EL, Sar AM van der, Ellett F, et al. Infection of zebrafish embryos with intracellular bacterial pathogens. J Vis Exp 2012 ; 61 : e3781. doi: 10.3791/3781. [Google Scholar]
- Torraca V, Masud S, Spaink HP, et al. Macrophage-pathogen interactions in infectious diseases: new therapeutic insights from the zebrafish host model. Dis Model Mech 2014 ; 7 : 785–797. [CrossRef] [PubMed] [Google Scholar]
- Ramakrishnan L. Looking within the zebrafish to understand the tuberculous granuloma. Adv Exp Med Biol 2013 ; 783 : 251–266. [CrossRef] [PubMed] [Google Scholar]
- Davis JM, Ramakrishnan L. The role of the granuloma in expansion and dissemination of early tuberculous infection. Cell 2009 ; 136 : 37–49. [CrossRef] [PubMed] [Google Scholar]
- Bernut A, Moigne V Le, Lesne T, et al. In vivo assessment of drug efficacy against Mycobacterium abscessus using the embryonic zebrafish test system. Antimicrob Agents Chemother 2014 ; 58 : 4054–4063. [CrossRef] [PubMed] [Google Scholar]
- Bernut A, Herrmann JL, Lutfalla G, et al. Les cordes mycobactériennes - Un nouveau moyen d’échappement au système immunitaire ? Med Sci (Paris) 2014 ; 30 : 499–502. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Mostowy S, Boucontet L, Mazon Moya MJ, et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. PLoS Pathog 2013 ; 9 : e1003588. [CrossRef] [PubMed] [Google Scholar]
- Lamoth F, Bochud PY. Aspergillose invasive : perspectives en infectiologie préventive. Med Sci (Paris) 2009 ; 25 : 669–672. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Knox BP, Deng Q, Rood M, et al. Distinct innate immune phagocyte responses to Aspergillus fumigatus conidia and hyphae in zebrafish larvae. Eukaryotic Cell 2014 ; 13 : 1266–1277. [CrossRef] [PubMed] [Google Scholar]
- Palha N, Guivel-Benhassine F, Briolat V, et al. Real-time whole-body visualization of chikungunya virus infection and host interferon response in zebrafish. PLoS Pathog 2013 ; 9 : e1003619. [CrossRef] [PubMed] [Google Scholar]
- Zon LI, Peterson RT. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov 2005 ; 4 : 35–44. [CrossRef] [PubMed] [Google Scholar]
- Adams KN, Takaki K, Connolly LE, et al. Drug tolerance in replicating mycobacteria mediated by a macrophage-induced efflux mechanism. Cell 2011 ; 145 : 39–53. [CrossRef] [PubMed] [Google Scholar]
- Makarov V, Lechartier B, Zhang M, et al. Towards a new combination therapy for tuberculosis with next generation benzothiazinones. EMBO Mol Med 2014 ; 6 : 372–383. [CrossRef] [PubMed] [Google Scholar]
- Spaink HP, Cui C, Wiweger MI, et al. Robotic injection of zebrafish embryos for high-throughput screening in disease models. Methods 2013 ; 62 : 246–254. [CrossRef] [PubMed] [Google Scholar]
- Van der Sar AM, Appelmelk BJ, Vandenbroucke-Grauls CMJE, et al. A star with stripes: zebrafish as an infection model. Trends Microbiol 2004 ; 12 : 451–457. [CrossRef] [PubMed] [Google Scholar]
- Vergunst AC, Meijer AH, Renshaw SA, et al. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infect Immun 2010 ; 78 : 1495–1508. [CrossRef] [PubMed] [Google Scholar]
- Clatworthy AE, Lee JSW, Leibman M, et al. Pseudomonas aeruginosa infection of zebrafish involves both host and pathogen determinants. Infect Immun 2009 ; 77 : 1293–1303. [CrossRef] [PubMed] [Google Scholar]
- Paranjpye RN, Myers MS, Yount EC, et al. Zebrafish as a model for Vibrio parahaemolyticus virulence. Microbiology 2013 ; 159 : 2605–2615. [CrossRef] [PubMed] [Google Scholar]
- Davis JM, Haake DA, Ramakrishnan L. Leptospira interrogans stably infects zebrafish embryos, altering phagocyte behavior and homing to specific tissues. PLoS Negl Trop Dis 2009 ; 3 : e463. [CrossRef] [PubMed] [Google Scholar]
- Levraud JP, Disson O, Kissa K, et al. Real-time observation of Listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infect Immun 2009 ; 77 : 3651–3660. [CrossRef] [PubMed] [Google Scholar]
- Prajsnar TK, Cunliffe VT, Foster SJ, et al. A novel vertebrate model of Staphylococcus aureus infection reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cell Microbiol 2008 ; 10 : 2312–2325. [CrossRef] [PubMed] [Google Scholar]
- Rounioja S, Saralahti A, Rantala L, et al. Defense of zebrafish embryos against Streptococcus pneumoniae infection is dependent on the phagocytic activity of leukocytes. Dev Comp Immunol 2012 ; 36 : 342–348. [CrossRef] [PubMed] [Google Scholar]
- Patterson H, Saralahti A, Parikka M, et al. Adult zebrafish model of bacterial meningitis in Streptococcus agalactiae infection. Dev Comp Immunol 2012 ; 38 : 447–455. [CrossRef] [PubMed] [Google Scholar]
- Prajsnar TK, Renshaw SA, Ogryzko NV, et al. Zebrafish as a novel vertebrate model to dissect enterococcal pathogenesis. Infect Immun 2013 ; 81 : 4271–4279. [CrossRef] [PubMed] [Google Scholar]
- Davis JM, Clay H, Lewis JL, et al. Real-time visualization of Mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity 2002 ; 17 : 693–702. [CrossRef] [PubMed] [Google Scholar]
- Chao CC, Hsu PC, Jen CF, et al. Zebrafish as a model host for Candida albicans infection. Infect Immun 2010 ; 78 : 2512–2521. [CrossRef] [PubMed] [Google Scholar]
- Burgos JS, Ripoll-Gomez J, Alfaro JM, et al. Zebrafish as a new model for herpes simplex virus type 1 infection. Zebrafish 2008 ; 5 : 323–333. [CrossRef] [PubMed] [Google Scholar]
Liste des tableaux
Acteurs impliqués dans la réponse immune du zebrafish. TCR : T cell receptor ; TLR : toll-like receptor ; NOD : nucleotide oligomerization domain receptor ; NET : neutrophil extracellular trap ; NITR : novel immune-type receptor ; * : spécifique du zebrafish ; DC-SIGN : dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin ; IFN : interféron ; PRR : pattern recognition receptor.
Pathogènes humains étudiés dans le modèle zebrafish (adulte et embryon). Modèles : A, adulte ; E, embryon. Voies d’infection : iv, intraveineuse ; im, intramusculaire ; v, vitellus ; ip, intrapéritonéale. NOS : nitric oxide synthase ; TNFa : tumor necrosis factor a ; IL- : interleukine ; IFN : interféron.
Liste des figures
 |
Figure 1. Mise en place de l’immunité au cours du développement du zebrafish. hpf : heure post-fécondation ; dpf : jour post-fécondation. |
| Dans le texte | |
 |
Figure 2. Le zebrafish : un formidable outil pour l’étude des interactions hôte-pathogène. L’utilisation d’un embryon transgénique marquant les neutrophiles (vert) et les macrophages (rouge) permet d’étudier in vivo le comportement des leucocytes durant un processus infectieux (haut). Il est par exemple possible d’observer ces cellules immunes phagocytant des bactéries exprimant différents fluorochromes (imagerie confocale, bas). |
| Dans le texte | |
 |
Figure 3. Exemples d’interactions zebrafish/pathogène. A. L’injection intraveineuse de M. marinum dans l’embryon entraîne un recrutement rapide des macrophages, lesquels phagocytent les bacilles, traversent l’endothélium vasculaire et transportent le pathogène dans les tissus profonds de l’hôte. Suite à la multiplication intracellulaire du pathogène, les macrophages infectés meurent et sont phagocytés par des neutrophiles, et d’autres macrophages, nouvellement recrutés, permettant aux bacilles d’accéder à de nouvelles cellules hôtes pour s’y multiplier, lesquelles mourront à leur tour et seront prises en charge par des phagocytes toujours plus nombreux, entraînant la formation d’un granulome « primaire ». Certains macrophages infectés peuvent également quitter le granulome primaire pour former un granulome « secondaire » et participeraient donc à l’expansion et à la dissémination du pathogène. B. M. abscessus, injectée par voie intraveineuse, est phagocytée par les macrophages au niveau du site d’injection. Une fois infectés, ces derniers traversent la barrière endothéliale et transportent les bactéries dans les tissus du système nerveux central, soulignant leur rôle clé dans la dissémination du pathogène. Implantés au sein du tissu nerveux, les macrophages infectés entrent en apoptose, libérant ainsi le pathogène dans le milieu extracellulaire ; celui-ci prolifère alors sous la forme de structures en cordes qui, du fait de leur taille (1) protègent les bacilles des phagocytes professionnels, et (2) entraînent le développement d’abcès volumineux. C. L’infection par S. flexneri se caractérise initialement par la prise en charge rapide des bactéries par les macrophages. Dans ces cellules, le pathogène est capable de s’échapper du phagosome puis de se multiplier dans le cytosol jusqu’à provoquer la mort du phagocyte malgré un contrôle partiel de l’infection (autophagie). Parallèlement, la bactérie va envahir les cellules non immunes grâce à la formation de comètes d’actine et provoquer leur apoptose. L’infection non contrôlée génère une bactériémie conduisant à la mort du poisson. D. Dans l’infection par A. fumigatus, les spores sont rapidement prises en charge par les macrophages et détruites, alors que les neutrophiles contrôlent la prolifération des hyphes. Ainsi, l’action conjointe des macrophages et des neutrophiles permet d’endiguer l’infection. E. Suite à l’injection, le CHIKV va infecter de façon non spécifique les cellules de l’embryon. À l’exception de cellules du cerveau, les cellules infectées vont mourir d’apoptose. De ce fait, le cerveau constitue un réservoir viral. La forte réponse interféron (IFN) oriente les cellules encore non infectées vers un état antiviral empêchant la propagation de l’infection. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




