Figure 1.
Télécharger l'image originale
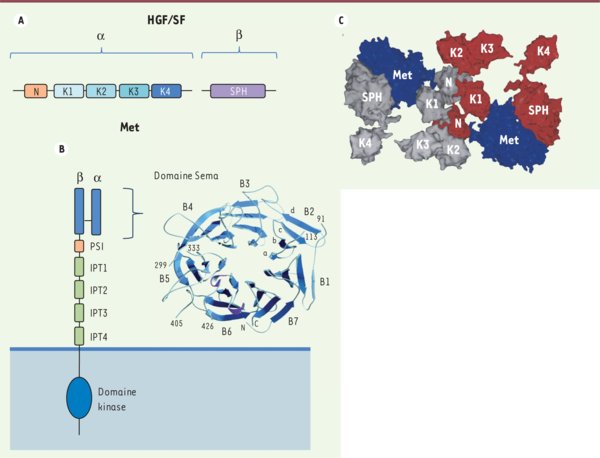
Domaines fonctionnels et structure de Met et de son ligand l’HGF/SF. A. L’HGF/SF est constitué de deux chaînes α et β reliées par des ponts disulfures. La sous-unité α possède un domaine amino-terminal (domaine N) et quatre domaines baptisés kringle (domaines K1 à K4) en forme de boucles stabilisées par trois liaisons disulfures intra-chaînes. La chaîne β possède un domaine présentant une forte homologie avec le domaine sérine protéase du plasminogène (domaine SPH, serine proteinase homology). B. Le récepteur Met est constitué de deux chaînes α et β reliées par des ponts disulfures. Sur sa partie extracellulaire, le récepteur est constitué d’un domaine Sema, homologue aux sémaphorines, à cheval sur la chaîne α et β. Ce domaine est suivi d’une région riche en cystéine appelée domaine PSI en raison de son homologie avec des domaines retrouvés dans les plexines, les sémaphorines et les intégrines. Puis la partie extracellulaire est constituée d’une succession de quatre domaines IPT (immunoglobulin-like fold shared by plexins and transcription factors). La structure cristallographique du domaine Sema révèle une organisation en sept pales concentriques bâties à partir de feuillets β. Met possède un domaine transmembranaire unique suivi dans la partie intracellulaire du domaine à activité tyrosine kinase. Figure extraite de [6] et reproduite avec l’autorisation de Proc Natl Acad Sci USA ; Copyright 2003 National Academy of Sciences, États-Unis. C. Structure cristallographique du domaine Sema de Met interagissant avec l’HGF/SF. Deux molécules d’HGF/SF interagissent via leurs domaines N et K1 associés tête-bêche. Chaque molécule d’HGF/SF interagit avec un domaine Sema de Met, permettant de proposer une interaction de type 2:2 (2 récepteurs:2 ligands) entre Met et l’HGF/SF. Figure extraite de [8] et reproduite avec l’autorisation de Proc Natl Acad Sci USA ; Copyright 2006, National Academy of Sciences, États-Unis.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




