| Issue |
Med Sci (Paris)
Volume 39, Number 1, Janvier 2023
|
|
|---|---|---|
| Page(s) | 23 - 30 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2022192 | |
| Published online | 24 January 2023 | |
La signalisation de CXCR4, un rhéostat de la réponse immunitaire à médiation humorale
CXCR4 as a rheostat of humoral response
1
Université Paris-Cité, Institut de recherche Saint-Louis, Inserm U1160, Paris, France
2
OPALE Carnot Institute, The Organization for Partnerships in Leukemia, Hôpital Saint-Louis, Paris, France
* Co-senior authors: marion.espeli@inserm.fr, karl.balabanian@inserm.fr
CXCR4 est un récepteur de chimiokine qui joue un rôle central dans la migration cellulaire mais également dans d’autres mécanismes essentiels, tels que le développement du système immunitaire. De concert avec son ligand naturel, la chimiokine CXCL12, cet axe de signalisation joue un rôle important dans la biologie des lymphocytes B, des stades précoces de différenciation dans la moelle osseuse à leur activation et différenciation en cellules sécrétrices d’anticorps, aussi appelées plasmocytes. Des mutations gain de fonction de CXCR4 sont retrouvées dans une immunodéficience rare, le Syndrome WHIM. Ces mutations affectent le mécanisme de désensibilisation du récepteur et entraînent un gain de fonction en réponse à CXCL12. Cette revue résume le rôle de CXCR4 dans la réponse immune humorale et, à travers l’étude du Syndrome WHIM, souligne le rôle régulateur essentiel de la désensibilisation de CXCR4 dans ces processus. Des travaux récents rapportent en effet qu’une signalisation correcte de CXCR4 est essentielle pour limiter la réponse immune dite « extra-folliculaire » et pour permettre une protection au long terme assurée par les anticorps.
Abstract
CXCR4 is a chemokine receptor that plays a central role in cell migration but also in other essential processes such as the development of the immune system. Together with its ligand, the chemokine CXCL12, this signalling axis plays an important role in B lymphocyte biology from their early differentiation in the bone marrow to their activation and differentiation into antibody secreting cells, also called plasma cells. Gain-of-function mutations of CXCR4 are found in a rare immunodeficiency, the WHIM Syndrome. These mutations affect the desensitization of the receptor and lead to a gain of function in response to CXCL12. This review summarizes the role of CXCR4 in the humoral immune responses and using the WHIM Syndrome as a paradigm, highlights the critical regulatory role of CXCR4 desensitization in these processes. Indeed, recent works report that fine-tuning of CXCR4 signalling is essential to limit the extra-follicular immune response and support long term antibody-mediated protection.
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.

Vignette (© Inserm).
La signalisation de CXCR4, un rhéostat de la réponse immunitaire à médiation humorale
Suite à une infection ou à une vaccination, notre système immunitaire produit une réponse complexe, en deux temps : une réponse rapide qui permet la genèse de cellules sécrétrices d’anticorps (Ac) de faible affinité constituant une première ligne de défense, suivie par une seconde réponse, plus à distance dans le temps, à l’origine d’Ac de haute affinité produits par des cellules qui pourront se maintenir plusieurs années et qui seront au cœur de la mémoire humorale. Les mécanismes en jeu dans la régulation de ces deux phases de la réponse humorale demeurent largement méconnus. Des travaux récents, incluant ceux de notre laboratoire, sont cependant en faveur d’un rôle joué par le récepteur CXCR4 (C-X-C motif chemokine receptor 4) dans la régulation et l’équilibre de ces deux processus.
CXCR4, un récepteur ubiquitaire essentiel à la biologie des lymphocytes B
Voie de signalisation de l’axe CXCL12/CXCR4
Les chimiokines sont définies comme des cytokines impliquées dans le trafic cellulaire, mais cette famille de protéines participe également à de nombreux autres mécanismes physiologiques. Ainsi, la liaison de la chimiokine CXCL12 (C-X-C motif chemokine ligand 12) à CXCR4 induit des signaux mitogéniques (i.e. qui promeuvent la prolifération cellulaire) et les voies de signalisation activées par cet axe jouent un rôle essentiel dans l’homéostasie de multiples processus comme l’organogenèse et l’hématopoïèse [1]. Des modèles murins dans lesquels Cxcr4 ou Cxcl12 ne sont pas exprimés ont été générés. Ces délétions sont létales au stade périnatal, démontrant le rôle primordial de ces molécules. La lymphopoïèse B précoce est également affectée en l’absence de CXCR4 ou de son ligand [2, 3]. En effet, de par sa capacité chimiotactique, la liaison de CXCL12 à CXCR4 au cours de la lymphopoïèse B dans la moelle osseuse (MO) permet la rétention et le bon positionnement des précurseurs des lymphocytes B (LB) au sein de cet organe et donc leur différenciation correcte en LB [4].
CXCR4 est un récepteur de chimiokine dont l’expression est ubiquitaire. Il appartient à la famille des récepteurs couplés aux protéines G (RCPG) et a pour particularité de se lier à un unique ligand, la chimiokinique CXCL12, sécrétée par de nombreuses cellules, dont les cellules stromales, épithéliales et endothéliales. La liaison de CXCL12 à son récepteur CXCR4 entraîne un changement de conformation du récepteur, qui va permettre l’activation des protéines G hétérotrimériques associées, à l’origine de l’activation de plusieurs voies de signalisation (Figure 1a), dont la voie PI3K (phosphoinositide 3-kinase) impliquée dans des mécanismes de migration et d’adhérence cellulaire, en phosphorylant la protéine kinase B (AKT). La liaison de CXCL12 à CXCR4 active également la voie des MAPK (mitogen-activated protein kinases) impliquée notamment dans la différenciation, la prolifération et la survie cellulaire, en particulier celles des LB [1,5]. Le système d’activation du couple CXCL12/CXCR4 est régulé par un mécanisme de rétrocontrôle négatif, appelé désensibilisation homologue (Figure 1b). Celui-ci limite l’amplification du signal induit par la chimiokine et permet l’arrêt de l’activation des protéines G associées au récepteur. Ce mécanisme repose sur des kinases spécifiques des RCPG dénommées GRK (G protein-coupled receptor kinase). Ces dernières phosphorylent des résidus sérine/thréonine présents dans le domaine intracellulaire C-terminal du récepteur. Des β-arrestines sont alors recrutées et vont empêcher le couplage du récepteur aux protéines G conduisant, in fine, à son internalisation via les endosomes (Figure 1c). Le récepteur sera finalement dégradé ou recyclé à la surface de la cellule [6].
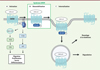 |
Figure 1. Voies de signalisation activées par la liaison de CXCL12 à CXCR4. La liaison de CXCL12 à CXCR4 entraîne l’activation des protéines G associées au récepteur. L’activation de cette voie est impliquée dans des mécanismes de migration, prolifération et différenciation cellulaires et est régulée par un mécanisme de désensibilisation empêchant un nouveau couplage de CXCR4 aux protéines G. Le récepteur est ensuite internalisé puis recyclé à la membrane ou dégradé. Des mutations gain de fonction de CXCR4 sont retrouvées dans le syndrome WHIM. Elles sont responsables de la génération d’un récepteur tronqué dans sa partie intracellulaire C-terminale, ce qui a pour conséquence d’abroger la désensibilisation du récepteur. MEK : MAP/ERK kinase ; ERK : extracellular signal-regulated kinase ; PI3K : phosphatidylinositol 3 kinase ; AKT : protéine kinase B ; b-arr : b-arrestine. |
L’activation de CXCR4 par CXCL12 peut induire des voies de signalisation impliquées dans la chimiotaxie, de façon dépendante des protéines G, mais également de façon indépendante, via les β-arrestines qui vont interagir avec la voie des MAPK [7].
Ce mécanisme de rétrocontrôle négatif est altéré dans certaines maladies. Des mutations germinales affectant le domaine C-terminal de CXCR4 ont en effet été mises en évidence dans le syndrome WHIM (SW), un déficit immuno-hématologique. Cette maladie rare, dont la prévalence est inférieure à un cas pour un million, est caractérisée par une lympho-neutropénie, une sensibilité accrue aux verrues (W pour warts, verrues en anglais) liée à des infections récurrentes par le HPV (papillomavirus humain), une hypogammaglobulinémie (H), des infections bactériennes (I) et une rétention anormale de neutrophiles hypermatures dans la moelle osseuse, appelée myélokathexis (M) [8]. L’analyse génétique des patients atteints du SW a permis de révéler l’existence de mutations récurrentes du gène CXCR4. Celles-ci touchent principalement la région codant le domaine C-terminal du récepteur. Les récepteurs produits sont exprimés à la membrane de la cellule, mais leur domaine C-terminal est tronqué, les rendant insensibles au mécanisme de rétrocontrôle négatif du signal induit par la liaison de CXCL12. Ces évènements se traduisent, biochimiquement et fonctionnellement, par un gain de fonction de CXCR4, non constitutif mais induit par la fixation de la chimiokine.
CXCR4 est essentiel à la mise en place de la réponse lymphocytaire B
Les LB sont générés dans la moelle osseuse par un processus finement régulé au cours duquel le réarrangement VDJ des locus des immunoglobulines (Ig) va permettre la génération de LB immatures exprimant à leur surface un récepteur antigénique (ou BCR pour B cell receptor) unique et fonctionnel. Ces cellules vont ensuite migrer vers les organes lymphoïdes secondaires (OLS), tels que la rate, où elles vont achever leur maturation afin de générer un pool de LB naïfs capables de répondre à un antigène. Dans la MO, CXCR4 est exprimé à tous les stades de différenciation des LB, depuis les cellules souches hématopoïétiques (CSH) jusqu’au stade des LB immatures (Figure 2). La voie de signalisation induite par CXCR4 est requise pour le maintien des CSH au sein de niches spécifiques dans la moelle osseuse [9], mais aussi pour l’engagement des progéniteurs multipotents (MPP) vers la différenciation lymphoïde [10, 11]. L’expression de CXCR4 varie en fonction des stades de différenciation des LB et les signaux induits par CXCL12 contribuent à la régulation spatio-temporelle de ce processus de différenciation. Par exemple, une balance entre les signaux induits par le récepteur de l’interleukine 7 (IL-7) et ceux induits par CXCR4 est nécessaire pour moduler la localisation et la différenciation des cellules pré-B, via une reprogrammation de leur profil épigénétique permettant le réarrangement des locus des chaînes légères d’Ig [12, 13]. Lorsque les lymphocytes B atteignent le stade de LB immatures, l’expression de surface de CXCR4 est réduite, ce qui semble nécessaire à leur mobilisation de la moelle osseuse vers le sang et les OLS [14]. Le développement optimal des LB repose donc sur l’intégration de différentes voies de signalisation et le couple CXCL12/CXCR4 joue un rôle central dans ce processus. Cette voie est également essentielle pour l’activation des LB (voir plus loin).
 |
Figure 2. L’expression de CXCR4 régule la différenciation des LB au sein de la moelle osseuse via un processus hautement régulé agissant à toutes les étapes de différenciation allant des cellules souches hématopoïétiques jusqu’au stade de lymphocyte B immature. Le niveau d’expression de CXCR4 varie lors de la différenciation B et régule la localisation des lymphocytes B (LB). Les LB immatures qui expriment moins CXCR4 sortent de la moelle osseuse et circulent jusqu’aux organes lymphoïdes secondaires, où ils termineront leur maturation jusqu’à leur activation. CSH : cellules souches hématopoïétiques ; MPP : progéniteurs multipotents. |
À côté de CXCR4, CXCL12 peut également se lier à un second récepteur qualifié d’« atypique » : ACKR3 (atypical chemokine receptor 3)/CXCR7 (C-X-C motif chemokine receptor 7). L’une des propriétés d’ACKR3 est de capter, d’internaliser et de dégrader CXCL12, régulant ainsi la bio-disponibilité de la chimiokine, notamment au sein de la moelle osseuse [15]. Au niveau des LB, ACKR3 est principalement exprimé par les LB matures. Il semble impliqué dans la différenciation plasmocytaire par la voie dépendant de la β-arrestine [16, 17]. Ainsi, ACKR3 apparaît comme un récepteur régulateur de l’axe CXCL12/CXCR4, mais il présente également des fonctions importantes via la mobilisation d’autres voies de signalisation qui lui sont propres [18].
La désensibilisation de CXCR4, un régulateur essentiel de la réponse lymphocytaire B thymo-dépendante
La mutation gain de fonction de CXCR4 exacerbe la maturation des lymphocytes B au sein des organes lymphoïdes secondaires
Il est généralement admis que l’activation des LB, via leur BCR, peut se faire directement de façon thymo-indépendante, en réponse à des antigènes présentant des motifs répétés, ou de façon thymo-dépendante, en réponse à des antigènes protéiques qui seront internalisés puis présentés aux lymphocytes T par les molécules du complexe majeur d’histocompatibilité de type II (CMH II).
Les LB peuvent également subir le processus de commutation isotypique, à l’origine de la modification de la nature de la chaîne lourde des Ac qu’ils synthétisent, entraînant le changement de l’isotype exprimé. Les cellules exprimant initialement une IgM peuvent alors exprimer d’autres isotypes d’Ig (G, A ou E). L’isotype produit confère leurs propriétés effectrices aux Ac et est donc adapté à l’agent pathogène à l’origine de la réponse immune.
Quel que soit le type d’antigène, l’activation des LB se fait selon deux phases. La première, appelée extra-folliculaire, est rapide et conduit à la génération des plasmablastes, des cellules sécrétrices d’Ac de relative faible affinité, qui vont former une première ligne de défense contre l’agent pathogène. La deuxième phase se met en place après quelques jours et se déroule dans une structure anatomique particulière, le centre germinatif (CG) qui permet la génération de plasmablastes de haute affinité vis-à-vis de l’antigène. Le CG est composé de deux zones : une zone sombre et une zone claire dans lesquelles les LB circulent de façon dynamique. Au sein de la zone sombre, les LB, appelés centroblastes, prolifèrent rapidement et subissent le phénomène d’hypermutation somatique (SHM) dans les domaines variables des gènes d’Ig. À la suite de cette phase de prolifération et de mutation, les LB migrent dans la zone claire ; ils sont alors appelés centrocytes. À ce niveau, les LB vont reconnaître l’antigène présenté par les cellules dendritiques folliculaires (FDC) et le présenter aux lymphocytes T folliculaires helper (Tfh) [19, 20]. Les LB exprimant le BCR le plus affin pour l’antigène internaliseront et présenteront plus d’antigène aux Tfh. Suite au signal d’aide reçu des Tfh, ils se différencieront alors en LB mémoire ou en plasmablastes puis quitteront le CG. Les LB les moins affins retourneront, quant à eux, vers la zone sombre, afin de subir un nouveau cycle de prolifération et de mutation de leur BCR [21, 22]. La circulation des LB entre la zone sombre et la zone claire est donc partie prenante de la réaction du CG. Cette dynamique dépend, notamment, de gradients de deux chimiokines : CXCL12 et CXCL13. CXCL12 est en effet présente principalement dans la zone sombre tandis que CXCL13 est retrouvée dans la zone claire [23-25]. La compartimentalisation du CG dépend par ailleurs de l’expression de CXCR4, qui est un marqueur des centroblastes, et son expression augmente lors de la phase de prolifération des LB. Le récepteur de CXCL13, CXCR5, est quant à lui retrouvé dans la zone claire [26, 27]. L’absence d’expression de CXCR4 par les LB entraîne la formation d’une structure sans polarité zone sombre/zone claire [28]. L’expression de facteurs de transcription, comme Foxo1, est également nécessaire pour la formation de la zone sombre [29, 30]. La polarisation et le fonctionnement du CG dépendent donc de plusieurs facteurs, et l’axe CXCL12/CXCR4 est fondamental dans ce processus. Une fois générés, les plasmablastes migrent ensuite vers la moelle osseuse sous l’influence de l’axe CXCL12/CXCR4. Dans la moelle osseuse, une partie de ces cellules poursuivent leur différenciation en plasmocytes, correspondant à leur stade final de maturation.
Les patients atteints du SW sont capables de générer une réponse T-dépendante suite, par exemple, à une vaccination contre le tétanos, avec une production d’Ac spécifiques retrouvés dans la circulation sanguine, mais cette réponse ne perdure pas au cours du temps, résultant en une réponse vaccinale inefficace [31, 32].
Afin de comprendre comment un gain de fonction de CXCR4, retrouvé chez les patients présentant un SW, peut altérer cette réponse vaccinale, un modèle murin du SW a été généré. Grâce à la forte homologie de séquence de CXCR4 entre l’homme et la souris, une mutation gain de fonction, orthologue de celle retrouvée chez certains patients, a pu être insérée par une stratégie de knock-in dans le gène Cxcr4 murin, conduisant à la délétion des 15 derniers acides aminés du domaine intracellulaire C-terminal du récepteur [33]. Dans ce modèle, le mécanisme de désensibilisation de CXCR4 est altéré, comme chez les patients, ce qui entraîne une suractivation du signal transduit par CXCR4 suite à la liaison de CXCL12, associée à une leucopénie similaire à celle observée dans le SW [33]. Chez les souris porteuses de la mutation gain de fonction de Cxcr4, la réaction du CG, suite à une immunisation thymo-dépendante, est exacerbée [34]. Malgré une réduction marquée du nombre de LB spléniques totaux, le nombre de LB du CG reste normal, avec une augmentation de la fréquence des centroblastes après immunisation. La fréquence et le nombre de plasmablastes spécifiques de l’antigène sont également plus importants chez les souris mutées comparativement aux souris sauvages. La désensibilisation de CXCR4 semble donc constituer un mécanisme régulateur de la réponse immunitaire adaptative à médiation humorale, et en son absence, la réponse du CG n’est plus contrôlée correctement (Figure 3). Comme chez certains patients atteints du SW, malgré cette augmentation de la réponse du CG, les taux d’Ac sériques spécifiques de l’antigène utilisé pour l’immunisation ne se maintiennent pas dans le temps chez les souris porteuses de la mutation.
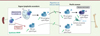 |
Figure 3. La désensibilisation de CXCR4 régule la réponse du centre germinatif. Lors d’une réponse thymo-dépendante, des plasmablastes (PB) issus de la réponse extra-folliculaire (E-F) sont rapidement générés dans les organes lymphoïdes secondaires, tandis que les plasmablastes spécifiques de l’antigène apparaissent plus tardivement suite à la réaction du centre germinatif (CG). Ces plasmablastes issus du CG terminent normalement leur maturation en plasmocyte (PC) au sein de la moelle osseuse. En absence du mécanisme de désensibilisation de CXCR4, des plasmablastes non spécifiques de l’antigène utilisé pour l’immunisation sont anormalement générés lors de la réponse extra-folliculaire et sont retrouvés de façon aberrante et précoce dans la moelle osseuse, probablement en raison d’une augmentation de leur migration vers Cxcl12. En parallèle, des plasmablastes de forte affinité pour l’antigène utilisé pour l’immunisation, issus du CG, sont fortement produits dans les organes lymphoïdes secondaires mais peu sont retrouvés dans la moelle osseuse. CXCR4 semble donc être nécessaire pour contrôler la réponse extra-folliculaire et permettre au plasmablastes issus de la réponse dépendante du CG de rejoindre la moelle osseuse. LZ : light zone ; DZ : dark zone. |
La mutation gain de fonction de Cxcr4 est associée à une accumulation de plasmablastes dans la moelle osseuse
Le maintien des taux d’Ac sériques dans le temps dépend de la survie des plasmocytes spécifiques de l’antigène utilisé pour l’immunisation au sein de niches spécialisées dans la moelle osseuse [35]. La migration des plasmablastes issus des OLS vers la MO, ainsi que leur maintien au sein de cet organe, sont en partie dépendant de l’axe de signalisation formé par CXCL12 et CXCR4 [36-38]. À l’opposé de ce qui est observé dans les OLS, peu de plasmocytes spécifiques de l’antigène sont détectés au cours du temps dans la moelle osseuse des souris porteuses de la mutation gain de fonction de Cxcr4, ce qui pourrait expliquer le défaut de maintien des titres sériques d’Ac au cours du temps. Une augmentation aberrante de plasmablastes exprimant des IgM (IgM+), non spécifiques de l’antigène utilisé pour l’immunisation et en cycle, a de plus été observée dans la moelle osseuse de ces souris (Figure 3) [34]. Il semble donc qu’en l’absence du mécanisme de désensibilisation de CXCR4, le défaut de maintien des taux d’Ac spécifiques circulants ne serait pas dû à une réponse immunitaire humorale réduite, mais à un défaut du compartiment plasmocytaire au sein de la moelle osseuse.
Afin d’expliquer ce phénomène, une étude détaillée de la cinétique de la réponse immunitaire a été réalisée et a permis de mettre en évidence une génération et une migration précoce des plasmablastes des OLS vers la moelle osseuse, dès trois jours après immunisation, soit bien avant la formation du CG [34]. Cette observation suggère donc que les plasmablastes que l’on observe seraient d’origine extra-folliculaire.
La désensibilisation de CXCR4 limite l’intensité et la durée de la réponse lymphocytaire B extra-folliculaire
Afin de caractériser la population de plasmablastes médullaires présumée issus d’une réponse extra-folliculaire, les souris, porteuses ou non de la mutation gain de fonction de Cxcr4, ont été injectées avec du lipopolysaccharide (LPS), un ligand du récepteur TLR4 (toll-like receptor 4), responsable quasi exclusivement d’une réponse extra-folliculaire [39]. En comparaison aux souris sauvages, dès trois jours après cette immunisation, les souris mutées présentent une augmentation plus marquée des plasmablastes IgM+ dans la rate. Ces plasmablastes IgM+ s’accumulent également précocement dans la moelle osseuse de ces souris (Figure 4). Les LB doivent se diviser quatre à huit fois avant de pouvoir se différencier en plasmablastes [40, 41]. La mutation gain de fonction de Cxcr4 semble promouvoir une entrée en cycle plus rapide des LB en réponse à une stimulation par le LPS, via une activation de la voie impliquant la protéine kinase mTOR (mammalian target of rapamycyin). La désensibilisation de CXCR4 est donc un régulateur négatif de l’entrée en cycle des LB, et une dérégulation de ce mécanisme pourrait contribuer à l’augmentation de la différenciation des LB en plasmablastes. De plus, l’analyse de la moelle osseuse de patients atteints du SW a permis de mettre en évidence une augmentation spontanée de la fréquence des plasmablastes, en comparaison aux individus sains, supportant les résultats décrits dans le modèle murin. Le suivi au long cours des plasmablastes IgM+ de la moelle osseuse a révélé que ces cellules pouvaient se différencier en plasmocytes, et se maintenir au moins 45 jours dans celle-ci chez les souris mutées. La désensibilisation de CXCR4 semble donc agir comme un régulateur négatif de la réponse extra-folliculaire, en contrôlant l’accumulation des plasmablastes générés au niveau de la rate, mais également en régulant la migration, la maturation et la persistance de certaines de ces cellules dans la moelle osseuse.
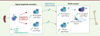 |
Figure 4. La désensibilisation de CXCR4 régule négativement la génération et le maintien dans le temps des plasmablastes issus de la réponse extra-folliculaire. L’absence de désensibilisation de CXCR4 entraîne une augmentation de la génération des plasmablastes (PB) dans la rate suite à une immunisation thymo-indépendante, associée à une entrée en cycle plus importante des LB via la voie mTOR. Les plasmablastes issus de cette réponse extra-folliculaire s’accumulent de façon aberrante au sein de la moelle osseuse, et certains peuvent persister pendant plusieurs mois. E-F: extra-folliculaire ; SW : syndrome WHIM ; PC : plasmocytes. |
La désensibilisation de CXCR4 est donc essentielle au contrôle de la différenciation des LB en plasmablastes au cours de la réponse extra-folliculaire, et une dérégulation de ce mécanisme est responsable de l’accumulation de plasmablastes dans la moelle osseuse que l’on observe chez la souris mais aussi chez l’homme, à l’état basal mais également après immunisations thymo-dépendante ou thymo-indépendante.
La désensibilisation de CXCR4 régule le tropisme médullaire des plasmocytes
Une partie des plasmablastes issus des réponses extra-folliculaire et du CG peut rejoindre la MO par un mécanisme dépendant de CXCR4 [36]. Ces cellules vont y terminer leur maturation pour devenir des plasmocytes quiescents qui persisteront pendant de longues périodes pouvant s’étendre à plusieurs décennies chez l’homme [35]. Leur maintien dépend de leur environnement ou « niches » qui restent encore partiellement caractérisées. Plusieurs études rapportent que les plasmocytes sont en contact avec des cellules stromales qui expriment fortement CXCL12, et qui sont probablement impliquées dans leur maintien [38]. La survie des plasmocytes dépend également de molécules, comme APRIL (a proliferation-inducing ligand) ou l’IL-6, qui sont sécrétées par les cellules stromales et les cellules d’origine hématopoïétiques, dont différents types de cellules myéloïdes [42]. Le gain de fonction de CXCR4 pourrait donc altérer la migration des plasmablastes vers la moelle osseuse, mais également leur maintien au sein de la niche riche en CXCL12. In vitro, le gain de fonction de CXCR4 est en effet associé à une augmentation de la migration des plasmablastes en réponse à CXCL12, qui peut être corrigée par l’addition d’un antagoniste spécifique de CXCR4, confirmant ainsi le rôle de ce récepteur dans ce mécanisme. In vivo, des expériences de transfert ont confirmé que le gain de fonction de CXCR4 conférait un avantage intrinsèque aux plasmablastes pour la migration vers la moelle osseuse. Une altération de plusieurs gènes impliqués dans la migration et l’adhérence cellulaires a été par ailleurs mise en évidence dans ces plasmablastes [39]. La mutation gain de fonction de CXCR4 entraîne donc une augmentation de la différenciation plasmocytaire extra-folliculaire associée à un tropisme médullaire exacerbé, responsable de l’accumulation de plasmablastes dans la moelle osseuse. Il est donc possible que cette accumulation, dès trois jours après immunisation, contribue à un encombrement des niches, empêchant ainsi l’accueil des plasmablastes issus du CG, générés une semaine plus tard.
La désensibilisation de CXCR4 semble donc être un mécanisme régulateur qui limite l’accumulation au sein de la moelle osseuse de plasmablastes non spécifiques ou de faible affinité, produits par la réponse extra-folliculaire, afin de favoriser le nichage de plasmocytes spécifiques de l’antigène, générés plus tardivement au cours de la réponse du CG. Le défaut de réponse vaccinale observé chez les patients souffrant du SW ne serait donc pas dû au statut lymphopénique ou à un défaut de leur réponse immunitaire humorale, mais plus probablement à une compétition pour des niches de survie au sein de la moelle osseuse entre les plasmablastes issus de la réponse extra-folliculaire et ceux issus du CG.
Conclusion et perspectives
L’étude de l’impact d’une mutation gain de fonction du gène CXCR4, à l’aide d’un modèle murin unique et original, a donc permis de révéler un rôle essentiel de ce récepteur dans l’activation des LB au cours de la réponse extra-folliculaire après des immunisations thymo-dépendante ou thymo-indépendante. Suite à une immunisation thymo-dépendante, les souris mutantes présentent en effet une augmentation transitoire de plasmablastes non spécifiques dans la moelle osseuse, suggérant un rôle important de la désensibilisation du récepteur dans le contrôle de la réponse extra-folliculaire. L’immunisation thymo-dépendante de ces souris confirme cette hypothèse, avec une augmentation de l’entrée en cycle des LB associée à une accumulation transitoire des plasmablastes spécifiques dans la moelle osseuse, ces cellules ayant un tropisme médullaire exacerbé. En l’absence du mécanisme de désensibilisation de CXCR4, les plasmablastes s’accumulent et perdurent dans des niches médullaires, empêchant probablement la venue et le nichage des plasmocytes générés plus tardivement (Figure 5).
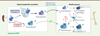 |
Figure 5. La signalisation induite par CXCR4 contrôle l’équilibre entre plasmocytes issus des réponses extra-folliculaire et du centre germinatif. En absence du mécanisme de désensibilisation de CXCR4, les plasmablastes issus de la réponse extra-folliculaire (E-F) sont générés de manière incontrôlée et sont retrouvés au sein de la moelle osseuse de façon aberrante et précoce. L’impact exact de la présence de ces cellules sur les plasmablastes et les plasmocytes générés lors d’une réponse dépendante du CG reste à déterminer (1). Plusieurs questions nécessitent également d’être élucidées : les plasmablastes et les plasmocytes se trouvent-ils dans les mêmes niches (2) ? Quelle est l’influence de la signalisation de CXCR4 sur les interactions établies au sein de ces niches (3) ? LZ : light zone ; DZ : dark zone ; PC : plasmocytes. |
Des analyses plus approfondies de ces niches sont cependant nécessaires afin de comprendre le mécanisme permettant la survie et la persistance de ces cellules. Il serait intéressant de déterminer, notamment, la localisation de ces cellules et leurs interactions avec les différentes composantes de leur microenvironnement, qu’elles soient hématopoïétiques ou stromales. Il serait également important d’étudier les interactions entre les niches, les plasmocytes et les plasmablastes, pour identifier des voies de signalisation qui seraient spécifiques à chaque type cellulaire.
Une même mutation gain de fonction de CXCR4 a également été retrouvée chez les patients souffrant de la Macroglobulinémie de Waldenström (MW)1, dont 90 % présentent une mutation somatique gain de fonction constitutive du gène codant MyD88, un adaptateur participant à la signalisation induite par les récepteurs de l’immunité innée. Les patients portant ces deux mutations somatiques présentent un lymphoplasmocytome plus invasif au niveau de la moelle osseuse, suggérant un rôle synergique des deux mutations dans la différenciation des LB, mais également dans leur migration. Néanmoins, le rôle de CXCR4, en regard de celui de MyD88, dans la physiopathologie de cette hémopathie lymphoïde reste à déterminer. La mutation de CXCR4 pourrait, par exemple, conférer aux cellules malignes un signal de survie et de tropisme médullaire supplémentaire. Les résultats obtenus avec le modèle de souris portant une mutation orthologue gain de fonction de Cxcr4, pourrait ainsi être en faveur de l’hypothèse intrigante d’une origine extra-folliculaire pour la MW, actuellement considérée comme une maladie post-CG.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Ce travail a été supporté par l’ANR (ANR-19-CE15-0019-01 pour M.E., ANR-17-CE14-0019 pour K.B.), l’Inserm et l’université Paris-Cité (ANR-18-IDEX-0001 pour M.E.).
Références
- Bam R, Ling W, Khan S, et al. Role of Bruton’s tyrosine kinase in myeloma cell migration and induction of bone disease. Am J Hematol 2013 ; 88 : 463–471. [CrossRef] [PubMed] [Google Scholar]
- Nagasawa T, Hirota S, Tachibana K, et al. Defects of B-cell lymphopoiesis and bone-marrow myelopoiesis in mice lacking the CXC chemokine PBSF/SDF-1. Nature 1996 ; 382 : 635–638. [CrossRef] [PubMed] [Google Scholar]
- Ma Q, Jones D, Borghesani PR, et al. Impaired B-lymphopoiesis, myelopoiesis, and derailed cerebellar neuron migration in CXCR4- and SDF-1-deficient mice. Proc Natl Acad Sci USA 1998 ; 95 : 9448–9453. [CrossRef] [PubMed] [Google Scholar]
- Tashiro K, Nakano T, Honjo T. Signal Sequence Trap: Expression Cloning Method for Secreted Proteins and Type 1 Membrane Proteins. cDNA Library Protocols. New Jersey : Humana Press, 1993 : 203–20. [Google Scholar]
- Chen S-S, Chang BY, Chang S, et al. BTK inhibition results in impaired CXCR4 chemokine receptor surface expression, signaling and function in chronic lymphocytic leukemia. Leukemia 2016 ; 30 : 833–843. [CrossRef] [PubMed] [Google Scholar]
- Moore CAC, Milano SK, Benovic JLRegulation of Receptor Trafficking by GRKs and Arrestins. Annu Rev Physiol 2007 ; 69 : 451–482. [CrossRef] [PubMed] [Google Scholar]
- Fong AM, Premont RT, Richardson RM, et al. Defective lymphocyte chemotaxis in beta-arrestin2- and GRK6-deficient mice. Proc Natl Acad Sci U S A 2002 ; 99 : 7478–7483. [CrossRef] [PubMed] [Google Scholar]
- Hernandez PA, Gorlin RJ, Lukens JN, et al. Mutations in the chemokine receptor gene CXCR4 are associated with WHIM syndrome, a combined immunodeficiency disease. Nat Genet 2003 ; 34 : 70–74. [CrossRef] [PubMed] [Google Scholar]
- Sugiyama T, Kohara H, Noda M, et al. Maintenance of the Hematopoietic Stem Cell Pool by CXCL12-CXCR4 Chemokine Signaling in Bone Marrow Stromal Cell Niches. Immunity 2006 ; 25 : 977–988. [CrossRef] [PubMed] [Google Scholar]
- Freitas C, Wittner M, Nguyen J, et al. Lymphoid differentiation of hematopoietic stem cells requires efficient Cxcr4 desensitization. J Exp Med 2017 ; 214 : 2023–2040. [CrossRef] [PubMed] [Google Scholar]
- Cordeiro Gomes A, Hara T, Lim VY, et al. Hematopoietic Stem Cell Niches Produce Lineage-Instructive Signals to Control Multipotent Progenitor Differentiation. Immunity 2016; 45 : 1219–31. [CrossRef] [PubMed] [Google Scholar]
- Mandal M, Okoreeh MK, Kennedy DE, et al. CXCR4 signaling directs Igk recombination and the molecular mechanisms of late B lymphopoiesis. Nat Immunol 2019 ; 20 : 1393–1403. [CrossRef] [PubMed] [Google Scholar]
- Purohit SJDetermination of lymphoid cell fate is dependent on the expression status of the IL-7 receptor. EMBO J 2003 ; 22 : 5511–5521. [CrossRef] [PubMed] [Google Scholar]
- Beck TC, Gomes AC, Cyster JG, et al. CXCR4 and a cell-extrinsic mechanism control immature B lymphocyte egress from bone marrow. J Exp Med 2014 ; 211 : 2567–2581. [CrossRef] [PubMed] [Google Scholar]
- Koenen J, Bachelerie F, Balabanian K, et al. Atypical Chemokine Receptor 3 (ACKR3): A Comprehensive Overview of its Expression and Potential Roles in the Immune System. Mol Pharmacol 2019 ; 96 : 809–818. [CrossRef] [PubMed] [Google Scholar]
- Radice E, Ameti R, Melgrati S, et al. Marginal Zone Formation Requires ACKR3 Expression on B Cells. Cell Rep 2020; 32 : 107951. [CrossRef] [PubMed] [Google Scholar]
- Koch C, Engele J. Functions of the CXCL12 Receptor ACKR3/CXCR7–What Has Been Perceived and What Has Been Overlooked. Mol Pharmacol 2020; 98 : 577–85. [CrossRef] [PubMed] [Google Scholar]
- Quinn KE, Mackie DI, Caron KMEmerging roles of Atypical Chemokine Receptor 3 (ACKR3) in normal development and physiology. Cytokine 2018 ; 109 : 17–23. [CrossRef] [PubMed] [Google Scholar]
- Victora GD, Schwickert TA, Fooksman DR, et al. Germinal Center Dynamics Revealed by Multiphoton Microscopy with a Photoactivatable Fluorescent Reporter. Cell 2010 ; 143 : 592–605. [CrossRef] [PubMed] [Google Scholar]
- Shulman Z, Gitlin AD, Weinstein JS, et al. Dynamic signaling by T follicular helper cells during germinal center B cell selection. Science 2014 ; 345 : 1058–1062. [CrossRef] [PubMed] [Google Scholar]
- Ersching J, Efeyan A, Mesin L, et al. Germinal Center Selection and Affinity Maturation Require Dynamic Regulation of mTORC1 Kinase. Immunity 2017 ; 46 : 1045–58e6. [CrossRef] [PubMed] [Google Scholar]
- Shinnakasu R, Kurosaki TRegulation of memory B and plasma cell differentiation. Curr Opin Immunol 2017 ; 45 : 126–131. [CrossRef] [PubMed] [Google Scholar]
- Rodda LB, Bannard O, Ludewig B, et al. Phenotypic and Morphological Properties of Germinal Center Dark Zone Cxcl12 -Expressing Reticular Cells. J Immunol 2015 ; 195 : 4781–4791. [CrossRef] [PubMed] [Google Scholar]
- Wang X, Cho B, Suzuki K, et al. Follicular dendritic cells help establish follicle identity and promote B cell retention in germinal centers. J Exp Med 2011 ; 208 : 2497–2510. [CrossRef] [PubMed] [Google Scholar]
- Barinov A, Luo L, Gasse P, et al. Essential role of immobilized chemokine CXCL12 in the regulation of the humoral immune response. Proc Natl Acad Sci USA 2017 ; 114 : 2319–2324. [CrossRef] [PubMed] [Google Scholar]
- Caron G, Le Gallou S, Lamy T, et al. CXCR4 Expression Functionally Discriminates Centroblasts versus Centrocytes within Human Germinal Center B Cells. J Immunol 2009 ; 182 : 7595–7602. [CrossRef] [PubMed] [Google Scholar]
- Weber TSCell Cycle-Associated CXCR4 Expression in Germinal Center B Cells and Its Implications on Affinity Maturation. Front Immunol 2018 ; 9 : 1313. [CrossRef] [PubMed] [Google Scholar]
- Allen CDC, Ansel KM, Low C, et al. Germinal center dark and light zone organization is mediated by CXCR4 and CXCR5. Nat Immunol 2004 ; 5 : 943–952. [CrossRef] [PubMed] [Google Scholar]
- Dominguez-Sola D, Kung J, Holmes AB, et al. The FOXO1 Transcription Factor Instructs the Germinal Center Dark Zone Program. Immunity 2015 ; 43 : 1064–1074. [CrossRef] [PubMed] [Google Scholar]
- Sander S, Chu VT, Yasuda T, et al. PI3 Kinase and FOXO1 Transcription Factor Activity Differentially Control B Cells in the Germinal Center Light and Dark Zones. Immunity 2015 ; 43 : 1075–1086. [CrossRef] [PubMed] [Google Scholar]
- Gulino AV, Moratto D, Sozzani S, et al. Altered leukocyte response to CXCL12 in patients with warts hypogammaglobulinemia, infections, myelokathexis (WHIM) syndrome. Blood 2004 ; 104 : 444–452. [CrossRef] [PubMed] [Google Scholar]
- Handisurya A, Schellenbacher C, Reininger B, et al. A quadrivalent HPV vaccine induces humoral and cellular immune responses in WHIM immunodeficiency syndrome. Vaccine 2010 ; 28 : 4837–4841. [CrossRef] [PubMed] [Google Scholar]
- Balabanian K, Brotin E, Biajoux V, et al. Proper desensitization of CXCR4 is required for lymphocyte development and peripheral compartmentalization in mice. Blood 2012 ; 119 : 5722–5730. [CrossRef] [PubMed] [Google Scholar]
- Biajoux V, Natt J, Freitas C, et al. Efficient Plasma Cell Differentiation and Trafficking Require Cxcr4 Desensitization. Cell Rep 2016 ; 17 : 193–205. [CrossRef] [PubMed] [Google Scholar]
- Slifka MK, Antia R, Whitmire JK, et al. Humoral Immunity Due to Long-Lived Plasma Cells. Immunity 1998 ; 8 : 363–372. [CrossRef] [PubMed] [Google Scholar]
- Hargreaves DC, Hyman PL, Lu TT, et al. A Coordinated Change in Chemokine Responsiveness Guides Plasma Cell Movements. J Exp Med 2001 ; 194 : 45–56. [CrossRef] [PubMed] [Google Scholar]
- Hauser AE, Debes GF, Arce S, et al. Chemotactic Responsiveness Toward Ligands for CXCR3 and CXCR4 Is Regulated on Plasma Blasts During the Time Course of a Memory Immune Response. J Immunol 2002 ; 169 : 1277–1282. [CrossRef] [PubMed] [Google Scholar]
- Tokoyoda K, Egawa T, Sugiyama T, et al. Cellular Niches Controlling B Lymphocyte Behavior within Bone Marrow during Development. Immunity 2004 ; 20 : 707–718. [CrossRef] [PubMed] [Google Scholar]
- Alouche N, Bonaud A, Rondeau V, et al. Hematologic disorder-associated Cxcr4 gain-of-function mutation leads to uncontrolled extrafollicular immune response. Blood 2021; 137 : 3050–63. [CrossRef] [PubMed] [Google Scholar]
- Kay JE, Kromwel L, Doe SEA, et al. Inhibition of T and B lymphocyte proliferation by rapamycin. Immunology 1991 ; 72 : 544–549. [PubMed] [Google Scholar]
- Limon JJ, Fruman DA. Akt and mTOR in B Cell Activation and Differentiation. Front Immun 2012; 3. [Google Scholar]
- Belnoue E, Pihlgren M, McGaha TL, et al. APRIL is critical for plasmablast survival in the bone marrow and poorly expressed by early-life bone marrow stromal cells. Blood 2008 ; 111 : 2755–2764. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Voies de signalisation activées par la liaison de CXCL12 à CXCR4. La liaison de CXCL12 à CXCR4 entraîne l’activation des protéines G associées au récepteur. L’activation de cette voie est impliquée dans des mécanismes de migration, prolifération et différenciation cellulaires et est régulée par un mécanisme de désensibilisation empêchant un nouveau couplage de CXCR4 aux protéines G. Le récepteur est ensuite internalisé puis recyclé à la membrane ou dégradé. Des mutations gain de fonction de CXCR4 sont retrouvées dans le syndrome WHIM. Elles sont responsables de la génération d’un récepteur tronqué dans sa partie intracellulaire C-terminale, ce qui a pour conséquence d’abroger la désensibilisation du récepteur. MEK : MAP/ERK kinase ; ERK : extracellular signal-regulated kinase ; PI3K : phosphatidylinositol 3 kinase ; AKT : protéine kinase B ; b-arr : b-arrestine. |
| Dans le texte | |
 |
Figure 2. L’expression de CXCR4 régule la différenciation des LB au sein de la moelle osseuse via un processus hautement régulé agissant à toutes les étapes de différenciation allant des cellules souches hématopoïétiques jusqu’au stade de lymphocyte B immature. Le niveau d’expression de CXCR4 varie lors de la différenciation B et régule la localisation des lymphocytes B (LB). Les LB immatures qui expriment moins CXCR4 sortent de la moelle osseuse et circulent jusqu’aux organes lymphoïdes secondaires, où ils termineront leur maturation jusqu’à leur activation. CSH : cellules souches hématopoïétiques ; MPP : progéniteurs multipotents. |
| Dans le texte | |
 |
Figure 3. La désensibilisation de CXCR4 régule la réponse du centre germinatif. Lors d’une réponse thymo-dépendante, des plasmablastes (PB) issus de la réponse extra-folliculaire (E-F) sont rapidement générés dans les organes lymphoïdes secondaires, tandis que les plasmablastes spécifiques de l’antigène apparaissent plus tardivement suite à la réaction du centre germinatif (CG). Ces plasmablastes issus du CG terminent normalement leur maturation en plasmocyte (PC) au sein de la moelle osseuse. En absence du mécanisme de désensibilisation de CXCR4, des plasmablastes non spécifiques de l’antigène utilisé pour l’immunisation sont anormalement générés lors de la réponse extra-folliculaire et sont retrouvés de façon aberrante et précoce dans la moelle osseuse, probablement en raison d’une augmentation de leur migration vers Cxcl12. En parallèle, des plasmablastes de forte affinité pour l’antigène utilisé pour l’immunisation, issus du CG, sont fortement produits dans les organes lymphoïdes secondaires mais peu sont retrouvés dans la moelle osseuse. CXCR4 semble donc être nécessaire pour contrôler la réponse extra-folliculaire et permettre au plasmablastes issus de la réponse dépendante du CG de rejoindre la moelle osseuse. LZ : light zone ; DZ : dark zone. |
| Dans le texte | |
 |
Figure 4. La désensibilisation de CXCR4 régule négativement la génération et le maintien dans le temps des plasmablastes issus de la réponse extra-folliculaire. L’absence de désensibilisation de CXCR4 entraîne une augmentation de la génération des plasmablastes (PB) dans la rate suite à une immunisation thymo-indépendante, associée à une entrée en cycle plus importante des LB via la voie mTOR. Les plasmablastes issus de cette réponse extra-folliculaire s’accumulent de façon aberrante au sein de la moelle osseuse, et certains peuvent persister pendant plusieurs mois. E-F: extra-folliculaire ; SW : syndrome WHIM ; PC : plasmocytes. |
| Dans le texte | |
 |
Figure 5. La signalisation induite par CXCR4 contrôle l’équilibre entre plasmocytes issus des réponses extra-folliculaire et du centre germinatif. En absence du mécanisme de désensibilisation de CXCR4, les plasmablastes issus de la réponse extra-folliculaire (E-F) sont générés de manière incontrôlée et sont retrouvés au sein de la moelle osseuse de façon aberrante et précoce. L’impact exact de la présence de ces cellules sur les plasmablastes et les plasmocytes générés lors d’une réponse dépendante du CG reste à déterminer (1). Plusieurs questions nécessitent également d’être élucidées : les plasmablastes et les plasmocytes se trouvent-ils dans les mêmes niches (2) ? Quelle est l’influence de la signalisation de CXCR4 sur les interactions établies au sein de ces niches (3) ? LZ : light zone ; DZ : dark zone ; PC : plasmocytes. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




