| Issue |
Med Sci (Paris)
Volume 39, Number 1, Janvier 2023
|
|
|---|---|---|
| Page(s) | 31 - 37 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2022191 | |
| Published online | 24 January 2023 | |
Alcoolisation chez les jeunes
Neuroinflammation et épigénétique à l’origine des pertes de mémoire dès les premiers épisodes de binge drinking
Binge drinking in the young population: Lost memory after initial ethanol exposure via neuroinflammation and epigenetic
Université de Picardie Jules Verne, Inserm UMR1247 GRAP, Amiens, France
*
olivier.pierrefiche@inserm.fr
La pratique du binge drinking (BD) se caractérise par l’alternance répétée d’épisodes d’alcoolisation rapide et massive, dans le but d’atteindre l’ivresse, et de périodes d’abstinence. Une telle modalité de consommation d’alcool est communément rencontrée chez les jeunes. Elle entraîne des déficits cognitifs en impliquant probablement des processus neuroinflammatoires et épigénétiques. Toutefois, le mode d’action de l’alcool au cours des expositions initiales de type BD, est peu connu. Il pourrait pourtant être à l’origine de ces déficits cognitifs à long terme. Des études récentes, réalisées chez le rat adolescent, révèlent que la perte de mémoire se produit dès les premiers BD, avec des mécanismes similaires à ceux d’une exposition plus longue. L’initiation au BD chez le jeune serait donc responsable de déficits qui seront probablement entretenus par la répétition de cette pratique. Ces données originales devraient permettre de renforcer les campagnes de prévention auprès de la jeune population qui pratique le BD.
Abstract
Binge drinking (BD) in young adults/adolescents can lead to cognitive deficits in the adult probably through neuroinflammation and epigenetic. However, the mode of action of alcohol during the initial exposure is less known while it may be the origin of the deficits seen in adults. Recent studies in adolescent rat hippocampus revealed that loss of memory occurred since the very first exposure to BD with similar mechanisms than those highlighted for longer alcohol exposure. Thus, initiation to BD in the young is responsible for cognitive deficits that will be probably entertained by repeated BD behavior. These kind of data may serve to reinforce the prevention campaigns towards the young population who practice BD.
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.

Vignette (© DR).
La consommation d’alcool chez les jeunes : une pratique qui dérive vers le binge drinking
Malgré une interdiction de vente aux moins de 18 ans en France1, l’alcool est la substance psychoactive la plus expérimentée chez les adolescents. L’enquête EnCLASS, initiée en 2018 [1], menée sur 20 000 collégiens et lycéens en France métropolitaine, indique que 44,3 % des élèves de classe de sixième ont déjà expérimenté l’alcool, qu’ils sont 75,3 % en classe de troisième, et 85 % au lycée. L’enquête révèle par ailleurs que 62,1 % des lycéens ont eu un usage d’alcool dans le mois précédant l’enquête, et que 16,7 % en ont un usage régulier (au moins 10 usages dans le mois précédent), des chiffres similaires à ceux observés dans l’enquête européenne ESPAD (european school project on alcohol and other drugs) de 20152.
La recherche de l’ivresse semble être un but important chez les jeunes. Ils sont 36,4 % en classe de seconde et 52,2 % en classe de terminale à déclarer avoir eu un épisode de consommation excessive au cours du mois précédant l’enquête. Un bilan plus exhaustif de l’évolution de la consommation d’alcool chez les jeunes révèle que si les chiffres diminuent depuis 2003, ceux concernant les usages excessifs, qu’ils soient réguliers, mensuels ou plus ou moins répétés dans le temps, restent stables depuis 2005 [2], avec un nombre d’épisodes de consommations excessives qui augmente avec l’usage de l’alcool. De fait, l’image globale de la consommation d’alcool chez les jeunes est celle d’une exacerbation des comportements de consommations excessives. En milieu étudiant, les enquêtes sont peu nombreuses, mais une étude a montré, en 2016, que 50 % des étudiants de 17 établissements français, rapportaient au moins un épisode de consommations excessives au cours du mois précédant l’enquête [3].
Ce mode de consommation, qui consiste donc à atteindre l’ivresse en consommant d’importantes quantités d’alcool en peu de temps, s’apparente à la notion d’intoxication éthylique aiguë : « … ingestion, délibérée, aiguë, d’alcool éthylique dont la traduction clinique est l’ivresse » [4]. Dans les pays anglo-saxons, ce mode de consommation se nomme binge drinking (BD). En français, le terme de « biture express » a été proposé et, dans les enquêtes de l’Observatoire français des drogues et des toxicomanies (OFDT), sont évoquées les « alcoolisations ponctuelles importantes » (ou API)3. Cependant, définir ce qu’est un binge drinker n’est pas aisé. L’Organisation mondiale de la santé (OMS) définit le BD comme la consommation d’au moins 60 g d’alcool pur en une occasion [5], ce qui correspond, dans notre pays, à six verres d’une boisson alcoolisée. Le BD pourrait se définir plus précisément par l’alternance répétée d’épisodes d’intoxication éthylique, avec une alcoolémie d’au moins 0,8 g/L, et de périodes d’abstinence [6]. Pourtant, cette définition simple émanant du NIAAA (national institute on alcohol abuse and alcoholism) [7], l’institut national américain pour l’abus d’alcool et l’alcoolisme, ne peut être considérée comme définitive, car elle ne prend pas en compte les notions de vitesse de consommation et de durée de pratique du BD. Finalement, boire beaucoup, rapidement et de temps en temps pourrait être une bonne traduction du terme (pour une définition plus opérationnelle du BD, voir [8]). Malgré les divergences dans la définition du comportement de BD, la communauté scientifique s’est appropriée ce terme, et cherche à mieux comprendre ses dimensions psychologiques, sociales et biologiques, afin d’en prévenir les conséquences à court et à long termes.
Adolescent/jeune adulte : un cerveau encore immature et très vulnérable
L’éthanol est un puissant psychotrope toxique (mais également un excellent tératogène…). On peut donc s’attendre à des conséquences importantes du BD chez l’adolescent et/ou le jeune adulte, puisque son cerveau est encore immature. En effet, la maturation cérébrale, selon les neuroscientifiques, se poursuit jusqu’à l’âge de 20 à 25 ans [9, 10]. Les dernières étapes de cette maturation concernent une réorganisation morpho-fonctionnelle des synapses, qui consiste à éliminer les connexions en surplus, tout en conservant celles qui sont le plus utiles, et en une myélinisation finale des axones, afin de rendre les réseaux de neurones les plus efficaces possible. La substance grise et la substance blanche continuent d’évoluer donc tardivement dans leur organisation structurelle : la substance grise corticale s’affine, alors que la substance blanche s’épaissit. Cette maturation finale suit, globalement, un ordre chronologique, commençant par les régions corticales postérieures pour se terminer vers le pôle antérieur, le cortex frontal. C’est cet ensemble de modifications dynamiques, tant anatomique que fonctionnelle et temporelle, qui fait du cerveau adolescent une cible particulièrement vulnérable aux dommages causés par l’alcoolisation. Il a d’ailleurs bien été montré une plus grande sensibilité à l’alcool du cerveau adolescent par rapport au cerveau adulte, faisant de cette période une fenêtre de vulnérabilité particulière [11].
Chez l’homme, au cours de cette période de maturation cérébrale finale, une accélération de la réduction de la substance grise dans le cortex frontal latéral et les aires temporales est observée [12]. Celle-là est corrélée à l’intensité de la pratique du BD [13] et est indépendante de la co-consommation de cannabis [14], une autre substance consommée par les jeunes. Sur le plan fonctionnel, des études en imagerie par résonance magnétique (IRM) révèlent des activations cérébrales aberrantes en réponse à des tâches relativement exigeantes sur le plan cognitif, dont la mémoire de travail et les processus d’inhibition [15]. Ces résultats sont proportionnels à la durée de l’alcoolisation avec des effets plus proéminents après plus de deux ans de pratique. Chez l’adolescent qui pratique le BD, la substance blanche est réduite au niveau du corps calleux, qui relie les deux hémisphères, et du pont de Varole, situé entre le mésencéphale et le myélencéphale [12]. De plus, l’intégrité de la substance blanche (mesurée par la technique d’imagerie du tenseur de diffusion [DTI] d’anisotropie fractionnelle)4 est détériorée, notamment dans le lobe frontal [16, 17]. Ces conséquences morphologiques ont des répercussions sur la sphère neurocognitive. Des déficits attentionnels, d’apprentissage et de mémorisation verbale [18], de process visuospatial ou émotionnel [19], et mnésique, ont ainsi été rapportés dans la littérature, chez les jeunes pratiquant le BD même de manière modérée [14]. Certaines altérations de structures cérébrales sont particulièrement bien documentées : le corps calleux est de volume réduit [20] comme celui du cortex préfrontal [21], de même que les hippocampes, chez les adolescents/jeunes adultes présentant un trouble de l’usage d’alcool [22, 23] (Figure 1).
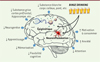 |
Figure 1. Les perturbations engendrées par la pratique du binge drinking dans la jeune population. Actuellement, on postule qu’une grande partie de ces anomalies se déclenchent par le biais de processus neuroinflammatoires et de modifications de l’épigénome qui perdureraient jusqu’à l’âge adulte. |
La recherche préclinique n’est pas en reste de résultats concernant la modélisation du BD afin d’étudier les comportements et les mécanismes cellulaires et moléculaires mis en jeu. À ce jour, l’ensemble des perturbations rapportées en clinique ont été répertoriées, aussi bien chez le rat que chez la souris, lorsque ceux-ci sont soumis à des épisodes d’intoxication éthylique pendant la période équivalent à l’adolescence chez l’homme. Les rats mâles exposés à l’alcool pendant le début de leur adolescence deviennent, par exemple, des adultes anxieux, alors qu’une exposition plus tardive les rend tolérants aux effets désinhibiteurs de l’alcool [24]. Ces animaux présentent également, à l’âge adulte, une appétence et une motivation plus importante à consommer de l‘alcool [25]. Des perturbations de la mémoire spatiale et de la flexibilité cognitive [26], de la reconnaissance de la nouveauté [27] associées entre autres, avec une perte de la neurogenèse dans l’hippocampe, structure clé des apprentissages, ainsi que des modifications de la connectivité dans le cortex frontal, ont également été rapportées chez ces animaux. Sur le plan des mécanismes cellulaires impliqués, il est admis qu’au moins deux systèmes sont perturbés : le système neuroimmunitaire, à l’origine des réactions neuroinflammatoires, et l’épigénome, qui modifiera les niveaux d’accessibilité de l’ADN à la machinerie transcriptionnelle. Chez le rat adolescent, le BD répété va en effet déclencher des réactions inflammatoires, notamment dans l’hippocampe et le cortex frontal, qui peuvent persister à l’âge adulte [26-30]. En ce qui concerne l’épigénome, de nombreuses études précliniques montrent la modification à long terme de processus, tels que l’acétylation des histones ou la méthylation de l’ADN, après exposition prolongée durant toute ou partie de l’adolescence chez le rat [31, 32].
Toutefois, ces études ne se sont pas intéressées au « seuil » d’épisodes de BD à partir duquel seront déclenchées les altérations cognitives et moléculaires chez l’adolescent ou le jeune adulte. Récemment des travaux ont été néanmoins effectués afin d’apporter des éléments de réponses à cette question.
Le rôle des R-NMDA dans la plasticité synaptique de l’hippocampe
Siège de la plasticité synaptique, un phénomène de modulation de la transmission d’information entre neurones glutamatergiques qui se déclenche lors d’un apprentissage, l’hippocampe assure le passage de la mémoire à court terme vers la mémoire à long terme [33]. Deux formes de plasticité synaptique coexistent dans cette structure : la potentialisation à long terme (PLT), qui augmente la communication entre les neurones, et la dépression à long terme (DLT), qui diminue cette communication. Associée à ces formes de plasticité fonctionnelle, il existe une plasticité structurelle par l’augmentation du nombre d’épines dendritiques lors de la PLT et une diminution lors de la DLT. La PLT est essentiellement liée à l’activation des récepteurs du glutamate de type NMDA (R-NMDA, récepteur du N-méthyle-D-aspartate), alors que la DLT peut être déclenchée majoritairement par ces mêmes récepteurs (DLT-NMDA, dépression à long terme dépendante des récepteurs NMDA), mais aussi par des récepteurs métabotropes5 du glutamate. L’éthanol, en prise aiguë, active les courants inhibiteurs portés par le récepteur de l’acide γ-aminobutyrique (GABA) de type A (R-GABA de type A) [34] et diminue la fonctionnalité des R-NMDA, ce qui expliquerait la diminution de la PLT et les déficits cognitifs associés en présence d’alcool [35]. Les R-NMDA sont constitués de deux sous-unités, GluN1 associée à GluN2A ou/et GluN2B. La sous-unité GluN2B est particulièrement sensible aux effets de l’éthanol [36]. Or, les R-NMDA présentent des propriétés électrophysiologiques qui dépendent de leur composition en sous-unités, ce qui peut avoir un impact sur leur rôle dans la plasticité synaptique [37]. Les effets de l’éthanol modifient la balance excitation/inhibition dans les réseaux de neurones ce qui, à force de répétition, engendre un état d’inhibitions neuronales renforcées. Il apparaîtra alors un rebond excitateur au cours du sevrage à l’alcool : une hyperexcitabilité associée à une excitotoxicité6. La répétition des cycles d’intoxication et de sevrage serait donc la clé du développement de l’addiction [38]. Toutefois, les effets à long terme du BD sur les processus cognitifs et la plasticité synaptique sous-jacente ne sont pas suffisamment documentés et la question de savoir à partir de quand sont déclenchées ces perturbations reste non résolue.
Premiers binges et plasticité synaptique dans l’hippocampe chez le jeune rat : épigénétique et inflammation
Pour répondre aux questions non encore résolues sur le début des dommages induits par le BD, un modèle d’expositions à l’éthanol, représentatif de la situation rencontrée aux urgences hospitalières, a été développé chez le rat. Des rats adolescents ont été exposés à deux épisodes de BD (3 g d’éthanol pur/kg de poids, par voie intrapéritonéale) atteignant une éthanolémie de 2 g/L, espacés d’un équivalent de 24 h à l’échelle humaine, mimant ainsi deux soirées bien « arrosées ». Quarante-huit heures plus tard, lorsque l’éthanol est éliminé, les capacités d’apprentissage des animaux et la plasticité synaptique, ainsi que le rôle de GluN2B dans la transmission synaptique, ont été mesurés dans des tranches coronales d’hippocampe dorsal. Les résultats de cette analyse ont montré que la DLT-NMDA était particulièrement sensible aux deux épisodes de BD, puisque la DLT était abolie pendant au moins quatre jours (Figure 2A) et que, sans cette DLT, les rats étaient incapables de reconnaître un nouvel objet dans leur environnement (Figure 2C). La transmission synaptique glutamatergique était, par ailleurs, plus sensible à l’effet inhibiteur d’un antagoniste de GluN2B (Figure 2B) et moins sensible à un antagoniste de GluN2A, suggérant un rôle prépondérant de ces sous-unités dans les modifications de la DLT-NMDA et le défaut d’apprentissage induits par l’éthanol [39, 40]. Dans l’étude princeps des effets d’un faible nombre de BD sur les processus cognitifs, les auteurs ont montré que l’abolition de la DLT était également obtenue en remplaçant l’éthanol par la kétamine, un antagoniste de courte durée d’action du R-NMDA, mais pas par le MK-801, un antagoniste de longue durée d’action du R-NMDA, et pas, non plus, par des agonistes du R-GABA de type A. Ainsi, les déficits cognitifs, suite à deux BD, étaient dus à un blocage répété et de courte durée du récepteur NMDA. D’autres expériences ont montré que l’absence de DLT-NMDA s’accompagnait, dans l’hippocampe, d’un taux trop élevé d’HDAC2 (histone déacétylase 2), un isotype d’histones déacétylases qui participe aux modifications épigénétiques7. Grâce à la cytométrie en flux, un plus grand nombre de neurones de l’hippocampe contenant une quantité plus importante d’HDAC2 a été observé ; un résultat qui a été confirmé par immunohistochimie (Figure 2D). Des expériences d’immunoprécipitation de la chromatine ont également indiqué un enrichissement, après deux BD, en HDAC2 du promoteur du gène codant GluN2B mais pas du promoteur du gène codant GluN2A. D’autre part, la plus grande sensibilité à l’antagoniste de GluN2B s’accompagne d’une augmentation de production de cette sous-unité, sans modification de la quantité de sous-unité GluN2A, suggérant une modification de la composition du récepteur NMDA, et donc de ses propriétés électrophysiologiques [37, 40]. L’ensemble de ces modifications peuvent être prévenues par un pré-traitement des animaux, 30 min avant chaque binge, par le butyrate de sodium (600 mg/kg par voie intrapéritonéale [i.p.]), un inhibiteur d’histones déacétylases [40] (Figure 3). Ces études suggèrent donc que deux BD modifient, par des processus épigénétiques, la composition en sous-unités GluN2B du récepteur NMDA, provoquant le blocage de la DLT-NMDA et donc l’altération des apprentissages.
 |
Figure 2. Modifications mesurées 48 h après deux épisodes de binge drinking chez le rat adolescent. A. L’amplitude de la plasticité synaptique de type dépression à long terme et dépendante du récepteur NMDA (DLT) enregistrée sur tranche d’hippocampe est abolie. B. La transmission synaptique au glutamate est plus sensible à un antagoniste de la sous-unité GluN2B du R-NMDA. C. L’apprentissage de la nouveauté chez le jeune rat est défaillant. D. Dans le champ CA1 (carré noir) où les enregistrements de DLT sont effectués, un nombre plus important de cellules présentent un marquage plus intense pour l’histone désacétylase HDAC2. NaCl : groupe contrôle ; EtOH : groupe traité avec deux épisodes de binge drinking. * : p < 0,05 ; *** : p < 0,001. |
 |
Figure 3. Le prétraitement des animaux à l’aide d’un inhibiteur d’histones désacétylases (iHDAC) ou de minocycline prévient les effets des deux épisodes de binge drinking. A. La NMDA-DLT est maintenue à une amplitude proche de celle mesurée dans le groupe contrôle. B..La surexpression de la sous-unité GluN2B du R-NMDA est prévenue et un accroissement de la sensibilité à un antagoniste de GluN2B n’est plus observée. C. L’apprentissage de la nouveauté est préservé. NaB : butyrate de sodium, un inhibiteur d’histones déacétylases, administré à 600 mg/kg par voie intrapéritonéale ; MINO : minocycline, un antibiotique aux propriétés anti-inflammatoires, administré à 45 mg/kg par voie intrapéritonéale. |
Le rôle des processus neuroinflammatoires dans ces altérations a été examiné initialement en appliquant de l’interleukine 1β (IL-1β), une cytokine pro-inflammatoire, sur des tranches d’hippocampe d’animaux contrôles. Ce traitement ex vivo provoquait l’arrêt du déclenchement de la DLT-NMDA, encourageant à vérifier la présence d’une telle inflammation chez les rats présentant des déficits d’apprentissage 48 h après deux BD. Cependant, à ce moment, l’inflammation n’est plus visible dans l’hippocampe : les cellules microgliales, qui assurent la réponse inflammatoire au sein du cerveau, sont dans un état basal, non activées, et les quantités d’ARN messagers (ARNm) de différentes cytokines pro-inflammatoires ne sont pas augmentées, y compris celle de l’ARNm codant l’IL-1β. Toutefois, une activation astrocytaire (ou astrogliose réactionnelle) et une neurogenèse accrue sont observées, révélant une souffrance tissulaire et de possibles processus de réparation/compensation à la suite de l’exposition à l‘éthanol [41]. L’inflammation n’est donc plus visible 48 h après les deux BD, au moment des pertes de mémoire, suggérant un déclenchement du processus inflammatoire plus précoce, autour du pic d’éthanolémie. Pour tester cette hypothèse, des rats ont été traités, 30 minutes avant chaque BD, par des molécules ayant des propriétés anti-inflammatoires via différentes cibles cellulaires : la minocycline (45 mg/kg i.p.), un antibiotique de la famille des tétracyclines aux propriétés neuroprotectrices ; l’indométhacine, un anti-inflammatoire non stéroïdien (4 mg/kg i.p.), ou le TAK-242 (3 mg/kg, i.p.), un antagoniste du TLR4 (Toll-like receptor 4), un récepteur exprimé par les cellules microgliales et activé par l’éthanol [28]. Chacune de ces molécules permet de prévenir les effets délétères de l’éthanol sur l’apprentissage, sur la DLT-NMDA ainsi que sur la transmission synaptique (Figure 3). Les deux BD semblent donc provoquer une inflammation, probablement très tôt après l’administration d’alcool, qui est impliquée dans les pertes de mémoire que l’on observe 48 h plus tard [42]. Des résultats complémentaires ont par ailleurs indiqué que la minocycline permettait de prévenir la surexpression d’HDAC2 induite par l’éthanol seul. Les déficits d’apprentissage induits par l’alcool apparaissent donc relayés par une inflammation et une modification de la composition en sous-unités du R-NMDA impliquant des mécanismes épigénétiques.
Conclusion
Chez le rat adolescent, peu d’épisodes d’intoxication aiguë à l’éthanol sont nécessaires pour déclencher des altérations de la mémoire, qui sont certes transitoires, mais qui durent plusieurs jours. Ces effets délétères, tant sur le plan comportemental que sur le plan de la plasticité synaptique, sont prévenus par des anti-inflammatoires et impliquent une reconfiguration des récepteurs NMDA via des mécanismes épigénétiques. Si nous commençons à comprendre les mécanismes cellulaires par lesquels le binge drinking altère la mémoire à un moment où le cerveau achève sa maturation et où les apprentissages sont primordiaux dans le devenir des jeunes, il reste important de développer les aspects de prévention afin de lutter contre ces représentations, encore très positives chez les jeunes, des consommations d’alcool excessives.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Technique de tractographie permettant d’évaluer l’intégrité des faisceaux de matière blanche. Elle est fondée sur la mesure de la symétrie de diffusion de l’eau dans le cerveau, influencée par les faisceaux de fibres blanches qui évoquent une asymétrie, appelée anisotropie, dans un tenseur. L’anisotropie fractionnelle est une mesure de la fraction de diffusion qui contribue à l’anisotropie.
Références
- https://www.ofdt.fr/enquetes-et-dispositifs/enquete-enclass/. [Google Scholar]
- https://www.ofdt.fr/publications/collections/rapports/thema/escapad-20-ans-dobservation-des-usages-ladolescence-thema/. [Google Scholar]
- Luquiens A, Falissard B, Aubin HJ. Students worry about the impact of alcohol on quality of life: Roles of frequency of binge drinking and drinker self-concept. Drug Alcohol Depend 2016 ; 167 : 42–48. [CrossRef] [PubMed] [Google Scholar]
- Menecier P, Rotheval L. Alcohol intoxication in old age. Soins Gerontol 2017 ; 22 : 21–24. [CrossRef] [PubMed] [Google Scholar]
- Desai A.. Governments confront drunken violence. Bull World Health Organ 2010 ; 88 : 644–645. [CrossRef] [PubMed] [Google Scholar]
- Courtney KE, Polich J. Binge drinking in young adults: Data, definitions, and determinants. Psychol Bull 2009 ; 135 : 142–156. [CrossRef] [PubMed] [Google Scholar]
- https://www.niaaa.nih.gov/alcohol-health/overview-alcohol-consumption/moderate-binge-drinking. [Google Scholar]
- Maurage P, Lannoy S, Mange J, et al. What we talk about when we talk about binge drinking: towards an integrated conceptualization and evaluation. Alcohol Alcohol 2020; 55 : 468–79. [CrossRef] [PubMed] [Google Scholar]
- Kozlov M. Your brain expands and shrinks over time – these charts show how. Nature 2022; 604 : 230–1. [CrossRef] [PubMed] [Google Scholar]
- Gogtay N, Giedd JN, Lusk Let al. Dynamic mapping of human cortical development during childhood through early adulthood. Proc Natl Acad Sci USA 2004 ; 101 : 8174–8179. [CrossRef] [PubMed] [Google Scholar]
- Spear LP. Effects of adolescent alcohol consumption on the brain and behaviour. Nat Rev Neurosci 2018 ; 19 : 197–214. [CrossRef] [PubMed] [Google Scholar]
- Squeglia LM, Tapert SF, Sullivan EVet al. Brain development in heavy drinking adolescents. Am J Psychiatry 2015 ; 172 : 531–542. [CrossRef] [PubMed] [Google Scholar]
- Infante MA, Eberson SC, Zhang Y, Brumback T, et al. Adolescent binge drinking is associated with accelerated decline of gray matter volume. Cereb Cortex 2022; 32 : 2611–20. [CrossRef] [PubMed] [Google Scholar]
- Tapert SF, Eberson-Shumate S. Alcohol and the adolescent brain: what we’ve learned and where the data are taking us. Alcohol Res 2022; 42 : 7. [CrossRef] [Google Scholar]
- Norman AL, Pulido C, Squeglia LMet al. Neural activation during inhibition predicts initiation of substance use in adolescence. Drug Alcohol Depend 2011 ; 119 : 216–223. [CrossRef] [PubMed] [Google Scholar]
- Zhao Q, Sullivan EV, Honnorat N, et al. Association of heavy drinking with deviant fiber tract development in frontal brain systems in adolescents. JAMA Psychiatry 2021; 78 : 407–15. [CrossRef] [PubMed] [Google Scholar]
- Smith KW, Gierski F, Andre Jet al. Altered white matter integrity in whole brain and segmetns of corpus callosum, in young social drinkers with binge drinking pattern. Addict Biol 2017 ; 22 : 490–501. [CrossRef] [PubMed] [Google Scholar]
- Gierski F, Stefaniak N, Benzerouk F, et al. Component process analysis of verbal memory in a sample of students with a binge drinking pattern. Addict Behav Rep 2020; 12 : 100323. [PubMed] [Google Scholar]
- Lannoy S, Dricot L, Benzerouk F, et al. Neural responses to the implicit processing of emotional facial expressions in Binge Driking. Alcohol Alcohol 2021; 56 : 166–74. [CrossRef] [PubMed] [Google Scholar]
- McQueeny T, Schweinsburg BC, Schweinsburg ADet al. Altered white matter integrity in adolescent binge drinkers. Alcohol Clin Exp Res 2009 ; 33 : 1278–1285. [CrossRef] [PubMed] [Google Scholar]
- Medina KL, McQueeny T, Nagel BJet al. Prefrontal cortex volumes in adolescents with alcohol use disorders: unique gender effects. Alcohol Clin Exp Res 2008 ; 32 : 386–394. [CrossRef] [PubMed] [Google Scholar]
- De Bellis MD, Clark DB, Beers SRet al. Hippocampal volume in adolescent-onset alcohol use disorders. Am J Psychiatry 2000 ; 157 : 737–744. [CrossRef] [PubMed] [Google Scholar]
- Nagel BJ, Schweinsburg AD, Phan Vet al. Reduced hippocampal volume among adolescents with alcohol use disorders without psychiatric comorbidity. Psychiatry Res 2005 ; 139 : 181–190. [CrossRef] [PubMed] [Google Scholar]
- Spear LP. Adolescent alcohol exposure: Are there separable vulnerable periods within adolescence?. Physiol Behav 2015 ; 148 : 122–130. [CrossRef] [PubMed] [Google Scholar]
- Alaux-Cantin S, Warnault V, Legastelois Ret al. Alcohol intoxications during adolescence increase motivation for alcohol in adult rats and induce neuroadaptations in the nucleus accumbens. Neuropharmacology 2013 ; 67 : 521–531. [CrossRef] [PubMed] [Google Scholar]
- Nunes PT, Kipp BT, Reitz NLet al. Aging with alcohol-related brain damage: Critical brain circuits associated with cognitive dysfunction. Int Rev Neurobiol 2019 ; 148 : 101–168. [CrossRef] [PubMed] [Google Scholar]
- Macht V, Elchert N, Crews F. adolescent alcohol exposure produces protracted cognitive-behavioral impairments in adult male and female rats. Brain Sci 2020; 10 : 785. [CrossRef] [PubMed] [Google Scholar]
- Montesinos J, Pascual M, Rodríguez-Arias Met al. Involvement of TLR4 in the long-term epigenetic changes, rewarding and anxiety effects induced by intermittent ethanol treatment in adolescence. Brain Behav Immun 2016 ; 53 : 159–171. [CrossRef] [PubMed] [Google Scholar]
- Macht V, Crews FT, Vetreno RP. Neuroimmune and epigenetic mechanisms underlying persistent loss of hippocampal neurogenesis following adolescent intermittent ethanol exposure. Curr Opin Pharmacol 2020; 50 : 9–16. [CrossRef] [PubMed] [Google Scholar]
- Pascual M, Calvo-Rodriguez M, Núñez L, et al. Toll-like receptors in neuroinflammation, neurodegeneration, and alcohol-induced brain damage. IUBMB Life 2021; 73 : 900–15. [CrossRef] [PubMed] [Google Scholar]
- Sakharkar AJ, Vetreno RP, Zhang Het al. A role for histone acetylation mechanisms in adolescent alcohol exposure-induced deficits in hippocampal brain-derived neurotrophic factor expression and neurogenesis markers in adulthood. Brain Struct Funct 2016 ; 221 : 4691–4703. [CrossRef] [PubMed] [Google Scholar]
- Coleman LG Jr, Crews FT, Vetreno RP. The persistent impact of adolescent binge alcohol on adult brain structural, cellular, and behavioral pathology: A role for the neuroimmune system and epigenetics. Int Rev Neurobiol 2021; 160 : 1–44. [CrossRef] [PubMed] [Google Scholar]
- Neves G, Cooke SF, Bliss TV. Synaptic plasticity, memory and the hippocampus: a neural network approach to causality. Nat Rev Neurosci 2008 ; 9 : 65–75. [CrossRef] [PubMed] [Google Scholar]
- Peoples RW, Weight FF. Differential alcohol modulation of GABA(A) and NMDA receptors. Neuroreport 1999 ; 10 : 97–101. [CrossRef] [PubMed] [Google Scholar]
- Lovinger DM, White G, Weight FF. Ethanol inhibits NMDA-activated ion current in hippocampal neurons. Science 1989 ; 243 : 1721–1724. [CrossRef] [PubMed] [Google Scholar]
- Naassila M, Pierrefiche O. GluN2B subunit of the NMDA receptor: the keystone of the effects of alcohol during neurodevelopment. Neurochem Res 2019 ; 44 : 78–88. [CrossRef] [PubMed] [Google Scholar]
- Paoletti P, Bellone C, Zhou Q. NMDA receptor subunit diversity: impact on receptor properties, synaptic plasticity and disease. Nat Rev Neurosci 2013 ; 14 : 383–400. [CrossRef] [PubMed] [Google Scholar]
- Kimbrough A, Kim S, Cole Met al. Intermittent access to ethanol drinking facilitates the transition to excessive drinking after chronic intermittent ethanol vapor exposure. Alcohol Clin Exp Res 2017 ; 41 : 1502–1509. [CrossRef] [PubMed] [Google Scholar]
- Silvestre de Ferron B, Bennouar KE, Kervern M, et al. Two binges of ethanol a day keep the memory away in adolescent rats: key role for GluN2B subunit. Int J Neuropsychopharmacol 2015; 19 : pyv087. [Google Scholar]
- Drissi I, Deschamps C, Fouquet G, et al. Memory and plasticity impairment after binge drinking in adolescent rat hippocampus: GluN2A/GluN2B NMDA receptor subunits imbalance through HDAC2. Addict Biol 2020; 25 : e12760. [CrossRef] [PubMed] [Google Scholar]
- Vilpoux C, Fouquet G, Deschamps C, et al. Astrogliosis and compensatory neurogenesis after the first ethanol binge drinking-like exposure in the adolescent rat. Alcohol Clin Exp Res 2022; 46 : 207–20. [CrossRef] [PubMed] [Google Scholar]
- Deschamps C, Uyttersprot F, Debris M, et al. Anti-inflammatory drugs prevent memory and hippocampal plasticity deficits following initial binge-like alcohol exposure in adolescent male rats. Psychopharmacology (Berl) 2022; 239 : 2245–62. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Les perturbations engendrées par la pratique du binge drinking dans la jeune population. Actuellement, on postule qu’une grande partie de ces anomalies se déclenchent par le biais de processus neuroinflammatoires et de modifications de l’épigénome qui perdureraient jusqu’à l’âge adulte. |
| Dans le texte | |
 |
Figure 2. Modifications mesurées 48 h après deux épisodes de binge drinking chez le rat adolescent. A. L’amplitude de la plasticité synaptique de type dépression à long terme et dépendante du récepteur NMDA (DLT) enregistrée sur tranche d’hippocampe est abolie. B. La transmission synaptique au glutamate est plus sensible à un antagoniste de la sous-unité GluN2B du R-NMDA. C. L’apprentissage de la nouveauté chez le jeune rat est défaillant. D. Dans le champ CA1 (carré noir) où les enregistrements de DLT sont effectués, un nombre plus important de cellules présentent un marquage plus intense pour l’histone désacétylase HDAC2. NaCl : groupe contrôle ; EtOH : groupe traité avec deux épisodes de binge drinking. * : p < 0,05 ; *** : p < 0,001. |
| Dans le texte | |
 |
Figure 3. Le prétraitement des animaux à l’aide d’un inhibiteur d’histones désacétylases (iHDAC) ou de minocycline prévient les effets des deux épisodes de binge drinking. A. La NMDA-DLT est maintenue à une amplitude proche de celle mesurée dans le groupe contrôle. B..La surexpression de la sous-unité GluN2B du R-NMDA est prévenue et un accroissement de la sensibilité à un antagoniste de GluN2B n’est plus observée. C. L’apprentissage de la nouveauté est préservé. NaB : butyrate de sodium, un inhibiteur d’histones déacétylases, administré à 600 mg/kg par voie intrapéritonéale ; MINO : minocycline, un antibiotique aux propriétés anti-inflammatoires, administré à 45 mg/kg par voie intrapéritonéale. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




