| Issue |
Med Sci (Paris)
Volume 41, Number 5, Mai 2025
Enjeux et objectifs de la psychiatrie de précision
|
|
|---|---|---|
| Page(s) | 434 - 442 | |
| Section | La psychiatrie de précision (PEPR PROPSY) : hypothèses et outils | |
| DOI | https://doi.org/10.1051/medsci/2025068 | |
| Published online | 26 May 2025 | |
Approche dimensionnelle des symptômes négatifs dans les troubles psychiatriques
A dimensional approach to negative symptoms in psychiatric disorders
1
Service de Psychiatrie, CHU d’Orléans, EPSM du Loiret, Laboratoire Interdisciplinaire pour l’innovation et la recherche en santé d’Orléans (LI2RSO), Université d’Orléans, Orléans, France
2
Centre expert schizophrénie, Hôpital A. Chenevier, Université Paris Est, Inserm U955, Paris, France
3
Service de psychiatrie adulte, Département de psychiatrie Hôpitaux universitaires de Genève et Université de Genève, Genève, Suisse
4
Hôpital A. Chenevier, AP-HP, Fondation FondaMental, Créteil, France
5
Université de Strasbourg, Strasbourg, France
Les symptômes négatifs occupent une place centrale dans les troubles psychiatriques, notamment dans le trouble schizophrénique, le trouble bipolaire, le trouble du spectre de l’autisme et la dépression. Ces symptômes, qui incluent le retrait social, l’anhédonie, l’avolition et l’émoussement affectif ainsi que l’alogie, sont souvent difficiles à traiter et sous-évalués par rapport aux symptômes positifs, tels que les hallucinations. Cependant, leur impact sur la qualité de vie et leurs conséquences fonctionnelles à long terme justifient une exploration approfondie. L’approche transdiagnostique permet d’explorer ces symptômes au-delà des catégories cliniques traditionnelles. La prévalence des symptômes négatifs dans la population générale et chez les individus atteints de troubles psychiatriques est analysée dans le cadre de la cohorte French Minds, en utilisant l’échelle SNS. Des thérapeutiques numériques et psychosociales montrent des résultats prometteurs, ouvrant la voie à des traitements plus personnalisés et plus efficaces.
Abstract
Negative symptoms play a central role in psychiatric disorders, including schizophrenia, bipolar, autism spectrum disorder, and depression. These symptoms, which include social withdrawal, anhedonia, avolition, alogia, and blunted affect, are often difficult to treat and are overlooked in comparison to positive symptoms such as hallucinations. However, their impact on patients’ quality of life and long-term functional outcomes warrants in-depth exploration. The transdiagnostic approach makes it possible to study of these symptoms beyond traditional clinical categories. The SNS scale will be used in the French Mind cohort to analyse the prevalence of negative symptoms in the general population and in people with psychiatric disorders. Digital and psychosocial therapies are showing promising results, paving the way for more personalized and effective treatments.
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© AdobeStock).
Bien que l’efficacité des traitements pharmacologiques antipsychotiques pour réduire les symptômes psychotiques positifs soit bien documentée, les symptômes négatifs sont plus résistants, et il est nécessaire d’améliorer leur description, ainsi que la compréhension de leur physiopathologie et leur traitement, à l’aide d’outils cliniques, biologiques, cognitifs et numériques. Les symptômes négatifs comprennent deux dimensions principales : la diminution de l’expression (notamment l’expression émotionnelle, avec l’émoussement des affects et l’alogie1) et l’apathie (comprenant l’avolition2, l’anhédonie3 et le retrait social) [1]. Historiquement, ces symptômes ont été décrits dans le cadre nosographique4 des troubles du spectre de la schizophrénie, comprenant la schizophrénie, le trouble schizophrénique et le trouble schizo-affectif. Kraepelin et Bleuler5, qui furent parmi les premiers psychiatres à individualiser ces troubles, ont ainsi mis en évidence l’émoussement affectif et le retrait émotionnel comme des symptômes clés [2]. Les symptômes négatifs sont observés dans les formes chroniques de la schizophrénie, mais peuvent également apparaître tôt dans l’évolution de la maladie [3] ou même en constituer des prodromes6 [4]. De plus, ils peuvent être observés dans d’autres troubles, tels que les troubles dépressifs (uni- ou bipolaires), pour lesquels la perte de motivation [5] et l’anhédonie [6] sont fréquentes, les troubles du spectre de l’autisme, le trouble obsessionnelcompulsif [7], le trouble schizo-affectif, chez les sujets à ultra-haut risque de psychose [8], dans les maladies neurologiques [9] et même en population générale [3,10,11].
L’initiative « Research Domain Criteria » (RDoC) du National Institute of Mental Health (NIMH) soutient de nouvelles méthodes pour conceptualiser et regrouper l’hétérogénéité des troubles psychiatriques [12]. Une reconceptualisation des symptômes négatifs, empruntée à la description clinique classique de la schizophrénie, offrirait une nouvelle perspective pour comprendre la symptomatologie. Cela permettrait de mieux saisir l’hétérogénéité des symptômes, d’améliorer la précision diagnostique en identifiant des entités transnosographiques mesurables, associées à des biomarqueurs objectifs, et de développer des approches thérapeutiques plus ciblées. Dans le premier épisode psychotique, dans les troubles schizophréniques, dépressifs, bipolaires ou dans les troubles du spectre de l’autisme, les symptômes négatifs peuvent contribuer à des déficits de communication sociale et de réciprocité socio-émotionnelle. Ces déficits incluent la réduction du partage affectif, du contact visuel, des expressions faciales et de l’utilisation des gestes, qui pourraient tous constituer des cibles thérapeutiques.
Les symptômes négatifs affectent à la fois les compétences sociales, professionnelles, et les comportements orientés vers des objectifs. Ils entraînent une limitation de la communication interpersonnelle, des activités, et peuvent réduire la qualité de vie et le fonctionnement des individus. Comprendre la structure dimensionnelle7 des symptômes négatifs et leur chevauchement avec d’autres troubles, ainsi que leurs mécanismes biologiques associés, est essentiel pour faire progresser la recherche et leur prise en charge. Un défi majeur dans leur compréhension et leur traitement est qu’il est souvent difficile de savoir s’ils sont primaires (liés à l’étiologie de la maladie), ou secondaires (liés à la médication, à d’autres dimensions cliniques, ou à la consommation de substances psychoactives).
Au niveau biologique, la compréhension des troubles psychiatriques sus-cités a évolué à travers différentes hypothèses. Parmi celles-ci, figurent la théorie de la dysrégulation de la dopamine, qui lie la schizophrénie à une sous-activité des voies de la dopamine ; l’hypothèse du déséquilibre GABA/glutamate, liée à une perturbation de la signalisation des neurotransmetteurs ; et l’hypothèse inflammatoire, qui implique une neuroinflammation chronique et une activation du système immunitaire. Ces théories ont amélioré notre connaissance de la physiopathologie neuropsychiatrique, bien que des défis, notamment dans le traitement des symptômes négatifs, persistent. En effet, les symptômes négatifs sont souvent résistants aux traitements (anti-psychotiques, antidépresseurs, ou autres) [13]. Les symptômes liés à l’expression (affects émoussés, alogie, repli social) et expérientiels (anhédonie et amotivation) apparaissent tôt dans la maladie et ont tendance à persister [14]. Comprendre les symptômes négatifs comme une caractéristique transnosographique pourrait mener à des interventions plus personnalisées et plus efficaces, quel que soit le trouble psychiatrique sous-jacent.
La nature transnosographique des symptômes négatifs
Les symptômes négatifs sont des critères diagnostiques de la schizophrénie, selon le DSM-58 [15]. Ils incluent l’émoussement affectif (réduction des expressions émotionnelles), l’alogie (diminution de la parole), le retrait social (activité sociale réduite accompagnée d’une baisse d’intérêt à nouer des relations sociales avec les autres), l’avolition (réduction de l’initiation et de la poursuite d’une activité) et l’anhédonie (réduction du plaisir) (Figure 1). Plus de 75 % des sujets atteints de schizophrénie et 80 % des soignants rapportent que des symptômes négatifs résiduels persistent malgré le traitement avec des antipsychotiques [16,17].
 |
Figure 1 Les symptômes négatifs sont classés dans deux dimensions (en rouge) : le déficit émotionnel et l’hypo-expressivité. Les sections du DSM-5 incluent des termes reflétant l’un des cinq domaines consensuels des symptômes négatifs définis par le NIMH, dans leurs critères diagnostiques ou caractéristiques associées à la schizophrénie, les troubles bipolaires, le trouble dépressif récurrent, et le trouble du spectre de l’autisme. |
Dans le trouble dépressif récurrent, des symptômes négatifs tels que l’avolition et l’anhédonie sont prédominants. Ces symptômes sont similaires à ceux observés dans la schizophrénie, et contribuent à un mauvais fonctionnement psychosocial [2]. Dans la dépression, l’anhédonie (critère diagnostique de l’épisode dépressif caractérisé, selon le DSM-5) serait prédictive d’un mauvais pronostic, avec des épisodes de dépression plus longs et une altération plus importante de la qualité de vie [6,18]. Cependant, les autres symptômes de la dépression, tels que l’humeur dépressive, les troubles du sommeil et la suicidalité, ne sont pas des symptômes négatifs.
La prévalence des symptômes négatifs dans les troubles bipolaires varie de 20 à 89 % [19]. L’apathie, l’anhédonie et l’émoussement affectif peuvent se manifester pendant les phases euthymiques (périodes de stabilité de l’humeur). La persistance de ces symptômes suggère qu’ils ne sont pas simplement liés aux épisodes aigus de l’humeur (qu’ils soient dépressifs ou maniaques), mais qu’ils pourraient refléter des dysfonctionnements neurobiologiques ou psychologiques sous-jacents, intrinsèques au trouble lui-même, indépendamment des fluctuations de l’humeur [19]. Des études ont trouvé des niveaux similaires d’apathie chez les sujets souffrant de troubles bipolaires et de schizophrénie, renforçant l’hypothèse que les symptômes négatifs ne sont pas spécifiques aux troubles psychotiques [20]. Le même modèle à deux facteurs des symptômes négatifs, basé sur les scores PANSS (positive and negative syndrome scale), a été retrouvé dans les troubles bipolaires et la schizophrénie [21], avec des symptômes négatifs plus graves chez les patients déprimés. Cependant, il est suggéré que la qualité de l’anhédonie pourrait différer. L’anhédonie anticipatoire9 serait plus spécifique à la schizophrénie, tandis que l’anhédonie consommatoire10 pourrait être plus spécifique à la dépression [2]. De même, l’émoussement affectif concerne plus spécifiquement les sujets atteints de schizophrénie et de troubles du spectre de l’autisme que ceux souffrant de troubles de l’humeur [22]. Dans les troubles bipolaires, les symptômes négatifs peuvent être liés à de moins bons résultats fonctionnels, particulièrement lorsque l’apathie est associée à des symptômes dépressifs ou psychotiques [19,23]. Cependant, en raison du peu de données, comprendre le rôle exact de ces symptômes dans le trouble bipolaire reste difficile, notamment pour les distinguer des états dépressifs ou des effets indésirables des médicaments.
De manière similaire, les individus atteints de troubles du spectre de l’autisme présentent des symptômes négatifs, mais également des déficits spécifiques de la communication et des interactions sociales, en particulier dans la réciprocité socio-émotionnelle et la communication [12]. Les symptômes négatifs dans les troubles du spectre de l’autisme incluent une réduction du partage des émotions, un manque d’initiative sociale et des déficits dans la communication non verbale, tels qu’un mauvais contact visuel et une utilisation limitée des gestes ou des expressions faciales [22]. Cependant, les déficits de communication et d’interaction sociale, caractéristiques centrales des troubles du spectre de l’autisme, ne relèvent pas strictement des symptômes négatifs et doivent être distingués de ces derniers. Dans les troubles du spectre de l’autisme, ces symptômes conduisent souvent à un repli social et à des difficultés à établir des relations significatives. Le flux de la communication spontanée et de la conversation est également perturbé, rendant les interactions sociales difficiles. Bien que ces symptômes se chevauchent avec ceux observés dans la schizophrénie, ils diffèrent par leur inscription dans un cadre neurodéveloppemental spécifique. Cela souligne l’importance d’approches complémentaires, à la fois spécifiques au trouble et transnosographiques, pour mieux comprendre ces dimensions et optimiser les traitements.
Les progrès dans les biomarqueurs diagnostiques et la physiopathologie des troubles psychiatriques
Les récentes avancées en psychiatrie biologique ont démontré, au cours des deux dernières décennies, le potentiel des biomarqueurs diagnostiques pour affiner ou remplacer les systèmes diagnostiques basés sur les symptômes. Cependant, leur application en psychiatrie clinique reste limitée. La compréhension de la physiopathologie des troubles psychiatriques, tels que les troubles schizophréniques, les troubles du spectre de l’autisme, les troubles bipolaires et la dépression, a évolué, passant des théories neurochimiques (par exemple, la dysrégulation de la dopamine) à des modèles intégrant des déséquilibres des neurotransmetteurs excitateurs et inhibiteurs (GABA/glutamate) et l’inflammation médiée par le système immunitaire. Ces évolutions reflètent une prise en compte croissante des interactions ayant lieu entre les facteurs neurochimiques, immunitaires et environnementaux, dans l’émergence des symptômes psychiatriques.
Les cytokines inflammatoires, telles que l’IFN-α (interféron), le TNF-α (tumor necrosis factor) et l’IL-6 (interleukine), ont une action sur les ganglions de la base11 et la fonction dopaminergique, contribuant aux symptômes neuropsychiatriques, notamment la dépression, l’anhédonie et la fatigue (Figure 2) [24]. Des études humaines et animales montrent que les cytokines modifient la neurotransmission de la dopamine en réduisant sa synthèse, en altérant son stockage vésiculaire, en augmentant sa recapture et en amplifiant le stress oxydatif. La synthèse de la dopamine nécessite la tyrosine hydroxylase et son cofacteur, la tétrahydrobioptérine (BH4), tous deux sensibles au stress oxydatif [25]. Les processus inflammatoires augmentent la production de réactifs oxydatifs (ROS) et induisent l’activité de l’oxyde nitrique synthase (NOS), réduisant la disponibilité en BH4 [25]. Une réduction de BH4 perturbe la conversion de la phénylalanine en tyrosine et en L-DOPA (lévodopa), des étapes essentielles de la production de dopamine. Le stress oxydatif, exacerbé par la production de l’acide quinolinique (QUIN) via la voie de la kynurénine, et réduit ultérieurement la synthèse et la fonction de la dopamine. Des ratios élevés de phénylalanine/tyrosine, observés dans les contextes inflammatoires, sont corrélés à une disponibilité réduite de la dopamine, et à des symptômes neuropsychiatriques tels que les troubles du sommeil et l’anhédonie [26].
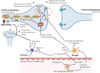 |
Figure 2 Mécanismes potentiels des effets des cytokines inflammatoires sur la synthèse et la libération de dopamine dans les ganglions de la base. Les preuves indiquent que les cytokines inflammatoires provenant de la périphérie, ou celles produites localement par la microglie activée ou les macrophages infiltrants, peuvent produire du monoxyde d’azote ainsi que de l’acide quinolinique via la voie de l’indoleamine 2,3-dioxygénase (IDO) et les voies de la kynurénine, contribuant toutes au stress oxydatif et à la génération d’espèces réactives de l’oxygène (ROS). L’augmentation des ROS et du monoxyde d’azote induite par l’inflammation contribue à (1) L’oxydation de la tétrahydrobioptérine (BH4), un cofacteur essentiel à la conversion de la phénylalanine en tyrosine et de la tyrosine en L-3,4-dihydroxyphénylalanine (L-DOPA), nécessaires à la synthèse de la dopamine. (2) La diminution de l’expression ou la fonction du transporteur vésiculaire des monoamines 2 (VMAT2). (3) l’augmentation de l’expression ou la fonction du transporteur de la dopamine (DAT). La dérégulation du transport et du stockage vésiculaire de la dopamine peut entraîner une accumulation cytosolique de dopamine, conduisant à une auto-oxydation et à la production de ROS et de quinones neurotoxiques. Enfin, l’activation de l’IDO par les cytokines dans les cellules immunitaires périphériques ou la microglie produit également de l’acide kynurénique à partir de la kynurénine via l’activité de la kynurénine aminotransférase II (KAT II) dans les astrocytes. L’acide kynurénique peut (4) réduire la neurotransmission du glutamate (Glu) par antagonisme des récepteurs et inhibition de la libération de Glu, entraînant ainsi une diminution de la libération de dopamine induite par le glutamate dans le striatum. Bien que non illustrée, une libération excessive de glutamate et d’acide quinolinique induite par les cytokines pourrait également contribuer à une augmentation du stress oxydatif et de l’excitotoxicité [24]. 3-HAO : acide 3-hydroxyanthranilique oxygénase ; AMPAR : récepteur de l’acide propanoïque 2-amino-3-(5-méthyl-3-oxo-1,2-oxazol-4-yl) ; BH4 : tétrahydrobioptérine ; D1 : récepteur de la dopamine 1 ; D2 : récepteur de la dopamine 2 ; DAT : transporteur de dopamine ; glu : glutamate ; DDC : dopamine décarboxylase ; IDO : indoleamine 2,3 dioxygénase ; KAT II : kynurénine aminotransférase II ; KMO : kynurénine 3-monooxygénase ; L-DOPA : L-3,4-dihydroxyphénylalanine ; NMDAR : récepteur de l’acide N-méthyl-D-aspartique ; HAP : phénylalanine hydroxylase ; ROS : espèces réactives de l’oxygène ; TH : tyrosine hydroxylase; VMAT2 : transporteur vésiculaires des monamines 2. |
Les cytokines perturbent également la neurotransmission du glutamate par des mécanismes impliquant la voie de la kynurénine [24]. L’activation par les cytokines de l’indoleamine 2,3-dioxygénase (IDO) convertit le tryptophane en kynurénine, qui est métabolisée en acide kynurénique et en acide quinolinique (Figure 2). L’acide kynurénique agit comme un antagoniste des récepteurs NMDA (N-méthyl-D-aspartate) et AMPA (acide α-amino-3-hydroxy-5-méthyl-4-isoxazole-propionique), réduisant la libération de glutamate et la signalisation en aval de la dopamine, tandis que l’acide quinolinique surexcite les récepteurs NMDA, induisant une excitotoxicité (transmission excessive du glutamate). Des niveaux excessifs de glutamate et d’acide quinolinique, liés à l’activation de la microglie, sont observés dans les troubles de l’humeur et les maladies neurodégénératives [24]. Les déficits de la recapture de glutamate par les astrocytes induits par les cytokines exacerbent les lésions neuronales, en particulier dans les régions sensibles à la dopamine.
L’inflammation chronique contribue, par le stress oxydatif et l’excitotoxicité, à une neurodégénérescence. Les modèles expérimentaux démontrent une perte significative de neurones dopaminergiques après exposition à des agents inflammatoires, tels que le lipopolysaccharide, induits par le TNF-α et les de réactifs oxydatifs. Ces processus soustendent probablement les symptômes de l’humeur et cognitifs associés à l’inflammation chronique et aux troubles neuropsychiatriques [24]. De plus, l’activation du système immunitaire maternel pendant la grossesse, déclenchée notamment par des infections virales, a été liée à un risque accru de schizophrénie et d’autisme dans la descendance, suggérant une perturbation durable du neurodéveloppement.
Les élévations des marqueurs inflammatoires tels que le TNF-α, l’IL-6 et la protéine C réactive sont associées à la schizophrénie, aux troubles bipolaires et à la dépression, notamment pendant certaines phases. Ces marqueurs, ainsi que la réduction du facteur neurotrophique dérivé du cerveau (BDNF, brain-derived neurotrophic factor), sont corrélés aux symptômes négatifs (affects émoussés, alogie) et à la gravité générale des symptômes. Des niveaux élevés d’IL-8 sont observés dans la schizophrénie, tandis que les troubles dépressifs montrent des niveaux stables d’IL-8 mais des niveaux élevés de TNF-α et d’IL-6. Dans les troubles du spectre de l’autisme, le dysfonctionnement microglial et l’élagage synaptique pourraient contribuer aux symptômes. Des réponses inflammatoires anormales impliquant la microglie et les cytokines sont liées au développement des troubles du spectre de l’autisme [27]. Des niveaux élevés de cytokines telles que l’IL-6, l’IL-1β et l’IL-7 chez les sujets atteints de troubles du spectre de l’autisme suggèrent une réponse inflammatoire persistante influençant la physiopathologie [27]. Malgré ces résultats, il faut encore clarifier la relation entre inflammation systémique et inflammation au niveau du système nerveux central, c’est-à-dire entre les taux périphériques de cytokines et leur activité au niveau cérébral, et comprendre les mécanismes spécifiques par lesquels des niveaux modifiés de cytokines contribuent à la pathogenèse de ces troubles.
Des agents anti-inflammatoires tels que la minocycline et la N-acétylcystéine ont montré un potentiel prometteur pour réduire les symptômes, notamment dans la schizophrénie et la dépression [28]. La minocycline pourrait être efficace contre les symptômes négatifs, tandis que la N-acétylcystéine, associée à des effets indésirables limités, maintient la production de glutathion, réduisant le stress oxydatif et la gravité des symptômes. D’autres approches thérapeutiques, telles que la neuromodulation, pourraient également ouvrir de nouvelles perspectives pour les sujets présentant des symptômes négatifs, comme la stimulation magnétique transcrânienne [29, 30] (→).
(→) Voir m/s n° 8-9, 2016, page 752
L’hypothèse inflammatoire, associée à la dysrégulation des neurotransmetteurs, constitue un cadre explicatif majeur pour ces troubles. Toutefois, une prise en charge efficace nécessite une approche intégrative combinant biomarqueurs, stratégies thérapeutiques anti-inflammatoires et interventions psychosociales adaptées. Alors que les stratégies diagnostiques et thérapeutiques basées sur les biomarqueurs et les anti-inflammatoires progressent, les interventions numériques offrent des solutions complémentaires, répondant à des besoins spécifiques des patients et s’inscrivant dans une perspective plus globale de prise en charge. Par exemple, les interventions psychosociales, telles que la formation aux compétences sociales et la thérapie cognitivo-comportementale, se révèlent efficaces dans la schizophrénie, mais elles nécessitent des professionnels de la santé bien formés, ce qui limite leur accessibilité. Les thérapeutiques numériques, telles que les programmes web, les applications mobiles et les dispositifs portables conçus pour prévenir, traiter ou gérer les conditions cliniques avec une intervention humaine limitée, représentent une alternative. Parmi ces approches, l’activation comportementale, couramment utilisée dans la dépression, peut améliorer les expériences positives grâce à une surveillance approfondie des activités. De même, la rééducation cognitive, qui cible les approches neurocognitives à travers le soutien à la résolution de problèmes, constitue une autre méthode prometteuse. Enfin, les thérapeutiques numériques pour les symptômes négatifs dans les troubles psychotiques ont également montré des bénéfices [31].
Les outils pour l’évaluation des symptômes négatifs en milieu clinique
Comme mentionné précédemment, les cinq symptômes négatifs peuvent être catégorisés en deux dimensions : la réduction de l’expression émotionnelle et l’apathie. Ces dimensions peuvent varier en fonction de facteurs externes qui influencent leur sévérité, nécessitant potentiellement des stratégies de traitement distinctes. L’identification clinique des symptômes négatifs représente un défi, car la conscience de la présence, de la gravité et de l’impact de ces symptômes est parfois incomplète. Cela demeure un enjeu crucial, car une symptomatologie négative sévère est associée à une mauvaise réponse au traitement et à des résultats fonctionnels médiocres. Certaines problématiques sont identifiées lors des évaluations cliniques, tandis que d’autres nécessitent des enquêtes et des discussions avec le patient, les membres de la famille et les soignants. Par conséquent, l’avis de l’entourage est essentiel pour une évaluation précise de la présence, de la sévérité et de l’impact des symptômes négatifs.
Les premières échelles d’évaluation, telles que la « positive and negative syndrome scale » (PANSS) [32], la « scale for the assessment of negative symptoms » (SANS) [33] ou la « negative symptom assessment-16 items » (NSA-16) [34], ont été essentielles dans la mesure des symptômes négatifs chez les patients souffrant de schizophrénie. Cependant, ces échelles évaluent généralement les symptômes négatifs à un moment donné et peuvent inclure des items qui ne sont plus considérés comme pertinents pour le domaine des symptômes négatifs (par exemple, des symptômes de désorganisation intellectuelle, tels que les difficultés d’abstraction de la pensée). De nouvelles échelles, telles que la « brief negative symptom scale » (BNSS) [35] et la « clinical assessment interview for negative symptoms » (CAINS) [36], ont été développées pour améliorer l’évaluation des symptômes négatifs en couvrant cinq domaines symptomatiques, interrogés au cours d’un entretien de 20 minutes. Cependant, ces échelles cliniques n’ont pas pour objectif de distinguer si les symptômes sont primaires ou secondaires à d’autres causes (psychiatriques, addictologiques, pharmacologiques, etc.), et leur utilisation peut être limitée par des contraintes de temps et par la disponibilité de professionnels de la santé formés. Les symptômes négatifs sont fréquents tout au long du parcours de la maladie, mais leur quantification est délicate. Les outils comme la BNSS améliorent le processus d’évaluation en offrant des entretiens semi-structurés pour évaluer la sévérité des symptômes. Cependant, il est parfois difficile, voire impossible, de distinguer les symptômes négatifs intrinsèques à la schizophrénie de ceux liés à une cause sous-jacente. Récemment, deux échelles spécifiquement destinées à l’auto-évaluation ont été mises au point : la « motivation and pleasure scale-self-report » (MAPSR), une version en auto-évaluation de 18 items de la sous-échelle « motivation and pleasure » de la CAINS [37], et la « self-assessment of negative symptoms » (SNS), un auto-questionnaire qui a montré une utilisation fiable et constante chez les patients atteints de schizophrénie [38].
La SNS a été développée pour répondre au besoin d’un outil fiable et facile à utiliser pour évaluer les symptômes négatifs dans les troubles psychiatriques, en particulier lors des premiers épisodes. Certaines études soulignent sa robustesse psychométrique et sa forte corrélation avec d’autres échelles d’évaluation des symptômes négatifs, telles que la SANS [3,38]. La SNS présente des avantages spécifiques tant pour l’évaluation clinique que pour la recherche, car elle combine de manière unique l’auto-évaluation avec la précision nécessaire à un profilage clinique précis des symptômes négatifs. Cela permet aux individus d’évaluer directement leurs propres symptômes, contournant ainsi les biais potentiels des évaluations cliniques, et améliore la sensibilité et la pertinence des résultats dans divers contextes diagnostiques. L’un des principaux avantages de la SNS est sa capacité à identifier efficacement les symptômes négatifs chez les adolescents et les jeunes adultes lors de leur premier épisode psychiatrique [3]. Contrairement à de nombreux outils d’évaluation traditionnels, qui peuvent sous-représenter les symptômes négatifs dans les cas précoces, la SNS peut identifier ces symptômes même lorsqu’ils sont prodromiques, c’est-à-dire avant même que le trouble ne puisse être caractérisé. Une étude prospective utilisant la SNS a exploré la présence de symptômes négatifs auto-déclarés chez les adolescents et les jeunes adultes vivant leur premier épisode psychiatrique [3]. L’étude a suggéré que les symptômes négatifs étaient présents non seulement chez les patients atteints de schizophrénie, mais aussi chez ceux vivant leur premier épisode de trouble dépressif, indiquant que ces symptômes pourraient concerner plusieurs troubles psychiatriques. La capacité de la SNS à identifier les symptômes négatifs au-delà des frontières diagnostiques souligne son utilité potentielle pour distinguer les personnes en premier épisode psychiatrique des témoins sains, là où les évaluations traditionnelles des symptômes positifs, comme le « prodromal questionnaire » (PQ16), peuvent être insuffisantes. L’observation de symptômes négatifs dans les populations cliniques et non cliniques favorise une conception dimensionnelle de ces manifestations, ce qui pourrait signaler des vulnérabilités potentielles au développement de troubles psychiatriques.
Du fait de sa validité démontrée à travers différents groupes d’individus et de son applicabilité tant aux populations cliniques que non cliniques, l’échelle d’auto-évaluation SNS des symptômes négatifs est utilisée dans la cohorte French Minds, dans le cadre du PEPR PROPSY. Cette intégration permettra d’étudier les données fournies par la SNS afin d’explorer les différences dans la prévalence des symptômes négatifs entre les sujets présentant des troubles psychiatriques et la population générale. Ce projet vise ainsi à affiner les catégories diagnostiques, à soutenir les stratégies préventives en santé mentale et à améliorer les efforts de détection précoce.
Les perspectives de recherche dans le cadre du PEPR PROPSY
Les recherches actuelles identifient diverses dimensions des symptômes négatifs, telles que l’expression diminuée et l’apathie, pouvant guider des traitements adaptés. Ces dimensions reflètent des processus physiopathologiques différents, nécessitant une approche transnosographique, c’est-à-dire une approche visant à comprendre les mécanismes sous-jacents communs à plusieurs troubles psychiatriques, indépendamment des diagnostics spécifiques. Des symptômes comme le retrait social sont prometteurs pour l’étude des maladies neurologiques, telles que la maladie d’Alzheimer [39]. Certains modèles théoriques relient ces symptômes à des fonctions neurocognitives, soulignant l’importance de tester des théories sur les processus affectant les symptômes négatifs à travers les diagnostics [40].
Bien que les cadres transnosographiques offrent des perspectives prometteuses, des défis persistent, en particulier concernant la rigueur méthodologique dans la définition et la validation des troubles à travers différents diagnostics. La distinction entre symptômes négatifs primaires et secondaires complique également les approches thérapeutiques, car ces catégories peuvent nécessiter des stratégies thérapeutiques différentes selon leur origine. Les symptômes négatifs primaires sont intrinsèques au trouble, tandis que les symptômes négatifs secondaires peuvent résulter de conditions comorbides ou de traitements, compliquant les évaluations cliniques et pouvant conduire à des erreurs diagnostiques ou à des stratégies de traitement inappropriées. La nature transversale de nombreuses recherches existantes soulève des questions sur la causalité, nécessitant des études longitudinales pour mieux comprendre la dynamique temporelle des symptômes négatifs et leurs implications transnosographiques.
Les modèles transnosographiques visent à identifier les changements psychologiques et neuronaux communs à travers les troubles en examinant des schémas similaires d’activation ou de connectivité neuronale. Dans l’étude prévue dans le cadre du projet PEPR PROPSY, les sujets subiront une évaluation multimodale incluant des évaluations numériques, cliniques, neuropsychologiques, biologiques (marqueurs génétiques et inflammatoires), un électroencéphalogramme et une imagerie par résonance magnétique. Les modèles précliniques pourraient améliorer la compréhension de la physiopathologie des symptômes négatifs dans les troubles psychiatriques en se concentrant sur des facteurs tels que l’anhédonie, l’amotivation et le retrait social [41–43]. Une étude récente a démontré la pertinence éthologique et translationnelle d’un paradigme d’évaluation du retrait social chez les rongeurs, en se concentrant sur un symptôme parmi les symptômes négatifs [44]. Le « facteur d’expressivité diminuée » et ses symptômes associés, notamment l’émoussement des affects, pourraient être plus difficiles à évaluer dans les modèles animaux [45].
Ces approches multimodales permettent une étude approfondie et intégrée des symptômes négatifs, non seulement dans un cadre clinique mais aussi à travers des modèles précliniques, fournissant des informations essentielles pour développer des interventions plus ciblées et spécifiques aux différents types de symptômes négatifs.
Conclusions : les applications actuelles et les perspectives de l’approche transdiagnostique des symptômes négatifs
Les symptômes négatifs dans les troubles psychiatriques posent d’importants défis pour des pathologies telles que le trouble bipolaire, les troubles du spectre de l’autisme, la schizophrénie et la dépression. Alors que les symptômes positifs, comme les hallucinations, répondent souvent aux traitements actuels, les symptômes négatifs tels que l’apathie, le retrait social et la perte de motivation demeurent difficiles à traiter et sont fréquemment négligés dans les études cliniques. L’absence de traitements ciblés et efficaces souligne le besoin urgent de recherches supplémentaires sur la neurobiologie de ces symptômes et le développement d’interventions capables de les traiter directement. En améliorant notre compréhension et nos options thérapeutiques pour les symptômes négatifs, les systèmes de santé pourront mieux soutenir les individus affectés, améliorant ainsi les résultats fonctionnels et la récupération à long terme.
Les preuves soulignent la nécessité d’une approche trans-nosographique pour mieux comprendre l’étiologie et le traitement des symptômes négatifs. Une telle approche pourrait faciliter l’identification des facteurs biologiques et environnementaux qui contribuent à ces symptômes à travers différents troubles. Comme les classifications catégorielles échouent souvent à capturer le continuum de la gravité des symptômes et leur nature interconnectée, les modèles dimensionnels de psychopathologie devraient être privilégiés. En adoptant des cadres transnosographiques et dimensionnels, les chercheurs et cliniciens peuvent développer des interventions ciblées qui traitent les mécanismes sous-jacents des symptômes négatifs, ce qui pourrait conduire à une meilleure efficacité des traitements et des résultats pour les patients.
De plus, le développement de stratégies de médecine de précision adaptées aux profils individuels des patients pourrait améliorer les approches thérapeutiques pour les symptômes négatifs. À mesure que la recherche progresse, il sera essentiel de favoriser la collaboration entre les études cliniques et précliniques afin d’élucider les bases neurobiologiques complexes des symptômes négatifs et d’identifier de nouvelles cibles thérapeutiques. L’exploration continue des mécanismes partagés et distincts des symptômes négatifs à travers les troubles psychiatriques, non seulement fera progresser notre compréhension, mais ouvrira également la voie à des interventions plus efficaces et spécifiques pour les symptômes.
Les approches pharmacologiques émergentes, notamment la modulation des récepteurs D3 de la dopamine [46] (→), des récepteurs NMDA et des mécanismes immunitaires, montrent des perspectives intéressantes, mais n’ont pas encore démontré d’efficacité robuste en milieu clinique. Les interventions psychosociales, telles que la thérapie cognitivo-comportementale et les programmes familiaux, offrent également des bénéfices modérés et peuvent être cruciaux dans les plans de traitement globaux lorsqu’elles sont intégrées avec des outils comme le SNS. En fin de compte, la recherche et les pratiques cliniques doivent se concentrer sur la combinaison de ces traitements pharmacologiques et psychosociaux avec des outils d’évaluation avancés pour traiter la nature complexe et impactante des symptômes négatifs. Une approche multidimensionnelle permettrait de mieux gérer les symptômes négatifs, d’optimiser les traitements et d’améliorer la vie quotidienne des patients atteints de troubles psychiatriques.
(→) Voir m/s n° 4, 2005, page 434
Remerciements
Ce travail a bénéficié d’une aide de l’État gérée par l’Agence nationale de la recherche au titre de France 2030 portant la référence ANR-22-EXPR-0013 (France 2030). Nous remercions la Pr. Marion Leboyer pour ses conseils lors de la rédaction de cet article.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
Emil Kraepelin (1856-1926) est un psychiatre allemand considéré comme le fondateur de la psychiatrie scientifique moderne. Eugen Bleuler (1857 – 1939), est un psychiatre suisse. Il est connu pour avoir inventé et introduit dans le vocabulaire psychiatrique les termes de schizophrénie, d’autisme et d’ambivalence (ndlr).
Références
- Marder SR, Galderisi S. The current conceptualization of negative symptoms in schizophrenia. World Psychiatry 2017 ; 16 : 14–24. [CrossRef] [PubMed] [Google Scholar]
- Guessoum SB, Le Strat Y, Dubertret C, et al. A transnosographic approach of negative symptoms pathophysiology in schizophrenia and depressive disorders. Prog Neuropsychopharmacol Biol Psychiatry 2020 ; 99 : 109862. [CrossRef] [PubMed] [Google Scholar]
- Mallet J, Guessoum SB, Tebeka S, et al. Self-evaluation of negative symptoms in adolescent and young adult first psychiatric episodes. Prog Neuropsychopharmacol Biol Psychiatry 2020 ; 103 : 109988. [CrossRef] [PubMed] [Google Scholar]
- Schmidt A, Cappucciati M, Radua J, et al. Improving prognostic accuracy in subjects at clinical high risk for psychosis: systematic review of predictive models and meta-analytical sequential testing simulation. Schizophr Bull 2017 ; 43 : 375–88. [PubMed] [Google Scholar]
- Bi R, Dong W, Zheng Z, et al. Altered motivation of effortful decision-making for self and others in subthreshold depression. Depress Anxiety 2022 ; 39 : 633–45. [CrossRef] [PubMed] [Google Scholar]
- McMakin DL, Olino TM, Porta G, et al. Anhedonia predicts poorer recovery among youth with selective serotonin reuptake inhibitor treatment-resistant depression. J Am Acad Child Adolesc Psychiatry 2012 ; 51 : 404–11. [CrossRef] [PubMed] [Google Scholar]
- Strauss GP, Cohen AS. A transdiagnostic review of negative symptom phenomenology and etiology. Schizophr Bull 2017 ; 43 : 712–9. [CrossRef] [PubMed] [Google Scholar]
- Fusar-Poli P, Tantardini M, De Simone S, et al. Deconstructing vulnerability for psychosis: meta-analysis of environmental risk factors for psychosis in subjects at ultra high-risk. Eur Psychiatry 2017 ; 40 : 65–75. [CrossRef] [PubMed] [Google Scholar]
- Winograd-Gurvich C, Fitzgerald PB, Georgiou-Karistianis N, et al. Negative symptoms: a review of schizophrenia, melancholic depression and Parkinson’s disease. Brain Res Bull 2006 ; 70 : 312–21. [CrossRef] [PubMed] [Google Scholar]
- Pignon B, Peyre H, Ayrolles A, et al. Genetic and psychosocial stressors have independent effects on the level of subclinical psychosis: findings from the multinational EU-GEI study. Epidemiol Psychiatr Sci 2022 ; 31 : e68. [CrossRef] [PubMed] [Google Scholar]
- Van Os J, Reininghaus U. Psychosis as a transdiagnostic and extended phenotype in the general population. World Psychiatry 2016 ; 15 : 118–24. [CrossRef] [PubMed] [Google Scholar]
- Foss-Feig JH, McPartland JC, Anticevic A, Wolf J. Re-conceptualizing ASD within a dimensional framework: positive, negative, and cognitive feature clusters. J Autism Dev Disord 2026 ; 46 : 342–51. [Google Scholar]
- Fusar-Poli, P. et al. Treatments of negative symptoms in schizophrenia: meta-analysis of 168 randomized placebo-controlled trials. Schizophr Bull 2015 ; 41, 892–99. [CrossRef] [PubMed] [Google Scholar]
- Strauss GP, Horan WP, Kirkpatrick B, et al. Deconstructing negative symptoms of schizophrenia: Avolition-apathy and diminished expression clusters predict clinical presentation and functional outcome. J Psychiatr Res 2013 ; 47 : 783–90. [CrossRef] [PubMed] [Google Scholar]
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders. Washington : APA, 2013. doi : 10.1176/appi.books.9780890425596. [Google Scholar]
- Fitzgerald HM, Shepherd J, Bailey H, et al. Treatment goals in schizophrenia: a real-world survey ofpatients, psychiatrists, and Caregivers in the United States, with an analysis of current treatment (long-acting injectable vs oral antipsychotics) and goal selection. Neuropsychiatr Dis Treat 2021 ; 17 : 3215–28. [CrossRef] [Google Scholar]
- Dollfus, S. Le déficit motivationnel dans la schizophrénie. Bull Acad Natl Med 2018 ; 202 : 115–26. [Google Scholar]
- Vinckier F, Gourion D, Mouchabac S. Anhedonia predicts poor psychosocial functioning: Results from a large cohort of patients treated for major depressive disorder by general practitioners. Eur Psychiatry 2017 ; 44 : 1–8. [CrossRef] [PubMed] [Google Scholar]
- Ihler HM, Lyngstad SH, Morch-Johnsen LE, et al. A transdiagnostic approach to negative symptoms: exploring factor structure and negative symptoms in bipolar disorders. Front Psychiatry 2023 ; 14 : 1136097. [CrossRef] [PubMed] [Google Scholar]
- Quattrone D, Di Forti M, Gayer-Anderson C, et al. Transdiagnostic dimensions of psychopathology at first episode psychosis: findings from the multinational EU-GEI study. Psychol Med 2019 ; 49 ; 1378–91. [CrossRef] [PubMed] [Google Scholar]
- Lindenmayer JP, Bossie CA, Kujawa M, et al. Dimensions of psychosis in patients with bipolar mania as measured by the positive and negative syndrome scale. Psychopathology 2008 ; 41 : 264–70. [CrossRef] [PubMed] [Google Scholar]
- Trevisan DA, Foss-Feig JH, Naples AJ, et al. Autism spectrum disorder and schizophrenia are better differentiated by positive symptoms than negative symptoms. Front. Psychiatry 2020 ; 11 : 548. [CrossRef] [Google Scholar]
- Kirschner M, Aleman A, Kaiser S. Secondary negative symptoms: a review of mechanisms, assessment and treatment. Schizophr Res 2017 ; 186 : 29–38. [CrossRef] [PubMed] [Google Scholar]
- Felger JC, Miller AH. Cytokine effects on the basal ganglia and dopamine function: the subcortical source of inflammatory malaise. Front Neuroendocrinol 2012 ; 33 ; 315–27. [CrossRef] [PubMed] [Google Scholar]
- Cunnington C, Channon KM. Tetrahydrobiopterin: pleiotropic roles in cardiovascular pathophysiology. Heart Br Card Soc 2010 ; 96 ; 1872–7. [CrossRef] [PubMed] [Google Scholar]
- Capuron L, Schroecksnadel S, Féart C, et al. Chronic low-grade inflammation in elderly persons is associated with altered tryptophan and tyrosine metabolism: role in neuropsychiatric symptoms. Biol Psychiatry 2011 ; 70 ; 175–82. [CrossRef] [PubMed] [Google Scholar]
- Zhao H, Zhang H, Liu S, et al. Association of peripheral blood levels of cytokines with autism spectrum disorder: a meta-analysis. Front Psychiatry 2021 ; 12 ; 670200. [CrossRef] [PubMed] [Google Scholar]
- Fond G, Mallet J, Urbach M, et al. Adjunctive agents to antipsychotics in schizophrenia: a systematic umbrella review and recommendations for amino acids, hormonal therapies and anti-inflammatory drugs. BMJ Ment Health 2023 ; 26 ; e300771. [CrossRef] [Google Scholar]
- Lorentzen R, Nguyen TD, McGirr A, et al. The efficacy of transcranial magnetic stimulation (TMS) for negative symptoms in schizophrenia: a systematic review and meta-analysis. Schizophr Heidelb Ger 2022 ; 8 : 35. [CrossRef] [Google Scholar]
- Heeren A, Coussement C, Colon E. La stimulation transcrânienne à courant continu en psychiatrie : vers de nouvelles perspectives d’interventions. Med Sci (Paris) 2016 ; 32 : 752–7. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Fulford D, Marsch LA, Pratap A. Prescription digital therapeutics: an emerging treatment option for negative symptoms in schizophrenia. Biol Psychiatry 2024 ; 96 ; 659–65. [CrossRef] [PubMed] [Google Scholar]
- Kay SR, Fiszbein A, Opler LA. The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull 1987 ; 13 : 261–76. [CrossRef] [PubMed] [Google Scholar]
- Andreasen NC. The scale for the assessment of negative symptoms (SANS): conceptual and theoretical foundations. Br J Psychiatry 1989 ; 155 : 49–52. [CrossRef] [Google Scholar]
- Axelrod BN, Goldman RS, Alphs LD. Validation of the 16-item negative symptom assessment. J Psychiatr Res 1993 ; 27 : 253–8. [CrossRef] [PubMed] [Google Scholar]
- Kirkpatrick B, Strauss GP, Nguyen N, et al. The brief negative symptom scale: psychometric properties. Schizophr Bull 2011 ; 37 : 300–5. [CrossRef] [PubMed] [Google Scholar]
- Kring AM, Gur RE, Blanchard JJ, et al. The clinical assessment interview for negative symptoms (CAINS): final development and validation. Am J Psychiatry 2013 ; 170 : 165–72. [CrossRef] [PubMed] [Google Scholar]
- Llerena K, Park SG, McCarthy JM, et al. The motivation and pleasure scale-self-report (MAP-SR): reliability and validity of a self-report measure of negative symptoms. Compr Psychiatry 2013 ; 54 ; 568–74. [CrossRef] [PubMed] [Google Scholar]
- Mach C, Dollfus S. Symptômes négatifs de la schizophrénie : une revue des instruments d’évaluation. L’Encéphale 2016 ; 42 ; 165–71. [Google Scholar]
- Ike KGO, de Boer SF, Buwalda, B, et al. Social withdrawal: an initially adaptive behavior that becomes maladaptive when expressed excessively. Neurosci Biobehav Rev 2020 ; 116 : 251–67. [CrossRef] [PubMed] [Google Scholar]
- Ebrahimi A, Poursharifi H, Dolatshahi B, et al. The cognitive model of negative symptoms in schizophrenia: a hierarchical component model with PLS-SEM. Front Psychiatry 2021 ; 12 : 707291. [CrossRef] [PubMed] [Google Scholar]
- Nikiforuk A, Hołuj M, Kos T, et al. The effects of a 5-HT5A receptor antagonist in a ketamine-based rat model of cognitive dysfunction and the negative symptoms of schizophrenia. Neuropharmacology 2016 ; 105 : 351–60. [CrossRef] [PubMed] [Google Scholar]
- Lutsenko RV, Sydorenko AH, Bobyriov VM. Anhedonia at experimental models of chronic stress and its correction. Wiadomosci Lek Wars Pol 2017 ; 196070 : 745–50. [Google Scholar]
- Slaney CL, Hales CA, Robinson ESJ. Rat models of reward deficits in psychiatric disorders. Curr Opin Behav Sci 2018 ; 22 ; 136–42. [CrossRef] [PubMed] [Google Scholar]
- Bove M, Ike K, Eldering A, et al. The visible burrow system: a behavioral paradigm to assess sociability and social withdrawal in BTBR and C57BL/6J mice strains. Behav Brain Res 2018 ; 344 ; 9–19. [CrossRef] [PubMed] [Google Scholar]
- Sahin C, Doostdar N, Neill JC. Towards the development of improved tests for negative symptoms of schizophrenia in a validated animal model. Behav Brain Res 2016 ; 312 ; 93–101. [CrossRef] [PubMed] [Google Scholar]
- Millan M.J. Le récepteur dopaminergique D3 : nouvelle cible pour un traitement amélioré de la schizophrénie. Med Sci (Paris) 2005 ; 21 : 434–42. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1 Les symptômes négatifs sont classés dans deux dimensions (en rouge) : le déficit émotionnel et l’hypo-expressivité. Les sections du DSM-5 incluent des termes reflétant l’un des cinq domaines consensuels des symptômes négatifs définis par le NIMH, dans leurs critères diagnostiques ou caractéristiques associées à la schizophrénie, les troubles bipolaires, le trouble dépressif récurrent, et le trouble du spectre de l’autisme. |
| Dans le texte | |
 |
Figure 2 Mécanismes potentiels des effets des cytokines inflammatoires sur la synthèse et la libération de dopamine dans les ganglions de la base. Les preuves indiquent que les cytokines inflammatoires provenant de la périphérie, ou celles produites localement par la microglie activée ou les macrophages infiltrants, peuvent produire du monoxyde d’azote ainsi que de l’acide quinolinique via la voie de l’indoleamine 2,3-dioxygénase (IDO) et les voies de la kynurénine, contribuant toutes au stress oxydatif et à la génération d’espèces réactives de l’oxygène (ROS). L’augmentation des ROS et du monoxyde d’azote induite par l’inflammation contribue à (1) L’oxydation de la tétrahydrobioptérine (BH4), un cofacteur essentiel à la conversion de la phénylalanine en tyrosine et de la tyrosine en L-3,4-dihydroxyphénylalanine (L-DOPA), nécessaires à la synthèse de la dopamine. (2) La diminution de l’expression ou la fonction du transporteur vésiculaire des monoamines 2 (VMAT2). (3) l’augmentation de l’expression ou la fonction du transporteur de la dopamine (DAT). La dérégulation du transport et du stockage vésiculaire de la dopamine peut entraîner une accumulation cytosolique de dopamine, conduisant à une auto-oxydation et à la production de ROS et de quinones neurotoxiques. Enfin, l’activation de l’IDO par les cytokines dans les cellules immunitaires périphériques ou la microglie produit également de l’acide kynurénique à partir de la kynurénine via l’activité de la kynurénine aminotransférase II (KAT II) dans les astrocytes. L’acide kynurénique peut (4) réduire la neurotransmission du glutamate (Glu) par antagonisme des récepteurs et inhibition de la libération de Glu, entraînant ainsi une diminution de la libération de dopamine induite par le glutamate dans le striatum. Bien que non illustrée, une libération excessive de glutamate et d’acide quinolinique induite par les cytokines pourrait également contribuer à une augmentation du stress oxydatif et de l’excitotoxicité [24]. 3-HAO : acide 3-hydroxyanthranilique oxygénase ; AMPAR : récepteur de l’acide propanoïque 2-amino-3-(5-méthyl-3-oxo-1,2-oxazol-4-yl) ; BH4 : tétrahydrobioptérine ; D1 : récepteur de la dopamine 1 ; D2 : récepteur de la dopamine 2 ; DAT : transporteur de dopamine ; glu : glutamate ; DDC : dopamine décarboxylase ; IDO : indoleamine 2,3 dioxygénase ; KAT II : kynurénine aminotransférase II ; KMO : kynurénine 3-monooxygénase ; L-DOPA : L-3,4-dihydroxyphénylalanine ; NMDAR : récepteur de l’acide N-méthyl-D-aspartique ; HAP : phénylalanine hydroxylase ; ROS : espèces réactives de l’oxygène ; TH : tyrosine hydroxylase; VMAT2 : transporteur vésiculaires des monamines 2. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




