| Issue |
Med Sci (Paris)
Volume 41, Number 3, Mars 2025
|
|
|---|---|---|
| Page(s) | 235 - 238 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2025033 | |
| Published online | 21 March 2025 | |
Une contribution de l’optogénétique à l’étude biophysique de la pyroptose induite par l’inflammasome
Optogenetics contributes to the study of biophysical phenomena during inflammasome-induced pyroptosis
Centre de recherche en cancérologie de Lyon, Inserm U1052, CNRS UMR5286, Université Claude Bernard Lyon 1, Centre Léon Bérard, Lyon, France
La pyroptose : une mort cellulaire programmée inflammatoire physiologique
Historiquement, la pyroptose a été décrite comme une mort cellulaire lytique inflammatoire provoquée par l’activation de la caspase 1 [1]. L’activité de cette caspase est contrôlée par un complexe multiprotéique cytosolique appelé inflammasome, un acteur clé de l’immunité innée. Plusieurs étapes sont nécessaires à la formation de la plateforme de l’inflammasome. D’abord, un récepteur de l’immunité innée (pattern recognition receptor, PRR) tel que NLRP3 (NOD-like receptor family, pyrin domain containing 3) détecte des motifs moléculaires associés à des microorganismes pathogènes ou des signaux de dangers, PAMP ou DAMP (pathogens/damage-associated molecular pattern) respectivement. Puis, NLRP3 s’oligomérise et recrute l’adaptateur ASC (apoptosis-associated speck-like protein containing a CARD) via son domaine pyrine (pyrin domain, PYD), formant une structure filamenteuse ou « speck ». Le domaine CARD de ASC permet alors le recrutement de la caspase 1 et son activation au sein du complexe [2] (→).
(→) Voir m/s n° 11, 2013, page 975
L’activation de la caspase-1 conduit à la pyroptose par le clivage de la gasdermine D, et à la maturation des cytokines proinflammatoires pro-IL-1β et pro-IL-18 en cytokines actives. En effet, la partie N-terminale de la gasdermine libérée s’oligomérise et forme des pores dans la membrane plasmique, ce qui permet la sécrétion des cytokines IL-1β et IL-18 (interleukines 1β et 18). Ces pores induisent, par un mécanisme mal compris, l’activation de la protéine membranaire ninjurine-1, ce qui entraîne la formation de larges ouvertures dans la membrane plasmique pour induire une lyse cellulaire [2–4] (→) (Figure 1).
(→) Voir m/s n° 1, 2018, page 47
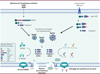 |
Figure 1 Activation de la cascade de l’inflammasome via des PAMP ou DAMP, ou par optogénétique dans des cellules produisant la protéine chimérique opto-ASC. ASC : apoptosis-associated speck-like protein containing a CARD ; DAMP : danger-associated molecular pattern ; PAMP : pathogen-associated molecular pattern ; GSDMD : gasdermine-D ; LDH : lactacte déshydrogénase ; NINJ1 : ninjurine-1 ; IL : interleukine ; PYD : pyrin domain ; NACHT : domaine commun à NAIP, C2TA, HET-E, et TP1 ; LRR : leucine-rich repeats ; CARD : caspase recruitment domain ; CRY : cryptochrome ; RFP : red fluorescent protein (figure réalisée avec BioRender). |
En détectant les agents pathogènes et en déclenchant des réponses inflammatoires rapides, l’inflammasome aide à contenir et éliminer les agents infectieux. Cette réponse contribue au retour à l’homéostasie. Cependant, un dysfonctionnement de l’inflammasome peut conduire à des maladies auto-inflammatoires, comme les cryopyrinopathies, ou à des maladies inflammatoires chroniques, comme l’athérosclérose [2, 3].
Un outil optogénétique pour activer l’inflammasome
La pyroptose a d’abord été décrite dans les cellules myéloïdes de souris après activation par un microorganisme pathogène [1]. Elle se caractérise par le gonflement cellulaire, la lyse membranaire et la libération de cytokines et de contenus intracellulaires agissant en tant que DAMP. Les étapes des changements morphologiques et les forces mécaniques à l’œuvre sont encore mal comprises. Afin de s’affranchir du signal de danger ou de l’agent pathogène, qui active de multiples voies de signalisation outre l’inflammasome, et de pouvoir activer ce complexe protéique à l’échelle de la cellule unique, nous avons utilisé une approche optogé né tique [5] (Figure 1).
L’optogénétique est fondée sur l’ajout de domaines de proté ines photosensibles à des proté ines d’intérêt par génie génétique, pour confé rer à ces protéines une proprié té spé cifique, comme par exemple la dimérisation en réponse à un signal lumineux. Cette approche expérimentale permet le contrô le spatiotemporel rapide (en quelques secondes) et réversible de l’activité de proté ines d’inté rê t. Pour notre étude, le domaine photosensible de la protéine cryptochrome 2 de Arabidopsis thaliana a é té fusionné à la proté ine ASC de l’inflammasome. La protéine chimérique contient également une étiquette RFP (red fluorescent protein) pour pouvoir la tracer dans les cellules. Nous avons nommé « opto-ASC » ce nouvel outil optogénétique. Lors d’une exposition à la lumiè re bleue (longueur d’onde 488 nm), le domaine photosensible se dimé rise rapidement, ce qui entraîne l’oligomé risation de ASC, et en conséquence, le recrutement et l’activation de la caspase-1 (Figure 1). La construction codant la protéine chimérique a été exprimée dans des macrophages immortalisés de souris (immortalized bone marrow-derived macrophages, iBMDM), puis les cellules produisant cette protéine ont été exposées à la lumière bleue. Nous avons montré que ces cellules forment alors des specks de ASC, gonflent, perdent l’intégrité membranaire, et meurent en moins d’une heure [5].
Pour vérifier que cette méthode expérimentale reproduit bien l’activation de l’inflammasome, les protéines effectrices de la pyroptose ont été analysées. Nous avons pu détecter le clivage de la caspase-1 et de la gasdermine D par immunoblot. La libération de IL-1β a été validée par immunoblot et par la technique immuno-enzymatique ELISA (enzyme-linked immunosorbent assay). La sécrétion de lactate déshydrogénase a également été mesurée dans les surnageants des cellules pyroptotiques. De plus, cette activation est bien spécifique de la voie de l’inflammasome puisqu’elle est inhibée par VX-765, un inhibiteur spécifique de la caspase-1.
La méthode par exclusion de fluorescence pour décrypter les étapes de gonflement et de rupture de la membrane plasmique caractéristiques de la pyroptose
La pyroptose est caractérisée par un gonflement cellulaire et une rupture de la membrane plasmique. En biologie, mesurer avec précision un volume cellulaire reste un défi. Cependant, une approche biophysique a été développée au cours des dernières années : la méthode FXm (fluorescence exclusion measurement), qui combine des approches de microscopie par épifluorescence et de microfluidique [6] (Figure 2). Les cellules d’intérêt sont ensemencées dans une chambre en polydiméthylsiloxane, un polymère de la classe des silicones, dont la hauteur est finement contrôlée, tandis que le milieu de culture comprend des dextranes de différentes tailles couplés à différents fluorochromes. Ces dextranes sont incapables de franchir passivement la membrane plasmique, et les cellules apparaissent sombres au microscope puisqu’elles ne sont pas fluorescentes. Il est alors possible, à partir de l’intensité de fluorescence dans la chambre et de la hauteur de la chambre, de déduire le volume cellulaire, et de suivre ainsi sa variation au cours du temps [6]. Afin de suivre les étapes menant à la rupture membranaire, nous avons utilisé deux dextranes de masses différentes : 10 kDa pour le dextrane de petite taille (small dextran, SD) et 500 kDa pour le dextrane de grande taille (large dextrane, LD). La petite taille du dextrane SD lui permet de passer au travers des pores de gasdermine D (environ 21 nm de diamètre), tandis que le dextrane LD ne peut pénétrer dans la cellule que lorsque la membrane plasmique est rompue. En couplant la méthode FXm avec l’induction de la pyroptose par l’outil opto-ASC, nous avons découvert que le gonflement cellulaire au cours de la pyroptose se déroule en deux phases successives, séparées par un « plateau » où le volume cellulaire se stabilise transitoirement. Nous suggérons que la première phase de gonflement correspond à la formation des pores de gasdermine D. Puis la cellule continue de gonfler jusqu’à la pénétration du dextrane LD, qui correspond à la rupture de la membrane plasmique, et nous avons montré que cette rupture intervient alors que le volume de la cellule a seulement doublé.
 |
Figure 2 L’opto-ASC couplé à la méthode FXm pour mesurer le volume cellulaire au cours du temps. Le haut de la figure schématise la chambre de poly-diméthyl-siloxane (PDMS) dans laquelle sont cultivées les cellules exprimant opto-ASC. Pour l’illustration, une seule cellule est représentée (en gris). La cellule à l’état basal est imperméable aux dextranes (gris foncé), et la fluorescence est émise par le milieu extracellulaire (1/4). La cellule gonfle, mais n’est pas encore perméable aux dextranes (2/4). Les pores de gasdermine D (GSDMD) se forment à la membrane plasmique, ce qui permet l’entrée des dextranes de petite taille (SD) (3/4). Après la rupture membranaire, les dextranes de grande taille (LD) pénètrent dans la cellule (4/4). La cellule n’exclut plus la fluorescence (gris clair). T0 : étape initiale avant stimulation ; T1 : étape 1 après stimulation par la lumière bleue (longueur d’onde 488 nm), montrant le gonflement provoqué par la stimulation ; T2 : étape 2 après la stimulation par la lumière bleue ; T3 : étape 3 après la stimulation par la lumière bleue (figure réalisée avec BioRender). |
On a longtemps supposé que la membrane se rompait passivement sous l’effet des forces mécaniques résultant du gonflement cellulaire. C’est pourquoi nous avons, en parallèle, induit des chocs hypotoniques en ajoutant de l’eau (H2O) dans le milieu extracellulaire sans activer opto-ASC. Étonnamment, les cellules ont alors été capables de subir une augmentation de leur volume bien au-delà du doublement avant de retrouver leur volume initial, ce qui suggère d’une part, qu’elles disposent d’une réserve de membrane suffisante pour tripler leur volume sans que la membrane se rompe, et d’autre part, que la rupture membranaire au cours de la pyroptose implique un mécanisme actif [5]. Cette conclusion est en accord avec les résultats de travaux de recherche précédents, notamment ceux de Kayagaki et al. qui ont montré que la ninjurine 1 est l’effecteur de la rupture de la membrane plasmique [4] (Figure 2).
D’autres études se sont appuyées sur des outils optogénétiques afin de décrypter le mécanisme d’action des molécules effectrices de la pyroptose. Santa Cruz et al. ont développé l’outil PhoDer, fondé sur les propriétés de photoclivage de la protéine PhoCl du corail vert Clavularia spp., afin d’activer spécifiquement par la lumière le clivage activateur de la gasdermine D. En couplant cette approche optogénétique à des techniques d’imagerie et d’électrophysiologie, ils ont montré que les oligomères de la région N-terminale de la gasdermine D forment spontanément des pores en s’insérant dans la membrane, et que le phosphatidylinositol-4,5-bisphosphate (PIP2) est nécessaire au contrôle de leur dynamique d’ouverture/fermeture. À son tour, cette dynamique semble exercer un contrôle spatio-temporel sur le relargage de cytokines pro-inflammatoires [7]. Ces observations battent en brèche l’hypothèse, répandue jusqu’ici, selon laquelle les pores de gasdermine D sont constamment ouverts.
Shkarina et al., quant à eux, ont développé des outils optogénétiques, baptisés opto-CDE (opto-cell death effectors), permettant d’induire différentes morts cellulaires programmées : pyroptose, apoptose, ou nécroptose. Pour ce faire, ils ont fusionné différentes caspases ou autres effecteurs de mort cellulaire comme RIPK3 (receptor-interacting serine/threonine-protein kinase 3) et MLKL (mixed lineage kinase domain-like pseudokinase) avec le domaine photosensible de la protéine cryptochrome 2 afin d’induire l’oligomérisation et l’activation de ces effecteurs de la mort cellulaire par la lumière bleue [8, 9].
Perspectives
Les résultats que nous avons obtenus avec ce nouvel outil optogénétique d’étude de l’inflammasome ouvrent la voie à l’exploration des mécanismes moléculaires spécifiques de chaque phase de gonflement cellulaire au cours de la pyroptose. Ces découvertes pourraient guider le développement de nouvelles approches thérapeutiques pour agir sur cette forme particulière de mort cellulaire programmée et traiter les maladies inflammatoires.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Fink SL, Cookson BT. Caspase-1-dependent pore formation during pyroptosis leads to osmotic lysis of infected host macrophages. Cell Microbiol 2006 ; 8 : 1812–25. [Google Scholar]
- Jamilloux Y, Henry T. Les inflammasomes, plates-formes de l’immunité innée. Med Sci (Paris) 2013 ; 29 : 975–84. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Groslambert M, Py BF. NLRP3, un inflammasome sous contrôle. Med Sci (Paris) 2018 ; 34 : 47–53. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Kayagaki N, Kornfeld OS, Lee BL, et al. NINJ1 mediates plasma membrane rupture during lytic cell death. Nature 2021 ; 591 : 131–6. [CrossRef] [PubMed] [Google Scholar]
- Nadjar J, Monnier S, Bastien E, et al. Optogenetically controlled inflammasome activation demonstrates two phases of cell swelling during pyroptosis. Sci Signal 2024 ; 17 : eabn8003. [Google Scholar]
- Zlotek-Zlotkiewicz E, Monnier S, Cappello G, et al. Optical volume and mass measurements show that mammalian cells swell during mitosis. J Cell Biol 2015 ; 211 : 765–74. [Google Scholar]
- Santa Cruz Garcia AB, Schnur KP, Malik AB, et al. Gasdermin D pores are dynamically regulated by local phosphoinositide circuitry. Nat Commun 2022 ; 13 : 52. [PubMed] [Google Scholar]
- Shkarina K, Hasel de Carvalho E, Santos JC, et al. Optogenetic activators of apoptosis, necroptosis, and pyroptosis. J Cell Biol 2022 ; 221 : e202109038. [Google Scholar]
- Hasel de Carvalho E, Dharmadhikari SS, Shkarina K, et al. The opto-inflammasome in zebrafish as a tool to study cell and tissue responses to speck formation and cell death. eLife 2023 ; 12 : e86373. [Google Scholar]
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1 Activation de la cascade de l’inflammasome via des PAMP ou DAMP, ou par optogénétique dans des cellules produisant la protéine chimérique opto-ASC. ASC : apoptosis-associated speck-like protein containing a CARD ; DAMP : danger-associated molecular pattern ; PAMP : pathogen-associated molecular pattern ; GSDMD : gasdermine-D ; LDH : lactacte déshydrogénase ; NINJ1 : ninjurine-1 ; IL : interleukine ; PYD : pyrin domain ; NACHT : domaine commun à NAIP, C2TA, HET-E, et TP1 ; LRR : leucine-rich repeats ; CARD : caspase recruitment domain ; CRY : cryptochrome ; RFP : red fluorescent protein (figure réalisée avec BioRender). |
| Dans le texte | |
 |
Figure 2 L’opto-ASC couplé à la méthode FXm pour mesurer le volume cellulaire au cours du temps. Le haut de la figure schématise la chambre de poly-diméthyl-siloxane (PDMS) dans laquelle sont cultivées les cellules exprimant opto-ASC. Pour l’illustration, une seule cellule est représentée (en gris). La cellule à l’état basal est imperméable aux dextranes (gris foncé), et la fluorescence est émise par le milieu extracellulaire (1/4). La cellule gonfle, mais n’est pas encore perméable aux dextranes (2/4). Les pores de gasdermine D (GSDMD) se forment à la membrane plasmique, ce qui permet l’entrée des dextranes de petite taille (SD) (3/4). Après la rupture membranaire, les dextranes de grande taille (LD) pénètrent dans la cellule (4/4). La cellule n’exclut plus la fluorescence (gris clair). T0 : étape initiale avant stimulation ; T1 : étape 1 après stimulation par la lumière bleue (longueur d’onde 488 nm), montrant le gonflement provoqué par la stimulation ; T2 : étape 2 après la stimulation par la lumière bleue ; T3 : étape 3 après la stimulation par la lumière bleue (figure réalisée avec BioRender). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




