| Issue |
Med Sci (Paris)
Volume 41, Number 1, Janvier 2025
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 93 - 96 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2024200 | |
| Published online | 31 January 2025 | |
La neurostimulation auriculaire transcutanée
Une alternative prometteuse pour le sevrage des opioïdes chez le nouveau-né
Transcutaneous auricular neurostimulation: a promising alternative for opioid withdrawal in neonates
1
Master 1 Humanités médicales, FSMPM, Aix Marseille Université, Marseille, France
a
souheila.ammari@outlook.fr
b
ronald.mendoza@etu.univ-amu.fr
c
papias.eurydice@hotmail.fr
d
lucie.romero@etu.univ-amu.fr
e
alexia.telesco@etu.univ-amu.fr
f
theo.vassiliou@etu.univ-amu.fr
La crise des opioïdes aux États-Unis
Les opioïdes sont des substances psychotropes naturelles, semi-synthétiques ou synthétiques agissant sur les récepteurs des opiacés dans le système nerveux. Leurs effets sont principalement antalgiques et narcotiques, mais ils sont également euphorisants et sont donc très addictifs. Aux États-Unis, il existe une « crise des opioïdes » qui correspond à l’augmentation de la consommation de ces substances depuis la fin des années 1990. Cette crise sanitaire majeure est issue de la promotion agressive de médicaments antalgiques très addictifs (oxycodone), puis elle s’est développée avec la consommation d’héroïne et plus récemment avec les opioïdes synthétiques (fentanyl et dérivés). L’addiction aux opioïdes touche l’ensemble de la population. Elle se complexifie à cause du phénomène de polyconsommation de substances addictives chez certains individus. Cette crise est aussi influencée par de nombreux facteurs socio-économiques et culturels : les individus les plus pauvres sont les plus touchés par l’addiction aux opioïdes. Depuis une dizaine d’années, de nombreux cas d’addiction aux opioïdes chez les femmes enceintes sont recensés [1, 2]. Les nouveau-nés présentent alors un syndrome d’abstinence néonatale dû au passage transplacentaire des opioïdes consommés par la mère pendant la grossesse, et au sevrage brutal provoqué par la naissance. L’administration transitoire d’opioïdes à ces nouveau-nés est proposée pour traiter ce syndrome d’abstinence, mais des effets indésirables à court terme et à long terme ont été rapportés [1, 2]. C’est avec l’objectif de développer des thérapies alternatives non médicamenteuses et non invasives que Jenkins et collaborateurs proposent un protocole expérimental utilisant la neurostimulation auriculaire transcutanée [3].
Le syndrome d’abstinence néonatal
Un large éventail de symptômes
Les opioïdes sont des molécules légères, solubles, lipophiles, avec une demi-vie plus ou moins longue selon les types d’opioïdes (action brève, libération prolongée, ou action longue). Ces caractéristiques chimiques permettent aux opioïdes présents dans le sang maternel de traverser la barrière placentaire. Les risques pour le fœtus sont nombreux : malformations congénitales, décollement placentaire, avortement spontané, ou encore décès du fœtus in utero [4]. La naissance interrompt le passage transplacentaire des opioïdes et provoque un syndrome d’abstinence néonatale, dont les symptômes sont comparables à ceux observés chez un consommateur adulte [5].
Généralement, le nouveau-né présente des signes de sevrage dès 24 à 72 heures après l’accouchement [6]. Le syndrome d’abstinence néonatale se manifeste principalement par des signes neurologiques (succions à répétition, trémulation, insomnie, irritabilité, hyperexcitabilité), cardiovasculaires (tachycardie, hypertension artérielle), et digestifs (vomissement, diarrhée, régurgitation) [5, 6].
Diagnostic et surveillance
La diversité des symptômes nécessite des outils diagnostiques précis afin de distinguer ce syndrome de sevrage d’autres maladies. Il existe plusieurs échelles de mesure, permettant de déterminer les scores de Ostrea, de Lipsitz, ou de Finnegan. Ce dernier est le score de référence pour évaluer le degré de sévérité du syndrome de sevrage [5]. Il est fondé sur l’évaluation clinique du nourrisson dès la première heure après la naissance, puis toutes les 3 heures pendant au moins 72 heures et jusqu’à 120 heures [5]. Il prend en compte plusieurs symptômes répartis en trois catégories : les troubles du système nerveux central, les troubles métaboliques et les troubles gastrointestinaux. Un score allant de 1 à 5 est attribué en fonction de la gravité [5]. Il permet d’affiner le diagnostic, d’orienter l’attitude thérapeutique et de déterminer la surveillance nécessaire [3, 5].
Une réponse thérapeutique limitée ?
Pour traiter le syndrome d’abstinence néonatale, les techniques non médicamenteuses sont utilisées en première intention. Ces soins de soutien visent à maintenir la dyade mère-enfant en favorisant le contact « peau à peau » pendant le traitement. Le toucherrelationnel, l’emmaillotement, le bercement de l’enfant, mais également l’allaitement en petites tétées riches en nutriments contribuent à réduire l’intensité des symptômes. D’autres approches intègrent la famille à la thérapie ou modulent l’espace de soin pour limiter les stimulations sensorielles du nouveau-né (faible luminosité, réduction du bruit ambiant) [7].
La thérapie médicamenteuse per os, quant à elle, fondée sur l’administration d’opioïdes au nouveau-né, a longtemps été la plus utilisée. On utilise principalement la morphine pour des raisons de facilité d’usage et de flexibilité [3]. Buprénorphine, méthadone, clonidine ou phénobarbital sont utilisés en deuxième intention lorsque le chlorhydrate de morphine est inefficace [8]. Ce dernier modifie considérablement l’activité cérébrale en se liant aux récepteurs µ des opiacés dans l’encéphale et la moelle spinale. Il mime donc la sécrétion d’endorphines ayant des effets sédatifs, euphorisants et analgésiques [9]. La posologie (dosage et fréquence d’administration) doit être individualisée, adaptée en fonction des signes cliniques et du score de Finnegan : plus celui-ci est élevé, plus la dose de morphine administrée est forte [3, 6]. Cependant, l’administration post-natale de morphine comporte des effets indésirables sur le développement cognitif de l’enfant : somnolence, lésion de la substance blanche (altération de la gaine de myéline des axones), ou encore apoptose neuronale [9]. Il est donc primordial de développer de nouvelles thérapies ayant moins d’effets indésirables.
Une alternative prometteuse
La neurostimulation auriculaire transcutanée
Des recherches précédentes chez l’adulte ont montré l’efficacité de la neurostimulation pour le traitement de la douleur, des troubles moteurs ou psychiatriques, mais également du syndrome d’abstinence des opiacés [10]. Adaptée au nouveau-né, la neurostimulation pourrait constituer un nouveau traitement adjuvant à l’administration orale de morphine.
Jenkins et collaborateurs [3] présentent une technique utilisant un système portable qui fournit une stimulation transcutanée du pavillon de l’oreille gauche (Figure 1). Grâce à un écouteur comprenant quatre électrodes, trois régions du dermatome1 auriculaire sont ciblées afin de stimuler différents nerfs. Ainsi, la branche auriculaire du nerf vague est stimulée à basse fréquence (5 Hz) dans la zone de la cymba conchae, tandis que la branche auriculo-temporale du nerf trijumeau est stimulée à haute fréquence (100 Hz) dans la zone du tragus. Quant aux électrodes appliquées à l’arrière du pavillon de l’oreille, elles permettent la stimulation du nerf grand auriculaire, dont l’efficacité contre le syndrome de sevrage des opiacés reste à déterminer [11]. L’intensité électrique du dispositif a été modulée à 0,1 mA en dessous du seuil de perception propre à chaque nouveau-né.
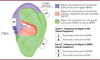 |
Figure 1. Système de neurostimulation auriculaire transcutanée. L’écouteur fournit une stimulation électrique de trois régions du dermatome auriculaire grâce à quatre électrodes. La stimulation de la cymba conchae et du tragus stimulent respectivement la branche auriculaire du nerf vague (BANV) et la branche auriculo-temporale du nerf trijumeau (BATNT). Les électrodes situées à l’arrière de l’oreille permettent de stimuler le nerf grand auriculaire (NGA). (Figure adaptée de [3]). |
Un traitement adjuvant révolutionnaire
Les auteurs ont testé l’efficacité de l’utilisation de la neurostimulation auriculaire transcutanée en tant que traitement associé à l’administration de morphine chez huit nouveau-nés souffrant du syndrome de sevrage des opiacés (Figure 2). La neurostimulation auriculaire est effectuée 1 heure avant l’administration orale de la morphine, jusqu’à 4 fois par jour, pendant 12 jours maximum. La conclusion de cet essai clinique est que ce traitement nonmédicamenteux et non-invasif est sûr et bien toléré. Ce traitement permet de diminuer l’utilisation prolongée de la morphine chez les nouveau-nés atteint d’un syndrome de sevrage aux opioïdes [3]. La durée moyenne d’hospitalisation sans traitement par neurostimulation auriculaire transcutanée est de 23 jours. Avec ce traitement, elle est significativement plus courte pour les nouveaunés traités dès la première dose de morphine (6 jours) ou 72 heures après la première dose (9 jours).
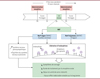 |
Figure 2. Fonctionnement et effets de la neurostimulation auriculaire transcutanée chez le nouveau-né. Ajoutée au traitement par la morphine ou par la méthadone, la neurostimulation auriculaire transcutanée (NAT) du pavillon de l’oreille gauche stimule la branche auriculaire du nerf vague (BANV) et la branche auriculo-temporale du nerf trijumeau (BATNT). L’information est relayée dans différentes régions cérébrales, ce qui libère des opioïdes endogènes. L’augmentation de l’activité parasympathique par la stimulation du nerf vague ainsi que la fixation des endorphines sur les récepteurs µ des opiacés réduisent les symptômes du sevrage des opioïdes. (Figure adaptée de [3]). |
Chez le nouveau-né, lorsque la neurostimulation auriculaire transcutanée est effectuée avant l’administration orale de morphine, des opioïdes endogènes sont libérés au niveau du tronc cérébral, ce qui atténue les symptômes de sevrage des opiacés et permet de réduire la durée du traitement par la morphine. Le syndrome de sevrage témoigne d’une suractivité du système nerveux sympathique. La neurostimulation auriculaire transcutanée, en augmentant l’activité du système nerveux parasympathique, via la libération d’acétylcholine par stimulation du nerf vague, permettrait de rétablir l’équilibre du système nerveux autonome. Enfin, la neurostimulation auriculaire n’a eu d’effets indésirables notables sur le long terme ni chez l’adulte, ni chez le nouveau-né [3, 10].
Limites et perspectives
Compte tenu des effets délétères de la morphine sur le développement neuronal du nouveau-né, il convient de développer des traitements non-pharmacologiques et non-invasifs de substitution contre le syndrome de sevrage des opioïdes néonatal. La neurostimulation auriculaire transcutanée en fait partie [12, 13]. Les recherches portant sur l’utilisation de cette technique devront à l’avenir répondre au gold-standard méthodologique : études standardisées, contrôlées et randomisées, portant sur un plus grand nombre de nouveau-nés afin de produire des résultats à niveau de preuve plus élevé [14]. De plus, le rôle d’un possible effet placebo devrait être évalué, bien que l’existence d’un tel effet soit encore discutée en médecine néonatale [3]. Il conviendra également de préciser les sites et paramètres de stimulation du nerf vague par cette technique. Par ailleurs, Jenkins et collaborateurs envisagent de doser le cortisol salivaire pour mesurer le stress oxydant dans le cerveau des nouveau-nés concernés [3].
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Kocherlakota P. Neonatal abstinence syndrome. Pediatrics 2014 ; 134 : 547–61. [Google Scholar]
- Patrick SW, Barfield WD, Poindexter BB, et al. Neonatal opioid withdrawal syndrome. Pediatrics 2020 ; 146 : 1–18. [Google Scholar]
- Jenkins DD, Khodaparast N, O’Leary GH, et al. Transcutaneous auricular neurostimulation (tAN): A novel adjuvant treatment in neonatal opioid withdrawal syndrome. Front Hum Neurosci 2021 ; 15 : 1–12. [CrossRef] [Google Scholar]
- Lind JN, Interrante JD, Ailes EC, et al. Maternal use of opioids during pregnancy and congenital malformations: A systematic review. Pediatrics 2017 ; 139 : 1–18. [Google Scholar]
- Lacaze-Masmonteil T, O’Flaherty P. La prise en charge des nouveau-nés dont la mère a pris des opioïdes pendant la grossesse. J Paediatr Child Health 2018 ; 23 : 227–33. [CrossRef] [Google Scholar]
- Weller AE, Crist RC, Reiner BC, et al. Neonatal opioid withdrawal syndrome (NOWS): A transgenerational echo of the opioid crisis. Cold Spring Harb Perspect Med 2021 ; 11 : 1–11. [Google Scholar]
- Martinet M. Pédiatrie. Les soins de soutien au développement en néonatologie. Revue Médicale Suisse 2011 ; 7 : 61–2. [CrossRef] [PubMed] [Google Scholar]
- Zangger P. Quand la morphine ne suffit plus. Revue Médicale Suisse 2012 ; 8 : 231–2. [CrossRef] [PubMed] [Google Scholar]
- Morphine Lavoisier (chlorhydrate). Laboratoire Chaix et du Marais, France : VIDAL, 2022. [Google Scholar]
- Tirado CF, Washburn SN, Covalin A, et al. Delivering transcutaneous auricular neurostimulation (tAN) to improve symptoms associated with opioid withdrawal: results from a prospective clinical trial. Bioelectron Med 2022 ; 8 : 1–12. [CrossRef] [PubMed] [Google Scholar]
- Badran BW, Yu AB, Adair D, et al. Laboratory administration of transcutaneous auricular vagus nerve stimulation (taVNS): Technique, targeting, and considerations. J Vis Exp 2019 ; 143 : 1–20. [Google Scholar]
- Filippelli AC, White LF, Spellman LW, et al. Non-insertive acupuncture and neonatal abstinence syndrome: A case series from an inner city safety net hospital. Glob Adv Health Med 2012 ; 1 : 48–52. [CrossRef] [PubMed] [Google Scholar]
- Price HR, Collier AC, Wright TE. Screening pregnant women and their neonates for illicit drug use: Consideration of the integrated technical, medical, ethical, legal, and social issues. Front Pharmacol 2018 ; 9 : 1–11. [CrossRef] [PubMed] [Google Scholar]
- Zhu SY, Zhang XL, Zhou MH, et al. Therapeutic applications of transcutaneous auricular vagus nerve stimulation with potential for application in neurodevelopmental or other pediatric disorders. Front Endocrinol 2022 ; 13 : 1–17. [Google Scholar]
© 2025 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Système de neurostimulation auriculaire transcutanée. L’écouteur fournit une stimulation électrique de trois régions du dermatome auriculaire grâce à quatre électrodes. La stimulation de la cymba conchae et du tragus stimulent respectivement la branche auriculaire du nerf vague (BANV) et la branche auriculo-temporale du nerf trijumeau (BATNT). Les électrodes situées à l’arrière de l’oreille permettent de stimuler le nerf grand auriculaire (NGA). (Figure adaptée de [3]). |
| Dans le texte | |
 |
Figure 2. Fonctionnement et effets de la neurostimulation auriculaire transcutanée chez le nouveau-né. Ajoutée au traitement par la morphine ou par la méthadone, la neurostimulation auriculaire transcutanée (NAT) du pavillon de l’oreille gauche stimule la branche auriculaire du nerf vague (BANV) et la branche auriculo-temporale du nerf trijumeau (BATNT). L’information est relayée dans différentes régions cérébrales, ce qui libère des opioïdes endogènes. L’augmentation de l’activité parasympathique par la stimulation du nerf vague ainsi que la fixation des endorphines sur les récepteurs µ des opiacés réduisent les symptômes du sevrage des opioïdes. (Figure adaptée de [3]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




