| Issue |
Med Sci (Paris)
Volume 40, Number 11, Novembre 2024
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 879 - 881 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2024157 | |
| Published online | 10 December 2024 | |
L’inhibition systémique d’ASBT
Une cible thérapeutique pour les cholestases
Systemic ASBT inhibition as a therapeutic target for cholestasis
1
M1 Biologie-Santé, Université Paris-Saclay, Orsay, France
2
Inserm, Université Paris-Saclay, Physiopathogénèse et traitement des maladies du foie, UMR_S 1193, Hepatinov, Orsay, France
a
alexandra.boitard@ens.uvsq.fr
b
melanie.goncalves@ens.uvsq.fr
c
tala.hajar@universite-paris-saclay.fr
d
thomas.falguieres@inserm.fr
Le foie est un organe vital impliqué dans de nombreuses fonctions biologiques, telles que la digestion des graisses et l’homéostasie du cholestérol. Cet organe est intégré dans la circulation entérohépatique [1–2] qui constitue une boucle de transport des acides biliaires depuis et vers le foie en passant par l’intestin grêle. Les acides biliaires sont sécrétés dans la bile grâce au transporteur BSEP (bile salt export pump) exprimé par les hépatocytes, puis passent à travers les canaux hépatiques commun et cholédoque qui s’abouchent à l’intestin au niveau du duodénum. Dans l’iléum (partie terminale de l’intestin grêle), les acides biliaires sont réabsorbés par le transporteur ASBT (apical sodium-dependent bile acid transporter) et retournent jusqu’au foie par la circulation sanguine, les hépatocytes recapturant les acides biliaires grâce au transporteur NTCP (sodium taurocholate co-transporting polypeptide) (Figure 1). Cette circulation entérohépatique peut être altérée lors de maladies hépatiques. C’est le cas notamment des cholestases, caractérisées par un arrêt ou une diminution de la sécrétion biliaire. La cholestase se manifeste cliniquement par un prurit (démangeaisons), un ictère (jaunisse) et l’accumulation d’acides biliaires au niveau du foie entraînant des phénomènes d’inflammation et de nécrose, pouvant aboutir à la fibrose, voire à la cirrhose [3]. Même si la cholestase est le plus souvent associée à une augmentation de la concentration des acides biliaires circulants, cela n’explique pas entièrement le prurit qui est observé chez les patients. Les approches thérapeutiques existantes pour la cholestase, telles que l’utilisation d’agents séquestrants des acides biliaires et de médicaments hépatoprotecteurs, présentent souvent des effets secondaires, tels que des troubles gastro-intestinaux et des anomalies hépatiques. Ainsi, le développement de nouvelles approches thérapeutiques plus ciblées et mieux tolérées est devenu primordial. Dans ce contexte, des recherches visent actuellement à inhiber la recapture des acides biliaires par ASBT. Ce transporteur, codé par le gène SLC10A2, est exprimé dans plusieurs tissus, principalement au niveau de l’iléum mais également au niveau du tubule contourné proximal du rein (Figure 1). ASBT constitue le principal régulateur des taux d’acides biliaires dans la circulation entérohépatique en assurant l’homéostasie des acides biliaires et du cholestérol dans le foie. L’activation du récepteur nucléaire FXR (farnesoid X receptor) au niveau des hépatocytes contribue également à cette régulation par rétrocontrôle négatif de leur biosynthèse à partir du cholestérol [4].
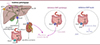 |
Figure 1. Réabsorption des acides biliaires de l’intestin vers le foie en conditions pathologiques ou en présence d’inhibiteurs d’ASBT. (Gauche) Au niveau du foie, l’expression du récepteur FXR est diminuée, ne régulant plus la synthèse d’acides biliaires à partir du cholestérol. Les acides biliaires sont accumulés dans le foie ce qui induit un arrêt ou une diminution de la sécrétion biliaire (cholestase). La circulation entérohépatique est perturbée. (Centre) L’inhibition systémique d’ASBT, dans l’intestin et le rein, augmente l’excrétion urinaire et fécale des acides biliaires, diminuant ainsi potentiellement les effets secondaires. (Droite) L’inhibition locale, dans l’intestin uniquement, d’ASBT provoque des effets secondaires telles que la diarrhée, des selles irrégulières et des douleurs intestinales. AB, acides biliaires ; ASBT, apical sodium-dependent bile acid transporter ; ASBTi, inhibiteur d’ASBT ; BSEP, bile salt export pump ; FXR, farnesoid X receptor ; NTCP, sodium taurocholate co-transporting polypeptide ; OCA, acide obéticholique. (Figure créée avec Biorender.com). |
Des limites à l’inhibition locale du transporteur ASBT au niveau de l’intestin
Les recherches sur l’implication du transporteur ASBT dans les maladies du foie connaissent un essor important depuis 2020. Des essais en cours montrent que l’inhibition locale d’ASBT au niveau de l’intestin réduit les concentrations sériques d’acides biliaires et les symptômes liés à la cholestase chez les rongeurs et chez les patients. Cependant, l’inhibition pharmacologique d’ASBT au niveau de l’intestin diminue indirectement l’activation de FXR dans les hépatocytes (via le cycle entérohépatique des acides biliaires). Cela conduit à une baisse d’expression de BSEP, le transporteur canaliculaire d’acides biliaires, et à une hausse de l’expression d’enzymes responsables de la synthèse des acides biliaires à partir du cholestérol par le foie [5] (→), entraînant une synthèse accrue d’acides biliaires dans le foie mais aussi une surcharge dans le côlon [6]. En clinique, cette surcharge intestinale en acides biliaires a pour conséquence l’apparition de diarrhées, de selles irrégulières et de douleurs intestinales. Pour limiter ces effets secondaires, une récente étude réalisée par Kunst et al. suggère de coupler l’inhibition de la réabsorption intestinale des acides biliaires à l’inhibition concomitante de leur recapture au niveau rénal [6].
(→) Voir la Synthèse de R. Poupon et al., m/s n° 12, décembre 2004, page 1096
L’inhibition systémique d’ASBT réduit les dommages liés à la cholestase chez la souris
Les auteurs de cette étude ont utilisé un modèle de cholestase induite expérimentalement par ligature des voies biliaires (bile duct ligation, BDL), interrompant ainsi toute circulation des acides biliaires du foie vers l’intestin. Lorsque la BDL est réalisée chez des souris génétiquement déficientes pour ASBT (ASBT-KO), celles-ci présentent une réduction significative de la concentration plasmatique d’acides biliaires, une diminution des concentrations sériques des enzymes hépatiques, et une baisse de la nécrose hépatique et des lésions des voies biliaires [6]. Cela indique que l’inhibition d’ASBT dans le cas d’une cholestase a des effets hépato-protecteurs, confirmant les résultats d’études antérieures [7]. Cependant, il a été constaté que les souris ASBT-KO après BDL possèdent un pool total d’acides biliaires (intestin, foie et vésicule biliaire) réduit et une augmentation importante de l’excrétion urinaire des acides biliaires [6]. Par des études comparatives de la taille des pools d’acides biliaires dans le foie, l’intestin et la vésicule biliaire par chromatographie en phase inverse (HPLC), les auteurs ont démontré que les effets hépato-protecteurs sur la cholestase résultaient en réalité de la réduction du pool total d’acides biliaires et de l’augmentation de l’excrétion urinaire des acides biliaires [6]. Ne disposant pas d’un inhibiteur à action globale (entérique + rénale), les chercheurs ont utilisé un inhibiteur entérique d’ASBT (GSK2299027B) couplé à l’OCA (obeticholic acid), un agoniste de FXR visant à réduire la taille du pool intestinal d’acides biliaires (Figure 1), reproduisant ainsi de manière indirecte l’effet de l’inactivation génétique d’ASBT [6]. Après ligature des voies biliaires, le traitement OCA couplé à l’inhibiteur d’ASBT a permis de diminuer la concentration sérique d’acides biliaires, la nécrose, ainsi que les effets délétères de la cholestase par rapport à des souris contrôles non traitées [6]. À l’aide d’expériences complémentaires dans des modèles cellulaires, les auteurs ont montré que l’OCA induit l’augmentation de l’expression de gènes cibles de FXR, contribuant ainsi à une réduction de la synthèse d’acides biliaires [6]. Cela indique que les effets hépato-protecteurs attribués à l’OCA sont dus à son effet indirect d’inhibition de la synthèse des acides biliaires.
L’inhibition d’ASBT : une nouvelle piste thérapeutique
Des essais cliniques ont montré l’efficacité d’inhibiteurs d’ASBT, l’odevixibat et le maralixibat, à améliorer la condition de patients atteints de maladies cholestatiques [8–9]. Néanmoins, ces inhibiteurs sont restreints à l’intestin et ne permettent donc pas une inhibition totale d’ASBT, comme suggéré par l’étude de Kunst et al. [6]. Ces nouveaux inhibiteurs d’ASBT entraînent une réduction des concentrations sériques d’acides biliaires et des symptômes liés à la cholestase dans le cas de la cholangite biliaire primitive mais présentent de nombreux effets indésirables. Les expériences réalisées in vivo sur des modèles murins d’inhibition systémique combinant un inhibiteur d’ASBT à un agoniste de FXR (OCA) miment les conditions d’inhibition totale d’ASBT [6]. Néanmoins, ces effets sont indirects et ne sont pas directement liés à une réelle inhibition d’ASBT au niveau rénal. Dans ce contexte, une nouvelle molécule (A3907) a permis de montrer des effets inhibiteurs d’ASBT tant au niveau intestinal que rénal dans des modèles murins [10]. De plus, cette molécule est bien tolérée chez l’homme (essai clinique de phase I) [10], suggérant l’adoption dans un proche avenir de cette nouvelle molécule en tant qu’inhibiteur systémique global (intestinal et urinaire) d’ASBT.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Durník R, Šindlerová L, Babica P, et al. Bile acids transporters of enterohepatic circulation for targeted drug delivery. Molecules 2022 ; 27 : 2961. [Google Scholar]
- Dawson PA, Lan T, Rao A. Bile acid transporters. J Lipid Res 2009 ; 50 : 2340–57. [CrossRef] [PubMed] [Google Scholar]
- de Vries E, Beuers U. Management of cholestatic disease in 2017. Liver Int 2017 ; 37 : 123–9. [CrossRef] [PubMed] [Google Scholar]
- Yang N, Dong YQ, Jia GX, et al. ASBT(SLC10A2): A promising target for treatment of diseases and drug discovery. Biomed Pharmacother 2020 ; 132 : 110835. [CrossRef] [PubMed] [Google Scholar]
- Poupon R, Chignard N, Rosmorduc O, et al. La fonction biliaire et sa régulation. Med Sci (Paris) 2004 ; 20 : 1096–9. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Kunst RF, de Waart DR, Wolters F, et al. Systemic ASBT inactivation protects against liver damage in obstructive cholestasis in mice. JHEP Rep 2022 ; 4 : 100573. [CrossRef] [PubMed] [Google Scholar]
- Baghdasaryan A, Fuchs CD, Österreicher CH, et al. Inhibition of intestinal bile acid absorption improves cholestatic liver and bile duct injury in a mouse model of sclerosing cholangitis. J Hepatol 2016 ; 64 : 674–81. [CrossRef] [PubMed] [Google Scholar]
- Thompson RJ, Arnell H, Artan R, et al. Odevixibat treatment in progressive familial intrahepatic cholestasis: a randomised, placebo-controlled, phase 3 trial. Lancet Gastroenterol Hepatol 2022 ; 7 : 830–42. [CrossRef] [PubMed] [Google Scholar]
- Gonzales E, Hardikar W, Stormon M, et al. Efficacy and safety of maralixibat treatment in patients with Alagille syndrome and cholestatic pruritus (ICONIC): a randomised phase 2 study. Lancet 2021 ; 398 : 1581–92. [CrossRef] [PubMed] [Google Scholar]
- Caballero-Camino FJ, Rodrigues PM, Wångsell F, et al. A3907, a systemic ASBT inhibitor, improves cholestasis in mice by multiorgan activity and shows translational relevance to humans. Hepatology 2023 ; 78 : 709–26. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Réabsorption des acides biliaires de l’intestin vers le foie en conditions pathologiques ou en présence d’inhibiteurs d’ASBT. (Gauche) Au niveau du foie, l’expression du récepteur FXR est diminuée, ne régulant plus la synthèse d’acides biliaires à partir du cholestérol. Les acides biliaires sont accumulés dans le foie ce qui induit un arrêt ou une diminution de la sécrétion biliaire (cholestase). La circulation entérohépatique est perturbée. (Centre) L’inhibition systémique d’ASBT, dans l’intestin et le rein, augmente l’excrétion urinaire et fécale des acides biliaires, diminuant ainsi potentiellement les effets secondaires. (Droite) L’inhibition locale, dans l’intestin uniquement, d’ASBT provoque des effets secondaires telles que la diarrhée, des selles irrégulières et des douleurs intestinales. AB, acides biliaires ; ASBT, apical sodium-dependent bile acid transporter ; ASBTi, inhibiteur d’ASBT ; BSEP, bile salt export pump ; FXR, farnesoid X receptor ; NTCP, sodium taurocholate co-transporting polypeptide ; OCA, acide obéticholique. (Figure créée avec Biorender.com). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




