| Issue |
Med Sci (Paris)
Volume 40, Novembre 2024
Les Cahiers de Myologie
|
|
|---|---|---|
| Page(s) | 56 - 59 | |
| Section | Prix SFM | |
| DOI | https://doi.org/10.1051/medsci/2024139 | |
| Published online | 18 November 2024 | |
Rôle du facteur de transcription PAX3 au cours de la myogenèse
De l’embryon à l’adulte
Role of the transcription factor PAX3 during myogenesis: from the embryo to the adult stage
Université Paris Est Créteil, Inserm, EnvA, EFS, AP-HP, IMRB, Créteil, France
*
joana.esteves-de-lima@inserm.fr
**
frederic.relaix@inserm.fr
Le facteur de transcription PAX3 est un acteur clé de la myogenèse embryonnaire, contrôlant la spécification, la migration, la prolifération et la différenciation des cellules musculaires pour assurer le développement des muscles striés squelettiques chez l’embryon. Les cellules souches du muscle adulte, nommées cellules satellites (CS), présentent une hétérogénéité en termes d’expression du gène Pax3 entre les différents muscles, et affichent une réponse bimodale à l’exposition au stress environnemental. Cependant, son rôle potentiel dans un contexte de régénération musculaire reste peu étudié. Pour explorer le rôle de PAX3 dans les cellules satellites lors de la régénération musculaire, nous avons réalisé des études de régénération, révélant ainsi une hétérogénéité fonctionnelle de ces cellules en fonction de l’expression de Pax3. Ensuite, pour identifier les réseaux régulateurs géniques en aval de PAX3, l’étude cherche à comprendre les mécanismes moléculaires responsables de cette hétérogénéité et à identifier les gènes cibles de PAX3 et leur rôle dans le développement musculaire et la régénération, afin de les utiliser comme nouvelles cibles pour de futures thérapies préventives.
Abstract
PAX3 plays a crucial role in embryonic myogenesis, controlling the specification, migration, proliferation, and differentiation of muscle progenitor cells to ensure normal skeletal muscle development in the embryo. However, PAX3 potential role in a context of muscle homeostasis and regeneration remains poorly investigated. The adult muscle stem cells, known as satellite cells (SCs) exhibit heterogeneity in Pax3 expression in various muscles throughout the body and display a bimodal response to environmental stress exposure. To explore the role of PAX3 in the context of tissue damage, we performed regeneration studies, which unveiled a functional heterogeneity of the SCs populations depending on Pax3 expression. Together, this project aims to decipher cell-type specific dysregulations linked to tissue damage and identify PAX3 downstream gene regulatory networks that can lead to specific SC behavior, thus potentially providing novel strategies for muscle disease preventive therapies.
© 2024 médecine/sciences – Inserm

© V. Zoglio
Vignette : Cellules exprimant un gène rapporteur Pax3 (bleu), observées par immunomarquage avec X-Gal, dans une coupe longitudinale d’un muscle biceps brachial murin.
PAX3, un régulateur génétique clé de la myogenèse embryonnaire
La formation du muscle squelettique est contrôlée par des réseaux de régulation génétique complexes. Le facteur de transcription PAX3 est caractérisé par des domaines de liaison à l’ADN – le domaine paired (PD) et l’homéodomaine (HD) – à son extrémité N-terminale, et un domaine de transactivation à son extrémité C-terminale. C’est un régulateur majeur de la myogenèse embryonnaire [1]. L’expression de Pax3 est observée au jour embryonnaire 8,5 dans le mésoderme pré-somitique [2] (Figure 1A). Lorsque les somites se forment, PAX3 est initialement exprimé dans l’ensemble des somites, puis il est confiné dans la portion épithéliale dorsale, le dermomyotome. L’expression de Pax3 se concentre ensuite dans les régions épaxiales et hypaxiales du dermomyotome [1, 3]. Lorsque les cellules progénitrices musculaires se détachent du dermomyotome pour former le muscle différencié sous-jacent du myotome, l’expression de Pax3 est réprimée et des facteurs de transcription myogéniques sont activés (MYF5, MRF4 pour myogenic factor 5 et 4, et MYOD1 pour myogenic differentiation 1) [3]. Du côté hypaxial, une sous-population de cellules exprimant Pax3 se détache également du dermomyotome et migre vers des sites myogéniques éloignés tels que les membres, la langue et le diaphragme [2–7] (Figure 1A). Au fur et à mesure que le développement progresse, le domaine central du dermomyotome où Pax7, le paralogue de Pax3, est induit, perd sa structure épithéliale, et les cellules exprimant à la fois PAX3 et PAX7 pénètrent dans le myotome sous-jacent où elles constituent la population de cellules progénitrices pour la croissance musculaire ultérieure (Figure 1A). Ces cellules contribuent à la croissance musculaire pendant la période postnatale et à la régénération musculaire par la suite [8].
 |
Figure 1 Développement du dermomoyotome et détermination du muscle squelettique. A. Schéma représentant les différents degrés de maturation des somites, avec les domaines dermomyotomaux en évidence. B. Cascades de signalisation opérant au niveau des domaines dermomyotomaux épaxiaux et hypaxiaux, qui activent l’expression des facteurs de régulation myogénique (MRF). (Adapté de Esteves de Lima et Relaix, Cell Regen 2021). |
Voies de signalisation en aval de PAX3
PAX3 orchestre de nombreuses voies de signalisation impliquées dans l’activation de la myogenèse, en régulant les gènes effecteurs de ces voies. Afin de comprendre la fonction de PAX3 chez les cellules progénitrices myogéniques, il est essentiel d’identifier et de caractériser ses cibles. Notamment, le gène c-Met (mesenchymal epithelial transition) a été identifié comme une cible directe de PAX3 [9]. Ce gène code pour un récepteur à activité tyrosine kinase, qui interagit avec son ligand, l’hepatocyte growth factor/scatter factor (HGF/SF), une signalisation nécessaire à la délamination, ainsi qu’à la migration et à la prolifération des progéniteurs myogéniques (Figure 1A). Dans la voie de signalisation FGF (fibroblast growth factor) associée à la prolifération cellulaire, Sprouty1 et Fgfr4 (fibroblast growth factor receptor 4) ont été montrés comme étant des cibles directes de PAX3, ce qui démontre que l’auto-renouvellement des progéniteurs myogéniques est en partie orchestré par la modulation de la signalisation FGF par PAX3 [10]. Dmrt2 (doublesex and mab-3 related transcription factor 2) a également été identifié comme une cible directe de PAX3. Ce gène code pour un facteur de transcription qui est présent dans les cellules exprimant Pax3 au niveau épaxial du dermomyotome, et qui régule un élément activateur épaxial précoce du gène Myf5, nécessaire au début de la myogenèse dans le somite [11, 12]. PAX3 régule le destin cellulaire en contrôlant négativement FoxC2 (forkhead box C2) dans le somite épithélial, puis dans le dermomyotome où ces gènes sont coexprimés. La modulation de cette répression réciproque aboutit à des cellules progénitrices myogéniques positives pour PAX3 ou à des cellules progénitrices vasculaires positives pour FOXC2 [13]. L’entrée des cellules progénitrices dans le programme myogénique dépend des facteurs de détermination myogénique MYF5 et MYOD. Un rôle crucial dans la voie génétique Pax3/MyoD qui régule le début de la myogenèse est assuré par les protéines SIX1/4. Il a été montré que les régions régulatrices de MYOD1 sont directement contrôlées par les protéines SIX, et qu’en l’absence de SIX1 et SIX4, SIX2 peut partiellement compenser leur activité [14, 15] (Figure 1B).
Adaptations physiologiques au stress environnemental
Le muscle squelettique possède de grandes capacités régénératrices, ce qui en fait un organe très plastique. À l’origine de cette plasticité musculaire se trouve un réservoir de cellules souches, les cellules satellites (CS), qui se localisent en périphérie des fibres musculaires [16] et dérivent des cellules progénitrices Pax3/Pax7 du dermomyotome. À la suite d’un stimulus tel qu’une blessure musculaire, les cellules satellites s’activent et s’engagent dans le programme de différentiation myogénique pour assurer la régénération du tissu [17, 18]. Bien que toutes les cellules satellites expriment le facteur de transcription PAX7, notre laboratoire a montré que seulement une minorité coexpriment PAX3 [19]. La proportion de cellules satellites exprimant PAX3 varie selon les différents muscles, représentant par exemple la moitié des cellules des muscles du tronc, des membres antérieurs et du diaphragme, et seulement dix pour cent des cellules des muscles des membres postérieurs [19]. Il a été démontré que le renouvellement homéostatique des cellules satellites dans un état quiescent est contrôlé par PAX3 [20], dont l’expression détermine l’activation des cellules satellites dans les muscles au repos. Un autre rôle particulier est joué par Pax3 dans le contexte du stress environnemental ainsi que de l’irradiation [21, 22]. Des études de notre équipe de recherche ont montré qu’il existe une hétérogénéité des cellules souches musculaires en réponse à la pollution, et que cela dépend de l’expression de Pax3. En particulier, il a été démontré que tandis que les cellules souches musculaires n’exprimant pas PAX3 présentent une survie altérée, une activation aberrante et une fusion sporadique avec les myofibres lors de l’exposition aux polluants, les cellules souches musculaires qui l’expriment en sont protégées grâce à une réponse G(alert) dépendante de mTORC1 (mechanistic target of rapamycin complex 1) [21] (Figure 2A). Toujours dans le contexte du stress, il a été montré que les cellules satellites exprimant PAX3 présentent un comportement radio-tolérant en réponse à l’irradiation et constituent une population de réserve de cellules souches musculaires capables d’expansion clonale, contribuant ainsi à la réparation musculaire et au maintien des cellules souches [22].
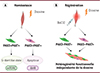 |
Figure 2 Hétérogénéité fonctionnelle des cellules satellites lors de l’homéostasie (A) et de la régénération musculaire (B). |
Un nouveau rôle de PAX3 lors de la régénération musculaire
En tenant compte des études précédentes mettant en évidence le rôle protecteur exercé par PAX3 dans un contexte de stress environnemental, notre travail actuel se concentre sur les mécanismes moléculaires régissant le comportement des cellules satellites (CS) et la réparation tissulaire dans le contexte d’un stress environnemental (Figure 2A-B). Pour explorer le rôle de PAX3 dans le contexte de la régénération et de la pollution, nous avons réalisé des études de régénération et des analyses in vivo sur des cellules satellites (CS), en administrant de la dioxine aux animaux pendant un mois, puis en provoquant une blessure musculaire.
Tout d’abord, nous avons démontré que la dioxine affecte la régénération musculaire en favorisant la formation de nouvelles fibres de taille réduite, observées à 7 et 28 jours après la blessure. Bien que ce résultat puisse suggérer que la régénération est altérée et que le muscle développe un phénotype atrophique après l’exposition à la dioxine, aucun changement significatif n’est observé dans le réservoir de cellules satellites PAX7+ entre les échantillons traités à la dioxine et les témoins. Les résultats obtenus ont révélé que la dioxine n’a pas d’impact sur le comportement des cellules satellites 7 jours après la blessure. De manière frappante, la proportion de la population positive pour PAX3 est modifiée lors de la blessure dans les muscles analysés, indépendamment de la dioxine, révélant une hétérogénéité fonctionnelle des cellules satellites en fonction de l’expression de PAX3. Par conséquent, nous avons observé que pendant la régénération musculaire, la présence de PAX3 dans les cellules souches est associée à une prolifération et une différenciation plus importantes. Ces découvertes suggèrent un plus grand engagement envers la lignée myogénique, ce qui pourrait indiquer qu’elles peuvent fournir une réponse plus efficace à la blessure.
Actuellement, notre équipe s’attache à décrypter les différences transcriptionnelles au niveau de l’ARN et du séquençage de cellules uniques, pour étudier les mécanismes cellulaires qui peuvent expliquer cette disparité entre les cellules satellites. Cela soulève désormais des questions sur le rôle respectif de ces deux sous-populations dans la réparation du muscle squelettique.
Enfin, nous avons développé un modèle murin conditionnel permettant d’invalider spécifiquement l’expression du gène Pax3 au sein des cellules souches musculaires. Grâce à cet outil, nous pouvons caractériser in vivo les conséquences de la perte de PAX3 dans les cellules souches musculaires au cours de la myogenèse régénérative, sur les plans histologique et moléculaire. Dans l’ensemble, ces résultats mettent en lumière, pour la première fois, un processus d’hétérogénéité fonctionnelle finement contrôlé et régulé par PAX3 dans les cellules souches, et contribuent à une meilleure compréhension des mécanismes moléculaires associés à la régénération des muscles squelettiques, dans des conditions normales et pathologiques.
Prix SFM
Virginia Zoglio a reçu le prix de la Meilleure communication orale lors des journées de la Société française de myologie (SFM) 2023.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Buckingham M, Relaix F. The Role of Pax Genes in the Development of Tissues and Organs: Pax3 and Pax7 Regulate Muscle Progenitor Cell Functions. Annu Rev Cell Dev Biol 2007; 23 (1): 645–673. [CrossRef] [PubMed] [Google Scholar]
- Abmayr SM, Keller CA. Drosophila Myogenesis and insights into the Role of nautilus. Curr Top Dev Biol 1998; 38: 35–80. [CrossRef] [PubMed] [Google Scholar]
- Tajbakhsh S, Buckingham M. The Birth of Muscle Progenitor Cells in the Mouse: Spatiotemporal Considerations. Curr Top Dev Biol 2000; 48: 225–268. [CrossRef] [PubMed] [Google Scholar]
- Tremblay P, Dietrich S, Mericskay M, et al. A Crucial Role for Pax3 in the Development of the Hypaxial Musculature and the Long-Range Migration of Muscle Precursors. Dev Biol 1998; 203 (1): 49–61. [CrossRef] [PubMed] [Google Scholar]
- Bober E, Brand-Saberi B, Ebensperger C, et al. Initial steps of myogenesis in somites are independent of influence from axial structures. Development 1994; 120 (11): 3073–3082. [CrossRef] [PubMed] [Google Scholar]
- Goulding M, Lumsden A, Paquette AJ. Regulation of Pax-3 expression in the dermomyotome and its role in muscle development. Development 1994; 120 (4): 957–971. [CrossRef] [PubMed] [Google Scholar]
- Tajbakhsh S, Rocancourt D, Cossu G, et al. Redefining the Genetic Hierarchies Controlling Skeletal Myogenesis: Pax-3 and Myf-5 Act Upstream of MyoD. Cell 1997; 89 (1): 127–138. [CrossRef] [PubMed] [Google Scholar]
- Esteves de Lima J, Relaix F. Master regulators of skeletal muscle lineage development and pluripotent stem cells differentiation. Cell Regen 2021; 10 (1): 31. [CrossRef] [PubMed] [Google Scholar]
- Epstein JA, Shapiro DN, Cheng J, et al. Pax3 modulates expression of the c-Met receptor during limb muscle development. Proc Natl Acad Sci USA 1996; 93 (9): 4213–4218. [CrossRef] [PubMed] [Google Scholar]
- Lagha M, Kormish JD, Rocancourt D, et al. Pax3 regulation of FGF signaling affects the progression of embryonic progenitor cells into the myogenic program. Genes Dev 2008; 22 (13): 1828–1837. [CrossRef] [PubMed] [Google Scholar]
- Sato T, Rocancourt D, Marques L, et al. A Pax3/Dmrt2/Myf5 Regulatory Cascade Functions at the Onset of Myogenesis. PLoS Genet 2010; 6 (4): e1000897. [CrossRef] [PubMed] [Google Scholar]
- Seo KW. Dmrt2 and Pax3 double-knockout mice show severe defects in embryonic myogenesis. Comp Med 2007; 57 (5): 460–468. [PubMed] [Google Scholar]
- Lagha M, Brunelli S, Messina G, et al. Pax3:Foxc2. Reciprocal Repression in the Somite Modulates Muscular versus Vascular Cell Fate Choice in Multipotent Progenitors. Dev Cell 2009; 17 (6): 892–899. [CrossRef] [PubMed] [Google Scholar]
- Fougerousse F, et al. Six and Eya expression during human somitogenesis and MyoD gene family activation. J Muscle Res Cell Motil 2002; 23 (3): 255–264. [CrossRef] [PubMed] [Google Scholar]
- Relaix F, Demignon J, Laclef C, et al. Six Homeoproteins Directly Activate Myod Expression in the Gene Regulatory Networks That Control Early Myogenesis. PLoS Genet 2013; 9 (2): 493–5. [Google Scholar]
- Mauro A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol 1961; 9 (2): 493–495. [CrossRef] [Google Scholar]
- Seale P, Sabourin LA, Girgis-Gabardo A, et al. Pax7 Is Required for the Specification of Myogenic Satellite Cells. Cell 2000; 102 (6): 777–786. [CrossRef] [PubMed] [Google Scholar]
- Kuang S, Chargé SB, Seale P, et al. Distinct roles for Pax7 and Pax3 in adult regenerative myogenesis. J Cell Biol 2006; 172 (1): 103–113. [CrossRef] [PubMed] [Google Scholar]
- Relaix F, Montarras D, Zaffran S, et al. Pax3 and Pax7 have distinct and overlapping functions in adult muscle progenitor cells. J Cell Biol 2006; 172 (1): 91–102. [CrossRef] [PubMed] [Google Scholar]
- de Morree A, Klein JDD, Gan Q, et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science 1979; 366 (6466): 734–738. [Google Scholar]
- Der Vartanian A, Quétin M, Michineau S, et al. PAX3 Confers Functional Heterogeneity in Skeletal Muscle Stem Cell Responses to Environmental Stress. Cell Stem Cell 2019; 24 (6): 958–973.e9. [CrossRef] [PubMed] [Google Scholar]
- Scaramozza A, Park D, Kollu S, et al. Lineage Tracing Reveals a Subset of Reserve Muscle Stem Cells Capable of Clonal Expansion under Stress. Cell Stem Cell 2019; 24 (6): 944–957.e5. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1 Développement du dermomoyotome et détermination du muscle squelettique. A. Schéma représentant les différents degrés de maturation des somites, avec les domaines dermomyotomaux en évidence. B. Cascades de signalisation opérant au niveau des domaines dermomyotomaux épaxiaux et hypaxiaux, qui activent l’expression des facteurs de régulation myogénique (MRF). (Adapté de Esteves de Lima et Relaix, Cell Regen 2021). |
| Dans le texte | |
 |
Figure 2 Hétérogénéité fonctionnelle des cellules satellites lors de l’homéostasie (A) et de la régénération musculaire (B). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




