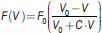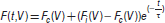| Issue |
Med Sci (Paris)
Volume 40, Novembre 2024
Les Cahiers de Myologie
|
|
|---|---|---|
| Page(s) | 69 - 73 | |
| Section | Prix SFM | |
| DOI | https://doi.org/10.1051/medsci/2024137 | |
| Published online | 18 November 2024 | |
Modèle Force-Vitesse-Endurance (FoVE)
Une nouvelle méthode d’évaluation fonctionnelle in situ des muscles striés squelettiques pour les modèles murins
Force-Velocity-Endurance (FoVE) Model: a new method for functional striated skeletal muscle in situ evaluation in murine models
1
Laboratoire Interuniversitaire de Biologie de la Motricité LIBM, Université Savoie Mont Blanc, 73000 Chambéry, France
2
Laboratoire Interuniversitaire de Biologie de la Motricité LIBM, Université Jean Monnet, 42100 Saint-Étienne, France
*
maximilien.bowen@univ-smb.fr
**
baptiste.morel-prieur@univ-smb.fr
Le modèle Force-Vitesse-Endurance (FoVE) est un nouveau cadre théorique couplé à une modélisation innovante pour évaluer les muscles striés squelettiques. Il se base sur les relations fondamentales « force-vitesse » et « force-temps » qui décrivent les capacités de production de force du muscle en fonction respectivement de la vitesse de contraction et de la durée d’exercice. En les combinant, le modèle FoVE offre une vue complète des capacités fonctionnelles du muscle à différentes vitesses, avec et sans fatigue.
Un protocole expérimental unique et rapide a été développé sur un système de mesure de force isocinétique afin d’obtenir les paramètres FoVE du modèle. Il permet de mesurer la force musculaire à différentes vitesses de contraction pendant une durée totale de 3 minutes. Appliqués au modèle murin, les résultats obtenus montrent ainsi des différences significatives de la fonction du muscle tibialis anterior. Les femelles présentent une force maximale normalisée plus élevée. À l’inverse, les mâles présentent une capacité de vitesse maximale initiale en condition de fatigue plus importante.
Cette approche fournit une cartographie complète de la fonction musculaire, dépassant les évaluations traditionnelles de la force isométrique. Elle peut ainsi être appliquée à la recherche fondamentale dans les modèles précliniques et à la recherche translationnelle chez l’Homme.
Abstract
The FoVE model is a new theoretical framework coupled with innovative modeling to evaluate the striated skeletal muscle function. The theoretical model is based on two fundamental relationships: the force-velocity relationship and the force-time relationship. These relationships describe the muscle force production capacity as a function of contraction velocity and exercise duration, respectively. By combining them, the FoVE model offers a comprehensive view of the muscle functional capacities at various velocities, with and without fatigue.
A unique experimental protocol has been developed using an isokinetic force measurement system to obtain the FoVE parameters of the model. This protocol enables muscle force to be measured at various contraction velocities for a total duration of 3 minutes. Applied to mouse model, the results obtained with the FoVE model show significant differences in the functional capacity of the tibialis anterior muscle. Females have a higher normalized initial maximal force. Conversely, males have a higher initial maximum velocity capacity under fatigue conditions.
This approach provides a comprehensive mapping of muscle function, surpassing traditional assessments of isometric strength. It can be applied to basic research in pre-clinical models and translational research in humans.
© 2024 médecine/sciences – Inserm

© M. Bowen
Fortius, citius, diutius
Les capacités contractiles du muscle strié squelettique sont essentielles aux mouvements et aux locomotions humaines et animales. Elles sont donc centrales pour la performance sportive, mais également pour la qualité de vie des personnes souffrant de déficiences ou d’altérations de la fonction musculaire. Lorsque l’on parle de « capacité fonctionnelle musculaire », la première chose qui vient en tête est la force. Cependant, cette production de force dépend grandement de la vitesse de contraction et de l’état de fatigue de la fonction neuromusculaire. Dans le contexte de l’exploration fonctionnelle des capacités musculaires humaines, un nouveau cadre théorique Force-Vitesse-Endurance (FoVE) a été développé [1]. Il permet de caractériser de manière plus exhaustive les capacités mécaniques de cet organe. En revanche, sur le modèle murin, la plupart du temps, la qualité de la fonction musculaire est évaluée par des tests de force isométrique sans fatigue [2]. La caractérisation des capacités de force n’est jamais effectuée dans différentes modalités de vitesse et de fatigue. Le modèle FoVE transposé à l’expérimentation animale a pour objectif de permettre une cartographie complète des capacités fonctionnelles du muscle applicable aux études pré-cliniques.
Modèle théorique
En raison de leur structure moléculaire, les fibres musculaires striées squelettiques produisent une force maximale plus faible lorsque la vitesse de raccourcissement est plus élevée [3, 4]. Cette relation est formulée mathématiquement par une fonction homographique force-vitesse F(V), définie par trois paramètres F0, V0 et C (Équation 1; Figure 1A). Chacun de ces paramètres représente une caractéristique différente du muscle.
 |
Figure 1 Modélisation des capacités musculaires. A)Relation force-vitesse F(V) (Équation 1): La force diminue avec la vitesse de contraction du muscle, entre F0 et V0. B) Relation force-temps F(t) (Équation 3): La force diminue au cours du temps lors de contractions répétées et converge vers une intensité non-nulle appelée force critique Fc. |
- F0 représente le plus grand niveau de force que le muscle peut produire.
- V0 représente la plus grande vitesse de raccourcissement du muscle.
- C caractérise la courbure de la relation force-vitesse. Elle influence grandement la capacité de production de puissance maximale. Plus la valeur de cette courbure est importance, moins le muscle est apte à produire de la puissance, et vice versa.
Par ailleurs, la force maximale que peut produire le muscle diminue avec la répétition de contractions ou avec la durée d’exercice, c’est le phénomène de fatigue musculaire.
Lors d’un effort au cours duquel chaque contraction est maximale (all-out), cette relation peut être décrite par une fonction force-temps F(t) (Équation 2; Figure 1B) définie par trois paramètres: Fi, Fc et τ [5]. Chacun de ces paramètres décrit une caractéristique différente du muscle.
- Fi, représente la force que le muscle produit à la première contraction sans fatigue (initiale).
- Fc représente le niveau de force qui peut être maintenu en condition de fatigue musculaire extrême (critique). Cette valeur de force critique est non-nulle.
- τ représente la vitesse à laquelle la fatigue (baisse de force) se développe. Plus ce temps caractéristique est grand, plus le muscle est endurant. À l’inverse, plus τ est petit, plus le muscle perd rapidement en force jusqu’à atteindre la force critique.
Ces deux relations fondamentales, F(V) et F(t), expliquent la diminution de la force, respectivement avec l’augmentation de la vitesse de contraction et/ou avec la durée ou le nombre de contractions répétées dans le temps. Ces deux relations définissent ainsi les capacités de production de force chez un grand nombre d’espèces animales [6]. Chez l’Homme, elles ont été explorées de différentes manières : de la fibre musculaire in vitro [7], en passant par le muscle isolé (e.g. adductor pollicis [8]), aux tâches complexes pluri-articulaires (saut, pédalage, course à pied [9, [10]). La constance de ces observations indique que les relations force-vitesse (F(V)) et intensité-temps (F(t)), ainsi que les mécanismes biomécaniques et physiologiques sous-jacents, sont des caractéristiques clés du muscle strié squelettique (Figure 1).
Ainsi, en combinant les relations F(V) et F(t) (Équations 1 et 2), une relation unique force-vitesse-temps (F(t, V)) peut être développée (Figure 2). En un seul modèle, il est donc possible d’obtenir une cartographie complète des capacités fonctionnelles du muscle. Le niveau de production de force peut être mesuré en considérant les effets combinés de la vitesse et de la fatigue (temps) ainsi que leurs interactions. Cette cartographie permet de déterminer les indices de force maximale (F0i et F0c), de vitesse maximale (V0i et V0c) et de puissance maximale (Pmaxi et Pmaxc), sans et avec fatigue (respectivement indice« i »: initial et« c »: critique).
 |
Figure 2 Modèle FoVE. A) Modèle unique à 7 paramètres et 2 variables: équation de la force maximale produite (F) par le muscle en fonction de la vitesse (V) de contraction et du temps (t). Les paramètres se réfèrent directement aux capacités initiales de force-vitesse sans fatigue et aux capacités critiques du muscle fatigué. B) Relation force-vitesse-temps, F(V, t), représentant les capacités maximales de production de force du muscle en fonction de la vitesse et du temps. Cercle rouge : capacité de force initiale à vitesse nulle sans fatigue, conceptuellement proche de la force maximale isométrique initiale traditionnellement évaluée. C) Relation puissance-vitesse-temps, P(V, t), représentant l’évolution de la puissance maximale au cours du temps lors de contractions maximales répétées. |
Protocole expérimental
Afin d’obtenir les paramètres FoVE de la cartographie force-vitesse-endurance, un court protocole expérimental unique de 3 minutes a été développé sur un ergomètre isocinétique dédié au petit animal (souris) (modèle 1305A, Aurora Scientific®, Dublin, Irlande) (Figure 3A). Ce système permet de mesurer la force générée par le muscle en fonction de différentes vitesses de déplacement imposées (raccourcissement musculaire).
 |
Figure 3 Protocole FoVE. A) Système Aurora Scientific 1305A avec module isocinétique : déplacement (D) isocinétique d’amplitude A=1,5mm et mesure de force (F) pendant la contraction concentrique induite par stimulation électrique (S) (tétanos 100Hz 2mA) du nerf sciatique innervant le muscle (M) tibialis anterior. B) Protocole « all-out sinus » de 180 s avec balayage continu en vitesse imposée (de 2 à 40mm/s, puis de 40 à 2mm/s toutes les 20s). Retour passif à la longueur initiale L0, sans stimulation électrique imposée, en 500ms, à vitesse isocinétique de - 3mm/s. C) Liaison du tibialis anterior par son tendon distal au bras de levier du système Aurora, par un fil rigide. Raccourcissement d’amplitude A du muscle lors de contraction concentrique imposée par stimulation électrique. D) Résultats types : modélisation du protocole FoVE à partir de chaque point noir représentant la force ou la puissance produite lors d’une contraction, en fonction de la vitesse de la contraction concentrique imposée et du temps du protocole. |
L’expérimentation FoVE est réalisée chez la souris sous anesthésie générale gazeuse. Le muscle tibialis anterior (TA) est relié par son tendon distal au module isocinétique de mesure de force (Figure 3C). Les contractions sont induites par des stimulations électriques, transmises par des électrodes crochetant directement le nerf sciatique mis à nu en amont (signal carré monophasique, intensité 2 mA, fréquence 100 Hz). Le module isocinétique est réglé pour un raccourcissement musculaire de 1,5mm (soit ~25 % de la longueur du muscle au repos L0).
Le protocole FoVE consiste à mesurer la force produite par un muscle électro-stimulé en balayant différentes vitesses imposées de contraction (de 2 à 40 mm/s, par pas de 3 mm/s, puis de 40 mm/s à 2 mm/s), sur des cycles de 20 s. La durée totale du protocole est de 180 s (soit 9 cycles de balayage force-vitesse) (Figure 3B). Après chaque contraction, un retour passif sans électro-stimulation est effectué à – 3 mm/s afin de revenir à la position de référence. La force maximale de chaque contraction du protocole FOVE est ainsi mesurée. Le modèle FoVE (fonction F(V,t)) est ensuite ajusté aux données de force sur les 180 s pour déterminer les 7 paramètres du modèle (F0i; F0c; V0i; V0c; Ci; Cc; τ) (Figure 3D).
Résultats
Les données présentées ici sont exprimées en force normalisée à la masse du muscle étudié (N⋅g−1). À titre d’exemple, cette approche a été appliquée à l’étude du dimorphisme sexuel (souris sauvages C57Bl6 âgées de 4 mois : mâles contre femelles, n = 6 par groupe, Figure 4). Le modèle FoVE complet en 3 dimensions (Figure 4E) permet d’obtenir par projection les graphiques en 2 dimensions : force-temps (Figure 4A), vitesse-temps (Figure 4D), et force-vitesse, sans fatigue (Figure 4B) et avec (Figure 4C). Ainsi, il est possible de mettre en évidence une force maximale isométrique normalisée (F0i) plus importante chez les femelles. À l’inverse, la vitesse maximale de contraction était plus grande chez les mâles à la fois au début du protocole (V0i) et en condition de fatigue (F0c).
 |
Figure 4 Résultat tridimensionnel FoVE et projections bidimensionnelles. A) Relation force (isométrique)-temps. B) Relation force-vitesse initiale. C) Relation force-vitesse critique. D) Relation vitesse (maximale)-temps. E) Relation FoVE force-vitesse- |
Conclusion
La force isométrique maximale traditionnellement évaluée ne reflète qu’une des nombreuses capacités de contraction musculaire. L’évaluation FoVE fournit, quant à elle, une cartographie plus complète. Les indices qui en découlent décrivent des caractéristiques de force, de vitesse et d’endurance qui sont gouvernées par des mécanismes biologiques et mécaniques distincts. Ainsi, lorsque l’on cherche à comparer deux groupes (e.g. sexe, phénotype, thérapeutique), il est possible de voir des différences ou non, dans un sens ou dans un autre, en fonction des indices considérés. Par exemple, nous avons vu que les femelles présentaient une force maximale (en N.g-1) plus élevée, alors que ce sont les mâles qui possédaient les capacités de vitesse les plus grandes. Il y a fort à parier que l’approche historique de mesure de force maximale isométrique ait pu passer au travers d’effets importants de telle ou telle thérapeutique en ne regardant pas « au bon endroit ». Un intérêt supplémentaire de l’approche FoVE réside dans son applicabilité chez l’Homme. Ainsi, il est possible, dans le cadre de la recherche translationnelle, d’évaluer les capacités FoVE avec des protocoles sur de petits groupes musculaires (adductor pollicis), des groupes musculaires plus importants (extenseurs de genou) ou sur des tâches locomotrices (pédalage, course).
Financement
Cette étude a été financée par l’Agence nationale de la recherche (ANR) dans le cadre du projet FOVEAL (anr.fr/Projet-ANR-22-CE14-0073).
Prix SFM
Maximilen Bowen a reçu le prix du Meilleur poster lors des journées de la Société française de myologie (SFM) 2023.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Bowen M, Samozino P, Vonderscher M, et al. Mathematical modeling of exercise fatigability in the severe domain: A unifying integrative framework in isokinetic condition. J Theor Biol 2024; 578: 111696. [CrossRef] [PubMed] [Google Scholar]
- Hakim CH, Wasala NB, Duan D. Evaluation of muscle function of the extensor digitorum longus muscle ex vivo and tibialis anterior muscle in situ in mice. J Vis Exp 2013; (72): 50183. [PubMed] [Google Scholar]
- Hill AV. The heat of shortening and the dynamic constants of muscle. Proceedings of the Royal Society of London. Series B-Biological Sciences 1938; 126 (843): 136–195. [Google Scholar]
- Seow CY. Hill’s equation of muscle performance and its hidden insight on molecular mechanisms. J Gen Physiol 2013; 142 (6): 561–73. [CrossRef] [PubMed] [Google Scholar]
- Morton RH. A new modelling approach demonstrating the inability to make up for lost time in endurance running events. IMA J Manag Mathematics 2009; 20 (2): 109–120. [Google Scholar]
- Wilson AM, Hubel TY, Wilshin SD, et al. Biomechanics of predator-prey arms race in lion, zebra, cheetah and impala. Nature 2018; 554 (7691): 183–188. [CrossRef] [PubMed] [Google Scholar]
- Sundberg CW, Hunter SK, Trappe SW, et al. Effects of elevated H + and Pi on the contractile mechanics of skeletal muscle fibres from young and old men: implications for muscle fatigue in humans. J Physiol 2018; 596 (17): 3993–4015. [CrossRef] [PubMed] [Google Scholar]
- De Ruiter CJ, Didden WJM, Jones DA, et al. The force-velocity relationship of human adductor pollicis muscle during stretch and the effects of fatigue. J Physiol 2000; 526 (3): 671–681. [CrossRef] [PubMed] [Google Scholar]
- Cross MR, Brughelli M, Samozino P, et al. Methods of Power-Force-Velocity Profiling During Sprint Running: A Narrative Review. Sports Med 2017; 47 (7): 1255–1269. [CrossRef] [PubMed] [Google Scholar]
- Hughson R, Orok C, Staudt L. A High Velocity Treadmill Running Test to Assess Endurance Running Potential. Int J Sports Med 1984; 5 (1): 23–5. [CrossRef] [Google Scholar]
Liste des figures
 |
Figure 1 Modélisation des capacités musculaires. A)Relation force-vitesse F(V) (Équation 1): La force diminue avec la vitesse de contraction du muscle, entre F0 et V0. B) Relation force-temps F(t) (Équation 3): La force diminue au cours du temps lors de contractions répétées et converge vers une intensité non-nulle appelée force critique Fc. |
| Dans le texte | |
 |
Figure 2 Modèle FoVE. A) Modèle unique à 7 paramètres et 2 variables: équation de la force maximale produite (F) par le muscle en fonction de la vitesse (V) de contraction et du temps (t). Les paramètres se réfèrent directement aux capacités initiales de force-vitesse sans fatigue et aux capacités critiques du muscle fatigué. B) Relation force-vitesse-temps, F(V, t), représentant les capacités maximales de production de force du muscle en fonction de la vitesse et du temps. Cercle rouge : capacité de force initiale à vitesse nulle sans fatigue, conceptuellement proche de la force maximale isométrique initiale traditionnellement évaluée. C) Relation puissance-vitesse-temps, P(V, t), représentant l’évolution de la puissance maximale au cours du temps lors de contractions maximales répétées. |
| Dans le texte | |
 |
Figure 3 Protocole FoVE. A) Système Aurora Scientific 1305A avec module isocinétique : déplacement (D) isocinétique d’amplitude A=1,5mm et mesure de force (F) pendant la contraction concentrique induite par stimulation électrique (S) (tétanos 100Hz 2mA) du nerf sciatique innervant le muscle (M) tibialis anterior. B) Protocole « all-out sinus » de 180 s avec balayage continu en vitesse imposée (de 2 à 40mm/s, puis de 40 à 2mm/s toutes les 20s). Retour passif à la longueur initiale L0, sans stimulation électrique imposée, en 500ms, à vitesse isocinétique de - 3mm/s. C) Liaison du tibialis anterior par son tendon distal au bras de levier du système Aurora, par un fil rigide. Raccourcissement d’amplitude A du muscle lors de contraction concentrique imposée par stimulation électrique. D) Résultats types : modélisation du protocole FoVE à partir de chaque point noir représentant la force ou la puissance produite lors d’une contraction, en fonction de la vitesse de la contraction concentrique imposée et du temps du protocole. |
| Dans le texte | |
 |
Figure 4 Résultat tridimensionnel FoVE et projections bidimensionnelles. A) Relation force (isométrique)-temps. B) Relation force-vitesse initiale. C) Relation force-vitesse critique. D) Relation vitesse (maximale)-temps. E) Relation FoVE force-vitesse- |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.