| Issue |
Med Sci (Paris)
Volume 40, Novembre 2024
Les Cahiers de Myologie
|
|
|---|---|---|
| Page(s) | 26 - 29 | |
| Section | Prix SFM | |
| DOI | https://doi.org/10.1051/medsci/2024131 | |
| Published online | 18 November 2024 | |
Arthrogryposes multiples congénitales à l’âge pédiatrique
Corrélation entre IRM musculaire et évaluation fonctionnelle
Arthrogryposis Multiplex Congenita in pediatric age: Correlation between Muscle MRI and functional assessment
1
Université Grenoble Alpes, Inserm U1209, IAB, CHU Grenoble Alpes, Génétique Médicale, France
2
Département d’Imagerie pédiatrique, CHU Grenoble Alpes, France
3
Médecine physique et réadaptation pédiatrique, CHU Grenoble Alpes, France
4
Centre de référence national des anomalies développementales, clinique multidisciplinaire AMC, CHU Grenoble Alpes, France
Les arthrogryposes multiples congénitales (AMC) regroupent l’ensemble des pathologies avec des limitations articulaires à au moins deux niveaux articulaires distincts, à la naissance. Les limitations articulaires ne sont pas évolutives, mais les conséquences fonctionnelles ont un impact tout au long de la vie des patients. Dans cet article, nous montrerons les résultats de notre étude qui vise à évaluer la corrélation entre l’infiltration graisseuse musculaire en IRM et les déficiences et limitations d’activité chez des enfants présentant une AMC. Notre étude est une des premières à établir le lien entre l’imagerie musculaire et les aspects fonctionnels de l’AMC, en population pédiatrique.
Abstract
Arthrogryposis multiplex congenita (AMC) is a group of diseases with joint limitations at two or more distinct joint levels at birth. Joint limitations are not progressive, but the functional consequences have a lifelong impact on patients. In this article we will present the results of our study aimed at evaluating the correlation between muscle fat infiltration on MRI and activity deficiencies and limitations in children with AMC. Our study is one of the first in a pediatric population to establish the link between muscle imaging and functional aspects of AMC.
© 2024 médecine/sciences – Inserm
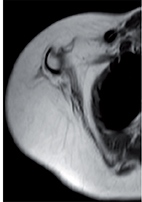
© A. Milot
Vignette : IRM membre supérieur d’un enfant atteint du syndrome de déficience intellectuelle-retard de développement-contractures (syndrome de Wieacker-Wolff).
Définitions et hypothèses
Les arthrogryposes multiples congénitales (AMC) regroupent l’ensemble des pathologies avec des limitations articulaires à au moins deux niveaux articulaires distincts, à la naissance [1]. Leur prévalence est estimée à 1/3 000 à 1/12 000 [2–4] dans le monde. C’est donc une pathologie rare parmi les plus courantes. Les AMC sont communément classées en trois groupes selon les habitudes cliniques [3, 5] : le groupe 1 pour l’amyoplasie, le groupe 2 pour les arthrogryposes distales (AD) et le groupe 3 appelé « autre », qui est un groupe plus hétérogène, regroupant les patients qui ne peuvent pas être classés dans un des groupes précédents.
La précocité et l’importance de la baisse des mouvements fœtaux pendant la grossesse sont les deux principaux facteurs de sévérité des manifestations musculo-squelettiques chez ces enfants à la naissance [6, 8]. Ces facteurs de sévérité influencent la fonction motrice, la marche, l’autonomie dans la vie quotidienne et la participation à la vie sociale [8, 9]. La prise en charge de ces maladies est donc exigeante, nécessairement multidisciplinaire et s’inscrit au long cours.
En plus de l’aspect articulaire, les compétences motrices dépendent également de la quantité et de la qualité du muscle squelettique et de son contrôle. La force musculaire est en effet un facteur prédictif important des capacités fonctionnelles. Ainsi, dans les AMC, et plus spécifiquement dans l’amyoplasie, Kroksmark et al. ont étudié l’impact de la force musculaire et des contractures sur la fonction motrice [9]. Ils ont trouvé des corrélations significatives entre la force musculaire et la fonction motrice, ainsi qu’avec l’amplitude articulaire passive (AA). Par ailleurs, dans de nombreuses myopathies telles que la dystrophie musculaire de Duchenne (DMD) ou la dystrophie fascio-scapulo-humérale (FSHD), il apparaît une involution graisseuse (plus ou moins sévère selon le degré de gravité de la maladie). Cette infiltration graisseuse est corrélée au stade clinique et donc à la sévérité de la maladie, et elle entraine des conséquences fonctionnelles [10, 11]. Plus l’infiltration graisseuse augmente, plus la force musculaire diminue [4] ; une diminution corrélée à la perte de la fonction motrice [12].
Au cours de la dernière décennie, l’IRM musculaire corps entier est devenue la méthode de choix pour évaluer la qualité et la quantité des fibres musculaires de manière non-invasive. Plusieurs études ont ainsi montré que l’IRM est un outil efficace à la fois pour le diagnostic, pour l’évaluation de la progression de la maladie [14, 15] et pour la quantification et la surveillance des effets des traitements [16, 17].
De plus, pour étudier l’infiltration graisseuse et aider à définir les patterns musculaires, Mercuri et al. ont développé un score semi-quantitatif qui mesure l’infiltration fibro-adipeuse des muscles sur IRM [7].
Des corrélations entre l’infiltration fibro-adipeuse et les déficits musculaires ont déjà été étudiées dans des maladies neuromusculaires telles que la maladie de Pompe [19,20] ou la DMD [20]. Ces études ont révélé une bonne corrélation entre l’apparition de la maladie, la force musculaire et le degré d’infiltration fibro-adipeuse musculaire évalué par le score de Mercuri. L’IRM musculaire a pu être utilisée pour suivre la progression de la maladie grâce à cette corrélation avec la fonction musculaire.
La principale différence entre les AMC et les pathologies neuromusculaires étudiées précédemment réside dans le caractère congénital non progressif des premières. Par ailleurs, jusque-là, l’impact des limitations articulaires et de la force musculaire sur la fonction motrice était basé uniquement sur des évaluations cliniques. L’objectif principal de ce projet était donc d’évaluer la corrélation entre l’infiltration fibro-adipeuse musculaire quantifiée sur l’IRM, évaluée par le score Mercuri, et les capacités fonctionnelles des patients pédiatriques atteints d’AMC.
Matériel et méthodes
Nous avons mené une étude observationnelle rétrospective sur une cohorte monocentrique avec un recrutement national, dans un but descriptif et comparatif. Les patients atteints d’AMC admis au centre de référence (CR) français pour les AMC, dans les services de génétique et de rééducation pédiatrique de l’Hôpital Couple Enfants (HCE) à Grenoble, avaient systématiquement bénéficié d’une IRM musculaire corps entier lorsque les conditions et l’âge le permettaient. Notre protocole d’étude a également été enregistré sur le site ClinicalTrial.gov (NCT05393375).
Les données cliniques et paracliniques ont été obtenues à partir des bilans multidisciplinaires qui avaient eu lieu lors des hospitalisations de jour en médecine physique et de réadaptation (MPR) pédiatrique à l’HCE.
Les critères d’inclusion étaient les suivants :
né vivant,
âge < 18 ans lors de la première évaluation clinique et/ou bénéficiant d’un suivi en rééducation pédiatrique au CHU Grenoble-Alpes,
diagnostic clinique, et si possible moléculaire, d’AMC établi,
au moins une évaluation fonctionnelle lors de consultations et de suivi en rééducation pédiatrique au CHU Grenoble-Alpes,
IRM musculaire des membres supérieurs et inférieurs et du tronc.
Le diagramme de flux de notre étude est résumé dans la figure 1.
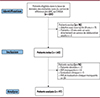 |
Figure 1 Diagramme de flux de l’étude. AMC : arthrogryposes multiples congénitales. CHUGA : CHU Grenoble Alpes |
Pour l’évaluation clinique, nous avons extrait les caractéristiques intrinsèques des patients, ainsi que les antécédents médicaux et chirurgicaux, le statut ambulatoire (marche ou non, âge de la marche) et le statut scolaire (scolarisation ordinaire ou non).
Tous les patients inclus avaient bénéficié d’une évaluation multidisciplinaire systématique par des médecins (généticiens, MPR), des kinésithérapeutes, des ergothérapeutes, et des orthophonistes et des psychologues en fonction des besoins.
Pour l’évaluation du handicap, les déficiences, les limitations d’activité et les restrictions de participation avaient été évaluées selon la classification internationale du fonctionnement, du handicap et de la santé (CIF). Les déficits cliniques avaient été évalués par des kinésithérapeutes formés. Nous nous sommes concentrés sur deux aspects : la faiblesse musculaire et les AA. La faiblesse musculaire avait été évaluée au travers de la fonction musculaire (par exemple, la flexion, l’extension, etc.). En utilisant l’échelle MRC (pour Medical research council), les AA avaient été évaluées pour toutes les articulations principales via l’examen clinique et goniométrique. Les limitations d’activité avaient été évaluées lors du suivi par des ergothérapeutes et des kinésithérapeutes. Les statuts ambulatoires avaient été recueillis par les équipes lors des bilans, ainsi que l’âge d’acquisition de la marche s’il était disponible et l’utilisation ou non d’aides techniques.
La mobilité de la main dans l’espace avait été évaluée par un test ad hoc (reaching score). Les patients devaient toucher successivement certaines cibles corporelles avec les membres supérieurs.
Pour l’IRM, nous avons utilisé des séquences IRM en turbo écho spin pondérées en T1 (T1W-TSE). Nous avons étudié 106 muscles – 53 de chaque côté – du tronc aux membres inférieurs. La mesure de l’infiltration graisseuse a été évaluée lorsqu’au moins deux coupes par muscle étaient visibles. Nous avons utilisé l’échelle visuelle semi-quantitative proposée par Mercuri et al. en 2002. Cette échelle classe les muscles en quatre catégories croissantes, basées sur les séquences IRM en T1. Un score de 1 signifie qu’il n’y a aucune infiltration graisseuse, 2 indique une infiltration légère (<30 %), à 3, elle est modérée (30 à 60 %) et à 4, l’infiltration graisseuse est > 60 %. Lorsque le muscle n’était pas identifiable, nous l’avons classé « non analysable » (NA).
Pour l’analyse finale, nous avons décidé de ne conserver que les muscles avec moins de 20 % du score Mercuri non interprétable. Ces analyses ont été réalisées sur tous les scores Mercuri disponibles pour chacun des muscles des hémicorps gauche et droit. Puis, nous avons analysé des scores moyens pour le membre supérieur, le tronc et le membre inférieur.
Résultats
Nous avons inclus 97 patients ayant été évalués entre 2007 et 2021, parmi lesquels 56 % étaient de sexe féminin.
47 patients étaient classés dans le groupe 1 « amyoplasie » (49 %), 38 dans le groupe 2 « DA » (39 %) et 12 dans le groupe 3 « autre » (12 %). La classification détaillée est présentée dans la figure 2.
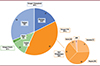 |
Figure 2 Classification des patients atteints d’AMC de la cohorte. Les patients sont classés en trois groupes et les diagnostics sont détaillés pour le groupe 2 (disque orange). La classification a été réalisée en suivant le travail de Le Tanno et al. [3]. JNM : jonction neuromusculaire, AMC : arthrogryposes multiples congénitales, AD : arthrogrypose distale. |
L’âge médian lors de la première évaluation était de 36 mois (allant d’un mois à 19 ans). Le statut ambulatoire était connu pour 90 patients parmi lesquels 78 % (n = 76) étaient marchants (de manière indépendante et stable) et 15 % (n = 14) ne l’étaient pas.
La majorité des patients inclus (n = 78) étaient scolarisés, dont 72 en milieu ordinaire, 4 en institut médicoéducatif (IME) et 2 en ULIS (unité localisée pour l’inclusion scolaire). La quasi-totalité des patients avaient au moins une aide technique et presqu’un tiers avait un fauteuil roulant.
Étude des corrélations
Tous groupes confondus, nous avons trouvé une corrélation de Pearson modérée entre les scores Mercuri et les AA pour les membres supérieurs et inférieurs (respectivement r = – 0,59, p < 0,0001, et r = – 0,64, p < 0,0001). Pour l’amyoplasie et l’AD, nous avons trouvé une corrélation modérée également pour les membres supérieurs et inférieurs (respectivement r = – 0,67, p < 0,0001, r = – 0,59, p < 0,0001, et r = – 0,38, p = 0,003 et r = – 0,65, p < 0,0001). Pour le groupe 3, nous avons trouvé une corrélation forte pour les membres inférieurs uniquement (r = – 0,89, p = 0,0003).
Pour la faiblesse musculaire, tous groupes confondus, nous avons trouvé une corrélation modérée avec les scores Mercuri uniquement pour les membres inférieurs (r = – 0,45, p = 0,001), une corrélation retrouvée également dans l’amyoplasie (r = – 0,49, p = 0,002).
Concernant les limitations d’activité, 42 enfants avaient eu une évaluation de la mobilité de la main dans l’espace. Tous groupes confondus, nous avons trouvé une corrélation modérée entre le reaching score et le score Mercuri pour les membres supérieurs (r = – 0,63, p < 0,0001) et le tronc (r = – 0,63, p = 0,03). Pour l’amyoplasie, nous avons trouvé une corrélation forte entre les deux scores pour les membres supérieurs (r = – 0,73, p = 0,003) et une corrélation modérée pour le tronc (r = – 0,63, p = 0,03). Pour l’AD, nous avons trouvé une corrélation modérée uniquement pour les membres supérieurs (r = – 0,50, p = 0,04).
L’IRM, un outil prédictif de la fonction ?
Dans cette étude observationnelle monocentrique rétrospective, nous avons recueilli les données de 97 patients pédiatriques atteints d’AMC et nous nous sommes concentrés sur leur imagerie musculaire et leurs résultats fonctionnels. À notre connaissance, il s’agit donc de la première étude évaluant la fonction et l’infiltration graisseuse dans l’AMC, dans un cadre pédiatrique.
Il existe des limitations techniques à l’IRM comme des artefacts de mouvement, les coupes hors plan, les écarts de coupe inadéquats. Afin de surmonter ces limitations, nous recommandons des protocoles IRM qui comprennent une analyse systématique du corps entier.
Notre étude a montré que l’IRM musculaire du corps entier, qui est un outil diagnostique et de suivi puissant, pourrait également être une approche efficace et non invasive pour l’évaluation du handicap, le suivi des enfants atteints d’AMC et pour évaluer la réponse à diverses interventions thérapeutiques.
Même si des études complémentaires sont nécessaires pour confirmer cette hypothèse, nos premiers résultats constituent un premier pas vers un modèle prédictif du pronostic fonctionnel des patients afin de mieux adapter leur prise en charge et d’améliorer leurs capacités fonctionnelles.
Prix SFM
Alicia Milot a reçu le prix Interne en médecine lors des journées de la Société française de myologie (SFM) 2023.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Dahan-Oliel N, Cachecho S, Barnes D, et al. International multidisciplinary collaboration toward an annotated definition of arthrogryposis multiplex congenita. Am J Med Genet 2019 ; 181 (3) : 288–99. [CrossRef] [PubMed] [Google Scholar]
- Hoff JM, Loane M, Gilhus NE, et al. Arthrogryposis multiplexa congenita: an epidemiologic study of nearly 9 million births in 24 EUROCAT registers. Eur J Obstet Gynecol Reprod Biol 2011 ; 159 (2) : 347–50. [CrossRef] [PubMed] [Google Scholar]
- Le Tanno P, Latypova X, Rendu J, et al. Diagnostic workup in children with arthrogryposis: description of practices from a single reference center, comparison with literature and suggestion of recommendations. J Med Genet 2021 ; jmedgenet-2021-107823. [PubMed] [Google Scholar]
- Lowry RB, Sibbald B, Bedard T, et al. Prevalence of multiple congenital contractures including arthrogryposis multiplex congenita in Alberta, Canada, and a strategy for classification and coding. Birth Defects Res A Clin Mol Teratol 2010 ; 88 (12) : 1057–61. [CrossRef] [PubMed] [Google Scholar]
- Sells JM, Jaffe KM, Hall JG. Amyoplasia, the Most Common Type of Arthrogryposis: The Potential for Good Outcome. Pediatrics 1996 ; 97 (2) : 225–31. [CrossRef] [PubMed] [Google Scholar]
- Felsenthal N, Zelzer E. Mechanical regulation of musculoskeletal system development. Development 2017 ; 144 (23) : 4271–83. [CrossRef] [PubMed] [Google Scholar]
- Mercuri E, Talim B, Moghadaszadeh B, et al. Clinical and imaging findings in six cases of congenital muscular dystrophy with rigid spine syndrome linked to chromosome 1p (RSMD1). Neuromuscul Disord 2002 ; 12 (7-8) : 631–8. [CrossRef] [PubMed] [Google Scholar]
- Donohoe M, Pruszcynski B, Rogers K, et al. Predicting Ambulatory Function Based on Infantile Lower Extremity Posture Types in Amyoplasia Arthrogryposis. J Pediat Orthop 2019 ; 39 (7) : e5315. [CrossRef] [PubMed] [Google Scholar]
- Kroksmark AK, Kimber E, Jerre R, et al. Muscle involvement and motor function in amyoplasia. Am J Med Genet 2006 ; 140A (16) : 1757–67. [CrossRef] [Google Scholar]
- Gaeta M, Messina S, Mileto A, et al. Muscle fat-fraction and mapping in Duchenne muscular dystrophy: evaluation of disease distribution and correlation with clinical assessments: Preliminary experience. Skeletal Radiol 2012 ; 41 (8) : 955–61. [CrossRef] [PubMed] [Google Scholar]
- Kan HE, Scheenen TWJ, Wohlgemuth M, et al. Quantitative MR imaging of individual muscle involvement in facioscapulohumeral muscular dystrophy. Neuromuscul Disord 2009 ; 19 (5) : 357–62. [CrossRef] [PubMed] [Google Scholar]
- Schlaeger S, Sollmann N, Zoffl A, et al. Quantitative Muscle MRI in Patients with Neuromuscular Diseases—Association of Muscle Proton Density Fat Fraction with Semi-Quantitative Grading of Fatty Infiltration and Muscle Strength at the Thigh Region. Diagnostics 2021 ; 11 (6) : 1056. [CrossRef] [PubMed] [Google Scholar]
- Pollard AS, McGonnell IM, Pitsillides AA. Mechanoadaptation of developing limbs: shaking a leg. J Anat 2014 ; 224 (6) : 615–23. [CrossRef] [PubMed] [Google Scholar]
- Fatehi F, Salort-Campana E, Le Troter A, et al. Long-term follow-up of MRI changes in thigh muscles of patients with Facioscapulohumeral dystrophy: A quantitative study. PLoS ONE 2017 ; 12 (8) : e0183825. [CrossRef] [PubMed] [Google Scholar]
- Janssen BH, Voet NBM, Nabuurs CI, et al. Distinct Disease Phases in Muscles of Facioscapulohumeral Dystrophy Patients Identified by MR Detected Fat Infiltration. PLoS ONE 2014 ; 9 (1) : e85416. [CrossRef] [PubMed] [Google Scholar]
- Fatehi F, Salort-Campana E, Le Troter A, et al. Muscle MRI of facioscapulohumeral dystrophy (FSHD): A growing demand and a promising approach. Rev Neurol (Paris) 2016 ; 172 (10) : 566–71. [CrossRef] [PubMed] [Google Scholar]
- Janssen B, Voet N, Geurts A, et al. Quantitative MRI reveals decelerated fatty infiltration in muscles of active FSHD patients. Neurology 2016 ; 86 (18) : 1700–7. [CrossRef] [PubMed] [Google Scholar]
- Figueroa-Bonaparte S, Segovia S, Llauger J, et al. Muscle MRI Findings in Childhood/Adult Onset Pompe Disease Correlate with Muscle Function. PLoS ONE 2016 ; 11 (10) : e0163493. [CrossRef] [PubMed] [Google Scholar]
- Khan AA, Boggs T, Bowling M, et al. Whole-body magnetic resonance imaging in late-onset Pompe disease: Clinical utility and correlation with functional measures. J Inherit Metab Dis 2020 ; 43 (3) : 549–57. [CrossRef] [PubMed] [Google Scholar]
- Brogna C, Cristiano L, Tartaglione T, et al. Functional levels and MRI patterns of muscle involvement in upper limbs in Duchenne muscular dystrophy. PLoS ONE 2018 ; 13 (6) : e0199222. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1 Diagramme de flux de l’étude. AMC : arthrogryposes multiples congénitales. CHUGA : CHU Grenoble Alpes |
| Dans le texte | |
 |
Figure 2 Classification des patients atteints d’AMC de la cohorte. Les patients sont classés en trois groupes et les diagnostics sont détaillés pour le groupe 2 (disque orange). La classification a été réalisée en suivant le travail de Le Tanno et al. [3]. JNM : jonction neuromusculaire, AMC : arthrogryposes multiples congénitales, AD : arthrogrypose distale. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




