| Issue |
Med Sci (Paris)
Volume 40, Number 8-9, Août-Septembre 2024
|
|
|---|---|---|
| Page(s) | 608 - 612 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024087 | |
| Published online | 20 September 2024 | |
Un rôle des microtubules astraux dans l’orientation de la division cellulaire
Quand la longueur compte… aussi !
A role of astral microtubules in the orientation of cell division: when length counts… too!
1
Université d’Aix-Marseille, CNRS UMR 7288, Institut de biologie du développement de Marseille, Centre Turing des systèmes vivants, Marseille, France
2
Équipe labellisée Fondation ARC
3
Université Paris Cité, CNRS, Institut Jacques Monod, Paris, France
4
Équipe labellisée La ligue contre le cancer
La division cellulaire, ou mitose, est un processus fondamental de la croissance, du développement et de la régénération tissulaire chez les organismes multicellulaires. Dans ce processus, une cellule mère se divise en deux cellules filles génétiquement identiques, chacune contenant un ensemble complet des chromosomes de la cellule mère. La ségrégation du matériel génétique entre les cellules filles repose sur la formation d’un fuseau mitotique, ce qui implique un profond remodelage du cytosquelette, en particulier du réseau de microtubules. Ces polymères de tubuline sont organisés autour d’un centre organisateur : le centrosome. Au cours de la prophase, le centrosome se duplique et donne naissance à deux centrosomes fils, qui vont se localiser chacun à un pôle du fuseau mitotique. Les microtubules kinétochoriens se fixent aux kinétochores1 des chromosomes et les alignent au centre de la cellule avant la séparation. Les microtubules interpolaires, provenant de centrosomes opposés, se chevauchent au centre de la cellule, contribuant ainsi à la séparation des chromosomes et au maintien de la stabilité du fuseau mitotique. Les microtubules astraux, quant à eux, rayonnent à partir des centrosomes vers le cortex cellulaire, et vont jouer un rôle déterminant pour établir l’axe de la division cellulaire [1].
L’axe de la division cellulaire est déterminé par l’orientation du fuseau mitotique, et contribue à la morphogenèse et au maintien de l’intégrité des épithéliums en y définissant la position des futures cellules filles : une orientation du fuseau dans le plan de l’épithélium maintient les cellules filles dans ce plan, tandis qu’une orientation dans un plan perpendiculaire, le long de l’axe apico-basal de la cellule mère, entraîne une stratification épithéliale [2]. Un défaut de positionnement du fuseau mitotique a été corrélé avec différentes situations pathologiques, allant de maladies développementales aux cancers [3]. L’orientation des fuseaux mitotiques est contrôlée par de nombreux signaux internes ou externes de polarité, qui s’ajoutent à la contribution de la géométrie de la cellule mère et des cellules filles. Les résultats de nombreuses études ont montré le rôle majeur d’un complexe protéique conservé au cours de l’évolution, composé des protéines GiD (une sous-unité des protéines G hétérotrimériques), LGN (leucine-glycine-asparagine), et NuMA (nuclear and mitotic apparatus). Durant la mitose, ce complexe moléculaire se localise au cortex cellulaire (i.e., sous la membrane plasmique), et coordonne le recrutement de la dynéine, un moteur moléculaire associé aux microtubules, qui peut se diriger de manière processive vers leurs extrémités dites négatives, situées aux centrosomes. La dynéine, ainsi reliée à la membrane cellulaire et guidée le long des microtubules astraux, exerce des forces de traction sur les extrémités des fuseaux mitotiques, contribuant ainsi à leur positionnement [4]. La découverte de ce complexe moléculaire et de son implication dans l’orientation de l’axe de division cellulaire est issue de nombreux travaux de recherche dans des modèles d’animaux invertébrés (in vivo) et de lignées cellulaires provenant de vertébrés [2]. Ces modèles continuent d’être utilisés pour découvrir de nouveaux régulateurs et comprendre la dynamique de ce processus cellulaire. Toutefois, ils ne reproduisent pas la complexité du contrôle de l’orientation de l’axe de la division cellulaire dans les tissus des vertébrés.
L’épithélium monocouche intestinal des mammifères représente ainsi un modèle de choix pour l’étude de la division cellulaire en raison de sa capacité remarquable à se renouveler constamment dans l’organisme adulte [5]. Il présente une organisation compartimentée stricte, avec des cellules différenciées le long des villosités et des cellules mitotiques localisées dans les cryptes intestinales [6] (Figure 1A, Ba). Cependant, malgré ces avantages, l’étude de l’épithélium intestinal des mammifères in vivo présente des limitations, dues notamment à la dynamique rapide de renouvellement de ce tissu et à son opacité aux rayons lumineux, ainsi qu’aux contraintes des règlementations éthiques concernant l’expérimentation animale. Les cultures primaires d’organoïdes intestinaux constituent donc une alternative prometteuse. Ces structures tridimensionnelles auto-organisées, dérivées de cellules souches, reproduisent bon nombre de caractéristiques de l’épithélium intestinal tout en simplifiant le système d’étude (Figure 1Bb) [7] (→).
(→) Voir la Synthèse de C. Flatres et al., m/s n° 6-7, juin-juillet 2019, page 549
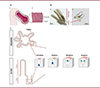 |
Figure 1. Modèle de division cellulaire dans les cryptes intestinales. A. (a) Schéma d’un intestin grêle de souris. (b) Agrandissement de ses deux principales structures : villosité (compartiment différencié) et crypte (compartiment prolifératif). B. (a) Photographie d’une microdissection d’un intestin grêle de souris. (b) Photographie d’un organoïde intestinal obtenu à partir de cellules souches de souris, dont la différenciation a été induite expérimentalement. C. Représentation schématique d’une crypte intestinale et d’un organoïde intestinal de souris, ainsi que d’une cellule de la crypte intestinale avant la mitose (interphase) et lors des premières étapes de la mitose : prophase, métaphase, anaphase. Pendant l’interphase, les cellules sont colonnaires, puis elles se déforment à leur pôle basal au début de la prophase, pour prendre une forme de goutte d’eau inversée en métaphase. En anaphase, les cellules adoptent une forme plus arrondie. L’ADN est représenté en bleu, les microtubules et les centrosomes sont représentés en vert. |
De plus, elles offrent la possibilité d’analyser, avec une haute résolution spatiale et temporelle, la division des cellules à l’échelle cellulaire et moléculaire [8].
Une orientation non conventionnelle de la division cellulaire
En étudiant l’orientation de la division cellulaire dans les cryptes intestinales in vivo dans le tissu de souris adulte, et ex vivo grâce à l’utilisation d’organoïdes, nous avons révélé des mécanismes mitotiques inédits chez les mammifères [9, 10]. À l’aide de techniques d’imagerie fine en temps réel des cryptes d’organoïdes intestinaux, nous avons pu examiner le déroulement des premières étapes de la mitose, de l’interphase à l’anaphase. En prophase, l’ADN de la cellule mitotique migre vers son pôle apical ; la cellule se remodèle et acquiert alors une forme allongée « en goutte d’eau inversée », avec un domaine apical bien développé au détriment du domaine basal (Figure 1C). De façon concomitante, le centrosome déjà dupliqué migre du pôle apical vers l’emplacement de l’ADN au début de la mitose. En prométaphase, les fuseaux mitotiques oscillent pour finir par se stabiliser en métaphase : ils s’alignent alors dans le premier tiers apical de la cellule et orthogonalement à l’axe apico-basal (Figure 1C) [10]. Cette géométrie de division particulière déroge à la règle d’orientation conventionnelle de la division cellulaire selon l’axe le plus long (axe longitudinal), une orientation décrite dans différents modèles d’invertébrés et de lignées de cellules transformées de vertébrés en culture.
Un mécanisme d’orientation mitotique inédit révélé par la modélisation mathématique : le codage de la forme cellulaire par une limitation de la longueur des microtubules astraux
Étonnamment, une cartographie du complexe de polarité mitotique (NuMA et LGN) a révélé une distribution atypique de ces complexes, traditionnellement associés à l’orientation du fuseau mitotique : ils se localisaient non pas, comme attendu, au cortex latéral de la cellule, en face des fuseaux mitotiques, mais au cortex basal, là où s’exercent des tensions corticales et jonctionnelles accrues dans le tissu intestinal [10]. Nous avons développé des modèles mathématiques en deux et trois dimensions afin de prédire l’orientation des fuseaux mitotiques dans les cellules intestinales : sur la base de modèles mécaniques qui calculent les couples forces/orientation en fonction de la distribution des forces générées par les microtubules astraux et l’orientation de la division à l’équilibre, nous avons fixé la forme de la cellule, le positionnement asymétrique des fuseaux mitotiques dans sa région apicale, et la localisation basale des complexes de polarité mitotique conformément à nos constats expérimentaux. Sur la base de ce modèle, deux hypothèses ont été testées en première intention (Figure 2A). Première hypothèse : les microtubules astraux s’expandent dans toute la cellule et exercent des forces dépendant de leurs longueurs. Il en résulterait une orientation de la division cellulaire le long du grand axe de la cellule, c’est-àdire son axe apico-basal.
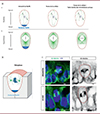 |
Figure 2. Localisation de l’α-tubuline (composant des microtubules) lors de la métaphase. A. (a) Représentation schématique des hypothèses de distribution de la longueur des microtubules astraux et des forces qu’ils exercent dans les trois modèles testés pour prédire l’orientation des fuseaux mitotiques. (b) Profils d’énergie potentielle de rotation, tracés en fonction des angles d’orientation des fuseaux par rapport à l’axe planaire prédit par les trois modèles différents. Le point noir marque l’orientation préférentielle des fuseaux au minimum des profils de potentiel. B. Schéma d’une cellule intestinale en métaphase. L’ADN (en bleu foncé) est organisé en plaque métaphasique au centre de la cellule, les microtubules et les centrosomes (en vert) sont de part et d’autre de l’ADN. La protéine mitotique NuMA (en bleu turquoise) est plus abondante au pôle basal de la cellule. C. Analyse de la distribution de l’D-tubuline et des noyaux cellulaires au cours de la métaphase dans un organoïde intestinal ex vivo et dans une crypte intestinale chez la souris in vivo, par microscopie confocale. Les cellules ont été immuno-marquées pour détecter l’D-tubuline (en vert), et les noyaux ont été révélés par coloration au DAPI (en bleu). |
Seconde hypothèse : les forces exercées par les microtubules astraux sont proportionnelles à la concentration de la protéine NuMA. La prédiction est alors que les fuseaux mitotiques s’orienteraient pour faire face aux domaines basaux ou est exprimé NuMA, c’est-à-dire, dans cette hypothèse également, le long de l’axe apico-basal de la cellule [10].
Le résultat de la prédiction dans les modèles mathématiques avec les deux hypothèses précédentes suggérait que l’orientation constatée du fuseau mitotique ne pouvait pas uniquement dépendre des complexes de polarité canoniques ou de la forme de la cellule dans le tissu intestinal. La croissance et la longueur des microtubules astraux au cours de la mitose étant généralement limitées par des instabilités dynamiques, nous avons donc testé un modèle fondé sur une limitation de leurs longueurs. Une telle limitation pourrait empêcher les microtubules astraux d’atteindre le domaine basal des cellules mitotiques allongées. Ainsi, une troisième hypothèse a été testée : les microtubules astraux présenteraient une taille limitée, et exerceraient des forces dépendantes de leurs longueurs, ce qui produirait alors, d’après la prédiction, une orientation du fuseau mitotique orthogonale à l’axe apico-basal de la cellule (Figure 2A) [10]. Ce résultat suggère qu’un mécanisme de détection de la forme de la cellule, influencé par une limite de la longueur des microtubules astraux, pourrait en principe participer à la géométrie de la métaphase dans les cellules de l’épithélium intestinal : les microtubules astraux « sonderaient » alors partiellement la cellule mitotique, et orienteraient les fuseaux mitotiques dans l’axe long du volume du domaine cellulaire apical.
Tester expérimentalement les résultats du modèle mathématique
Cette hypothèse a été validée expérimentalement, d’abord en établissant la cartographie des microtubules astraux après expansion des organoïdes intestinaux. Cette analyse a en effet révélé l’existence d’interactions des microtubules astraux avec les cortex cellulaires apicaux et latéraux, mais très rarement avec le cortex basal (Figures 2B, C). De plus, des expériences de dissection au laser des microtubules astraux dans les cellules vivantes ont montré un retrait significatif du fuseau mitotique par rapport aux coupures lorsqu’elles étaient effectuées dans le domaine apical ou latéral, témoignant de l’existence de forces de traction exercées auparavant par les microtubules lésés. En revanche, la lésion des microtubules du domaine basal a provoqué des retraits du fuseau mitotique bien moindres [10]. Ces résultats confirment l’asymétrie des interactions entre les microtubules astraux et le cortex cellulaire le long de l’axe apico-basal, et montrent la très faible contribution des complexes de polarité situés dans la région basale de la cellule en comparaison avec les forces qu’exercent les microtubules astraux sur le fuseau mitotique. Enfin, afin d’évaluer le rôle du contrôle de la longueur des microtubules astraux dans l’orientation du fuseau mitotique, une kinésine impliquée dans la limitation de la longueur des microtubules, Kif18B (kinesin family member 18b) [11, 12], a été inactivée dans les organoïdes : l’allongement des microtubules astraux jusqu’au cortex basal, que cette inactivation a provoqué, a perturbé l’orientation planaire du fuseau mitotique, démontrant ainsi l’importance de la limitation de la longueur des microtubules astraux basaux pour la géométrie de la division cellulaire dans ce modèle tissulaire. De plus, l’inactivation de Kif18b, en affectant l’orientation des divisions cellulaires, a induit des défauts majeurs d’organisation de la monocouche épithéliale, ce qui témoigne de l’importance des divisions planaires pour la morphogenèse des cryptes intestinales [10].
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
La microscopie confocale a été réalisée à la plateforme d’imagerie PICSL (IBDM, Marseille). Ce travail a bénéficié des financements provenant de la Fondation Groupama (Prix de recherche sur les maladies rares 2017), la Fondation ARC (Programmes labellisés PGA), la Ligue contre le cancer (EL2021.LNCC), le Human frontier science program (RGP0038/2018), l’ANR-20-CE13-0015, l’ANR-19-CE13-0014-01, la Fondation Bettencourt Schueller (Prix « Coup d’élan »), le LabEx Who Am I? (ANR-11-LABX-0071) et l’Université de Paris IdEx (ANR-18-IDEX-0001) financés par le gouvernement français au travers du programme Investments for the future, et l’INCA PLBIO20-150 – Cancéropole Île-de-France.
Références
- Glotzer M. The 3Ms of central spindle assembly: microtubules, motors and MAPs. Nat Rev Mol Cell Biol 2009 ; 10 : 9–20. [CrossRef] [PubMed] [Google Scholar]
- Morin X, Bellaïche Y. Mitotic spindle orientation in asymmetric and symmetric cell divisions during animal development. Dev Cell 2011 ; 21 : 102–19. [CrossRef] [PubMed] [Google Scholar]
- Bergstralh DT, St Johnston D. Spindle orientation: What if it goes wrong ? Semin Cell Dev Biol 2014 ; 34 : 140–5. [CrossRef] [PubMed] [Google Scholar]
- Zheng Z, Wan Q, Liu J, et al. Evidence for dynein and astral microtubule-mediated cortical release and transport of GDi/LGN/NuMA complex in mitotic cells. Mol Biol Cell 2013 ; 27 : 901–13. [CrossRef] [PubMed] [Google Scholar]
- Barker N. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration. Nat Rev Mol Cell Biol 2014 ; 15 h 19–33. [CrossRef] [PubMed] [Google Scholar]
- Guevara-Garcia A, Soleilhac M, Minc N, et al. Regulation and functions of cell division in the intestinal tissue. Semin Cell Dev Biol 2023 ; 150-1 : 3–14. [CrossRef] [PubMed] [Google Scholar]
- Flatres C, Loffet E, Neunlist M, Mahé MM. Façonner l’intestin à partir des cellules souches pluripotentes humaines. Med Sci (Paris) 2019 ; 35 : 549–55. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Fatehullah A, Tan SH, Barker N. Organoids as an in vitro model of human development and disease. Nat Cell Biol 2016 ; 18 : 246–54. [CrossRef] [PubMed] [Google Scholar]
- Steinway SN, Saleh J, Koo BK, et al. Human microphysiological models of intestinal tissue and gut microbiome. Front Bioeng Biotechnol 2020 ; 8 : 275. [CrossRef] [PubMed] [Google Scholar]
- Saleh J, Fardin M-A, Barai A, et al. Length limitation of astral microtubules orients cell divisions in murine intestinal crypts. Dev Cell 2023 ; 58 : 1519–33. [CrossRef] [PubMed] [Google Scholar]
- Stout JR, Yount AL, Powers J A, et al. Kif18B interacts with EB1 and controls astral microtubule length during mitosis. Mol Biol Cell 2011 ; 22 h 17. [PubMed] [Google Scholar]
- McHugh T, Gluszek AA, Welburn JPI. Microtubule end tethering of a processive kinesin-8 motor Kif18b is required for spindle positioning. J Cell Biol 2018 ; 217 : 2403–16. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Modèle de division cellulaire dans les cryptes intestinales. A. (a) Schéma d’un intestin grêle de souris. (b) Agrandissement de ses deux principales structures : villosité (compartiment différencié) et crypte (compartiment prolifératif). B. (a) Photographie d’une microdissection d’un intestin grêle de souris. (b) Photographie d’un organoïde intestinal obtenu à partir de cellules souches de souris, dont la différenciation a été induite expérimentalement. C. Représentation schématique d’une crypte intestinale et d’un organoïde intestinal de souris, ainsi que d’une cellule de la crypte intestinale avant la mitose (interphase) et lors des premières étapes de la mitose : prophase, métaphase, anaphase. Pendant l’interphase, les cellules sont colonnaires, puis elles se déforment à leur pôle basal au début de la prophase, pour prendre une forme de goutte d’eau inversée en métaphase. En anaphase, les cellules adoptent une forme plus arrondie. L’ADN est représenté en bleu, les microtubules et les centrosomes sont représentés en vert. |
| Dans le texte | |
 |
Figure 2. Localisation de l’α-tubuline (composant des microtubules) lors de la métaphase. A. (a) Représentation schématique des hypothèses de distribution de la longueur des microtubules astraux et des forces qu’ils exercent dans les trois modèles testés pour prédire l’orientation des fuseaux mitotiques. (b) Profils d’énergie potentielle de rotation, tracés en fonction des angles d’orientation des fuseaux par rapport à l’axe planaire prédit par les trois modèles différents. Le point noir marque l’orientation préférentielle des fuseaux au minimum des profils de potentiel. B. Schéma d’une cellule intestinale en métaphase. L’ADN (en bleu foncé) est organisé en plaque métaphasique au centre de la cellule, les microtubules et les centrosomes (en vert) sont de part et d’autre de l’ADN. La protéine mitotique NuMA (en bleu turquoise) est plus abondante au pôle basal de la cellule. C. Analyse de la distribution de l’D-tubuline et des noyaux cellulaires au cours de la métaphase dans un organoïde intestinal ex vivo et dans une crypte intestinale chez la souris in vivo, par microscopie confocale. Les cellules ont été immuno-marquées pour détecter l’D-tubuline (en vert), et les noyaux ont été révélés par coloration au DAPI (en bleu). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




