| Issue |
Med Sci (Paris)
Volume 40, Number 6-7, Juin-Juillet 2024
|
|
|---|---|---|
| Page(s) | 525 - 533 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024079 | |
| Published online | 08 July 2024 | |
« ReNAissance »1 des biothérapies par ARN
« ReNAissance » of biotherapies with RNA
1
Nantes Université, Université d’Angers, Immunology and New Concepts in Immunotherapy (INCIT), Inserm UMR-S 1302, CNRS EMR6001, Nantes, France
2
In-Cell-Art, Nantes, France
Nombre de maladies ont pour origine une absence d’expression ou une expression défectueuse d’une protéine donnée. Pour certaines d’entre elles, la protéine faisant défaut est circulante et peut être captée par les cellules lorsqu’elle est délivrée de façon exogène. Dans ce cas, les thérapies ont d’abord consisté en l’administration de la protéine thérapeutique extraite de tissus humains. Par la suite, le génie génétique a permis la production des protéines par fermentation de cellules après y avoir introduit le gène correspondant. Pour beaucoup d’autres maladies, la protéine faisant défaut ne peut être délivrée de façon exogène. Une production endogène de la protéine thérapeutique, par les cellules elles-mêmes est donc nécessaire. La technologie de l’ARN messager (ARNm), comme celle la précédant de l’ADN, se propose de supplémenter, au cœur des cellules, l’information génétique nécessaire pour produire elles-mêmes la protéine thérapeutique. Cependant, contrairement aux thérapies utilisant l’ADN, le transfert d’ARNm permet une expression transitoire de la protéine d’intérêt ce qui constitue un avantage dans nombre de maladies. La maîtrise de la quantité, de la qualité et de la régulation spatio-temporelle de la production d’une protéine codée par l’ARNm thérapeutique représente, néanmoins, un défi important pour le développement de cette approche.
Abstract
Many diseases originate from either the absence or defective expression of a given protein. For some of them, the lacking protein is secreted or can be taken up by cells when delivered exogenously. In such cases, therapies initially involved administering the physiological protein extracted from human tissues. Subsequently, genetic engineering enabled the production of proteins through cell fermentation after introducing the corresponding gene. For many other pathologies, the deficient protein cannot be delivered exogenously. Thus, an endogenous production of the therapeutic protein by the cells themselves is necessary. Messenger RNA (mRNA) technology, like its predecessor DNA, aims to supplement the genetic information needed to produce the therapeutic protein within the cells. However, unlike DNA-based therapies, mRNA transfer allows for transient expression of the protein of interest, which offers an advantage in numerous pathologies. Nonetheless, mastering the quantity, quality, and spatio-temporal regulation of protein production encoded by therapeutic mRNA remains a significant challenge for the development of this approach.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Héloïse Bonnal).
Depuis les années 1990, les protéines thérapeutiques sont majoritairement produites en utilisant la technologie dite de « protéine recombinante », qui consiste à les faire produire par des bactéries, des levures ou des cellules de mammifères, après y avoir introduit le gène les codant. L’utilisation d’ARN messager (ARNm) offre désormais une nouvelle opportunité thérapeutique. En effet, la thérapie par ARNm permet d’envisager des applications pour de nombreuses maladies pour lesquelles l’approche par protéine recombinante n’est pas envisageable. Cette nouvelle approche thérapeutique est donc porteuse d’espoir non seulement pour les patients concernés par ces maladies mais aussi pour l’industrie pharmaceutique, puisqu’elle permet de réduire considérablement le temps requis pour la production de protéines thérapeutiques. Des études précliniques utilisant de l’ARNm thérapeutique ont démontré leur faisabilité dans certaines indications. Cependant, à ce jour, aucun essai clinique de phase III n’a fourni de résultat positif. Comparée à la technologie dite de « protéine recombinante », la thérapie par ARNm présente de nombreux avantages. En théorie, toute protéine peut en effet être fabriquée à partir d’un ARNm. De plus, la fabrication de l’ARNm est rapide et elle est réalisée in vitro, évitant ainsi l’utilisation d’une culture cellulaire, comme c’est le cas pour la production des protéines recombinantes, qui doivent être ensuite purifiées à un niveau compatible avec une utilisation en clinique. Une molécule d’ARNm peut être conçue, produite et optimisée très rapidement, en seulement quelques semaines, ce qui permet d’économiser un temps précieux ainsi que des ressources en recherche et développement. Ce dernier point est particulièrement important dans le contexte du développement rapide de thérapies contre des maladies acquises, comme les maladies infectieuses par exemple. Alors qu’une grande majorité des protéines endogènes ne sont pas éligibles à devenir des candidats-médicaments (seule une centaine de produits biologiques ont été approuvés), des ARNm peuvent être, a priori, produits à partir de tous les gènes du génome humain. Des plates-formes technologiques d’ARNm sont ainsi proposées comme une approche innovante pour produire une nouvelle classe de produits biologiques pour traiter des maladies héréditaires ou acquises. Cependant, tout le potentiel de cette nouvelle modalité thérapeutique ne pourra être atteint qu’avec le développement de systèmes de délivrance capables d’acheminer de façon efficace l’ARNm à l’intérieur des cellules cibles. Bien que l’ARNm soit environ 5 fois plus petit qu’un ADN véhiculé par un plasmide ou un vecteur d’origine viral, qui pourrait également être utilisé, des formulations particulières sont nécessaires pour le transporter jusqu’au cytosol des cellules où il sera traduit en protéine [1] (→).
(→) Voir la Nouvelle de B. Pitard, m/s n° 10, octobre 2019, page 749
Les plates-formes technologiques d’ARNm pourraient être utilisées pour des applications thérapeutiques plus larges que celles qui ont été développées jusqu’à présent, en particulier dans le cas des vaccins à ARNm contre la Covid-19 (coronavirus disease 2019) avec le Tozinameran (Pfizer-BioNTech) et l’Elasomeran (Moderna). Cependant, contrairement à ce qui est recherché pour les vaccins à ARNm, pour de telles applications thérapeutiques, une forte expression protéique est requise. En effet, comparée à la dose d’ARNm vaccinal utilisée dans les études précliniques et cliniques (environ 0,001 mg d’ARNm/kg), la dose nécessaire d’ARNm pour la production d’une protéine à un niveau thérapeutique devrait être 100 à 1 000 fois supérieure (soit 0,1 à 1 mg d’ARNm/kg) [2]. Pour autant, aucune réponse immunitaire ne doit être engendrée. Il est donc indispensable que ces molécules d’ARNm ne soient pas détectées par les récepteurs de l’immunité innée. La réponse immunitaire qui serait alors produite pourrait en effet être à l’origine d’une réponse adaptative vis-à-vis de la protéine thérapeutique, annulant l’effet biologique escompté et susceptible de déclencher, dans le cas de protéines du soi, une réaction auto-immune. La vectorisation des ARNm thérapeutiques constitue ainsi, dans le cadre de ces nouvelles applications, un défi qui reste difficile à relever. Nous aborderons dans cette revue les différentes stratégies de vectorisation envisagées, leurs conséquences sur la stimulation de l’immunité innée et l’inflammation ainsi que les modalités d’injection et les applications cliniques potentielles.
Le développement de l’ARNm thérapeutique est un chemin semé d’obstacles (délivrance précise/localisation d’expression, chaîne d’approvisionnement et stockage, défis spécifiques à la maladie, expression de nouvelles protéines ou de protéines complexes, etc.), qui devront être contournés pour pouvoir exploiter le potentiel thérapeutique de l’ARNm.
Les molécules d’ARNm thérapeutique
Comme l’ARNm vaccinal, la molécule d’ARNm thérapeutique est constituée de cinq éléments structuraux : une coiffe à son extrémité 5’, telle que la 7-méthylguanine (ou des analogues artificiels : ARCA [anti-reverse cap analog] ou CleanCap®) ; une queue poly (A) comportant d’une centaine de ribonucléotides adénosine (A) à son extrémité 3’ ; et, entre les deux, la séquence nucléotidique codant la protéine thérapeutique, encadrée aux extrémités 5’ et 3’ par des séquences non traduites (UTR pour untranslated regions), [3]. La coiffe est nécessaire au recrutement des ribosomes, les UTR permettent d’augmenter la synthèse protéique, et la queue poly (A) confère à la molécule d’ARNm sa stabilité. Cette molécule est produite industriellement par transcription in vitro, utilisant une ARN polymérase recombinante et un plasmide linéarisé servant de matrice pour la transcription de l’ARNm. L’ARNm ainsi produit est purifié et sera traduit directement en protéine par la machinerie des ribosomes, une fois dans le cytosol de la cellule cible.
Les molécules d’ARNm sont fragiles, facilement dégradées, et possèdent une taille quasiment identique à la taille de la cellule cible dans laquelle elles doivent pénétrer. Les ARNm sont chargés négativement, comme toutes les molécules d’acides nucléiques mais aussi comme l’environnement entourant les cellules in vivo constitué par des matrices extracellulaires. Ces caractéristiques de taille et de charge, qui sont à l’origine de forces de répulsion électrostatique entre l’ARNm et l’environnement cellulaire, constituent des obstacles importants au transfert de l’ARN dans les cellules.
Les vecteurs lipidiques
Depuis les années 1990 [4], de nombreux travaux ont été entrepris afin de réduire la taille et d’inverser la charge des molécules d’ARNm pour les rendre compatibles avec une internalisation cellulaire. Le mécanisme de la condensation naturelle des molécules d’acides nucléiques dans les noyaux cellulaires ou dans les têtes de spermatozoïdes, puis la détermination de la composition lipidique des membranes des cellules à traverser, ont guidé les synthèses des premiers vecteurs synthétiques. Ces vecteurs étaient conçus selon le prototype d’une molécule lipidique synthétique chargée positivement, pour condenser l’ARNm chargé négativement, reliée à des chaînes d’acides gras ou de cholestérol, pour pouvoir se mélanger avec les lipides de la membrane de la cellule cible. Ces vecteurs ont été dénommés vecteurs lipidiques chargés positivement ou lipides cationiques ou encore ionisables.
Les lipides cationiques, comme par exemple les lipopolyamines, ont été développés initialement pour la transfection d’ADN [5,6] (Figure 1). Ils ont été ensuite utilisés pour la transfection d’ARN interférents (ou siARN pour short interfering RNA) pour inhiber l’expression d’un gène avec, comme vecteur, le lipide ionisable DLin-DMA (1,2-dilinéoleyloxy-N, N-diméthyl-3-amniporomane). Ce lipide a été ensuite optimisé pour donner naissance au DLin-MC3-DMA (Figure 1), le composé clef de la vectorisation in vivo de siARN dans le foie pour le traitement de l’amylose héréditaire à transthyrétine, avec l’Onpattro® [7]. En 2018, ce médicament a été le premier approuvé par la FDA (Food and Drug Administration) aux États-Unis. Des versions améliorées du lipide ont ensuite été synthétisées pour la vectorisation spécifique de molécules d’ARNm environ 30 fois plus grandes que les siARN. Les lipides ALC-0315 et le SM-102 (Figure 1) ont ainsi été utilisés pour la préparation des vaccins contre la Covid-19 pour complexer, respectivement, 30 et 100 µg d’ARNm codant la protéine S (spike) du SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2). D’autres lipides ionisables, de structure chimique différente, utilisant comme partie chargée positivement des molécules naturelles d’aminosucres2, ont été synthétisés pour le transport intracellulaire d’ARN [8–10]. Un représentant de cette famille de lipides, dénommé CHOLK (Figure 1), a démontré son efficacité pour la vectorisation d’ARNm dans le muscle squelettique [11,12]. Chez le primate, ce lipide permet en outre une biodistribution étendue de l’ARNm à partir du site d’injection [13].
 |
Figure 1. Structures chimiques de lipides ionisables et de lipides neutres. A. les lipides ionisables pour la vectorisation d’acides nucléiques incluant le RPR120535, le DLin-MC3-DMA, le SM-102 et l’ALC-035, utilisés sous forme de nanoparticules lipidiques (LNP), respectivement dans le premier médicament (Onpattro®) approuvé par la FDA (Food and Drug Administration) pour le transport de siARN, et dans les premiers vaccins à ARNm Elasomeran et Tozinamera. Le CHOLK est un lipide ionisable dérivé d’un aminosucre naturel couplé à du cholestérol, utilisé sans association avec des lipides neutres. B. Lipides neutres utilisés pour former les LNP incluant le lipide-PEG (ALC-00159), le DSPC (distearoyl phosphatidyl choline) et le cholestérol, généralement au ratio molaire: 35, 16, 46,5, 2,5M/M. |
Dans un environnement dont le pH est acide, les lipides ionisables sont chargés positivement mais ils sont neutres au pH physiologique. Ainsi, pour favoriser les interactions électrostatiques entre les charges positives du lipide et celles négatives de l’ARNm, l’association des lipides ionisables avec l’ARNm sera réalisée à pH acide. La neutralité du lipide ionisable, au pH physiologique, sera obtenue lorsqu’il sera injecté dans l’organisme. Neutre, il n’interagira pas avec les composés anioniques des membranes des cellules ou présents dans la matrice extracellulaire avec, pour conséquence, l’augmentation de la biodistribution au niveau systémique ou tissulaire et de la biocomptatibilité du complexe lipidique.
Après son endocytose (non spécifique ou spécifique via un récepteur) dans la cellule cible, le complexe sera pris en charge par les endosomes dont le pH est acide. Les lipides ionisables se chargeront donc positivement ce qui facilitera leur interaction avec la phosphatidylsérine, un lipide chargé négativement présent naturellement dans le feuillet interne de la membrane des endosomes. Le déplacement du lipide ionisable, initialement cationique, en interaction avec les charges négatives de l’ARNm, vers les charges négatives de la phosphatidylsérine, provoque alors la déstabilisation de la membrane des endosomes. Ce processus, observé également avec d’autres acides nucléiques comme l’ADN [14], entraîne une rupture de la membrane endosomale, créant des passages vers le cytoplasme pour les molécules d’ARNm alors débarrassées de leurs lipides. Cette étape est indispensable à la libération des molécules d’ARNm dans le cytoplasme et leur prise en charge par les ribosomes pour la traduction de la protéine d’intérêt qu’elles codent.
Une évolution de ces vecteurs lipidiques a été la mise au point de nanoparticules lipidiques (LNP, pour lipidic nanoparticles) qui consistent en l’association de lipides ionisables avec des lipides neutres non chargés [15]. Ces lipides neutres, majoritairement des phospholipides, comme la phosphatidylcholine ou la phosphatdyléthanolamine, du cholestérol ou des lipides fonctionnalisés avec des molécules de polyéthylène glycol (PEG) (Figure 1), améliorent les propriétés de stabilité, d’efficacité de délivrance, de tolérance et de biodistribution des nanoparticules.
Les phospholipides ont tendance à adopter une structure en phase hexagonale inversée3. Cette structure est un élément supplémentaire de déstabilisation des membranes des endosomes. Elle facilite donc la sortie des ARNm vers le cytoplasme de la cellule. Le cholestérol, quant à lui, contribue à la stabilité des particules, en modulant la rigidité et l’intégrité des membranes lipidiques composant les nanoparticules. Le lipide couplé au PEG présente de multiples propriétés ayant des effets sur les caractéristiques des nanoparticules. En effet, la quantité de lipides-PEG peut affecter la taille et la charge des particules ; les lipides-PEG contribuent également à la stabilisation des particules en créant une répulsion stérique empêchant les particules de s’agréger entre elles ; enfin, les lipides-PEG peuvent être utilisés pour assurer un ciblage cellulaire particulier après leur avoir greffé chimiquement un ligand spécifique à leur extrémité.
La formulation des molécules d’ARNm avec le mélange de ces quatre lipides s’effectue selon un rapport molaire très précis (lipide ionisable/phospholipide/cholestérol/lipide-PEG : 35/16/46,5/2,5) en utilisant un procédé de mélange par microfluidique de deux solutions : une solution aqueuse contenant les ARNm et une solution contenant les lipides dissous dans l’éthanol. Avant d’être utilisées, les nanoparticules ainsi produites subissent ensuite différentes opérations consistant en l’échange de solvant, leur concentration, leur stérilisation, et finalement, leur caractérisation.
Les nanoparticules, en l’absence même de molécules d’ARNm, possèdent des propriétés adjuvantes. Le lipide ionisable est le composant critique pour cet effet adjuvant. In vivo, il induit en effet la production de plusieurs chimiokines et cytokines (telles que l’IL[interleukine]-6) par les cellules immunitaires qu’il stimule [16–18]. Cette réponse inflammatoire peut être à l’origine d’effets secondaires allant de simples réactions locales au site d’injection à des manifestations plus importantes comme l’inflammation du myocarde [19].
Les vecteurs polymériques
L’étape d’endocytose des nanoparticules lipidiques constitue une étape limitante pour la délivrance des molécules d’ARNm dans le cytoplasme cellulaire pour y être traduites en protéine thérapeutique. Afin de s’affranchir de cette étape et d’augmenter l’efficacité des ARNm, une classe de vecteurs constituée de blocs copolymères de structure chimique très différente a été développée. Ces vecteurs sont constitués de molécules amphiphiles4 reliées entre elles par une molécule chargée positivement ( Figure 2A ). Ils ont été initialement utilisés pour la vectorisation d’ADN in vivo [20]. Des molécules aux propriétés physicochimiques très variées peuvent être obtenues, selon la longueur et la nature chimique des segments hydrophobes et hydrophiles. Les vecteurs plus hydrophobes seront les plus affins pour les membranes cellulaires. Les vecteurs plus hydrophiles seront en revanche solubles dans l’environnement extracellulaire. Les propriétés physicochimiques optimales pour la délivrance de molécules d’ARNm dans différents tissus ont été ainsi définies, pour le tissu musculaire squelettique [21], le tissu cardiaque ou le tissu pulmonaire.
 |
Figure 2. Vectorisation d’ARNm thérapeutique utilisant des blocs copolymères. A. Structure chimique de la famille des blocs copolymères tétrafonctionnalisés ionisables. Les blocs hydrophiles (en bleu) et les blocs hydrophobes (en gris) sont reliés entre eux par une molécule centrale chargée positivement. Différentes propriétés physico chimiques peuvent être créées en variant la nature chimique des blocs et de la partie centrale. B. Représentation schématique illustrant l’organisation supramoléculaire d’une molécule d’ARNm en interaction avec les molécules de blocs copolymères, par forces électrostatiques entre les résidus phosphates des nucléotides chargés négativement et les charges positives de la partie centrale. Les blocs hydrophobes s’associant entre eux pour minimiser leur interaction avec l’eau. Dans un but de simplification un seul bloc hydrophile et hydrophobe par molécule est représenté. C. Représentation schématique illustrant le mécanisme de franchissement membranaire de la formulation bloc copolymère/ARNm. L’organisation supramoléculaire particulière va permettre un mécanisme d’internalisation direct dans le cytoplasme des cellules, contrairement aux structures globulaires d’une centaine de nanomètres des nanoparticules qui conduit à une internalisation par endocytose. Le masquage des charges négatives de l’ARNm par les blocs copolymères empêche les répulsions électrostatiques entre l’ARN et l’environnement cellulaire également chargé négativement. L’effet de déshydratation de la surface de la cellule par les blocs hydrophiles entraîne une déformation et une ouverture de la membrane pour la pénétration de la chaîne d’ARNm. Ensuite, les blocs hydrophobes à l’intérieur de la membrane vont créer des espaces pour l’ARNm. Puis, du côté interne de la membrane, les blocs hydrophiles avec leur forte affinité pour les environnements aqueux vont entraîner l‘ARN vers l’intérieur de la cellule (© Héloïse Bonnal). |
La formulation de ces vecteurs est plus aisée que celle des nanoparticules : elle repose uniquement sur un mélange auto-associant, sans mélangeur microfluidique, de la solution aqueuse contenant les ARNm et de la solution contenant les blocs copolymères. L’organisation supramoléculaire de cette formulation est très différente de celle des nanoparticules, avec les molécules de blocs copolymères dispersées le long de la chaîne d’ARNm, en interaction électrostatique avec les charges négatives des bases nucléotidiques (Figure 2B). La neutralisation des charges négatives des nucléotides permet ainsi aux molécules d’ARN d’entrer en contact avec la membrane des cellules cibles, en évitant les forces de répulsion électrostatique. Les longues chaînes hydrophiles des blocs copolymères provoqueront la déshydratation locale de la membrane plasmique, permettant à l’ARNm de la traverser. Contrairement aux ARNm contenus dans les nanoparticules qui sont internalisés dans la cellule par endocytose, l’ARNm en interaction avec les blocs copolymères pénètre par un mécanisme de diffusion passive au travers de la membrane cellulaire (Figure 2C). Les molécules d’ARNm sont donc acheminées directement dans le cytosol (sans étape vésiculaire) et sont immédiatement disponibles pour la traduction en protéine, comme ce qui a été observé avec les molécules d’ADN [22, 23].
Minimiser la réaction inflammatoire
La présence d’ARN exogène, en particulier viral, au sein de la cellule est détectée par des senseurs cytosoliques ou membranaires dédiés, à l’origine d’une cascade de signalisation conduisant à une réponse immunitaire innée avec la production d’interféron (IFN) de type I (chez l’homme, IFN-α, IFN-β et IFN-ω) et de cytokines pro-inflammatoires. La RNAse L intracellulaire est également activée afin de dégrader les ARN simple brin présents dans le cytosol, et le facteur d’initiation de la traduction eIF2a, suite à sa phosphorylation, est inactivé. Différents senseurs participent à la défense de la cellule contre les ARN viraux [24] (Figure 3) : des récepteurs endosomaux de type PRR (pathogen recognition receptor), tels que le TLR7 (Toll like receptor 7) qui reconnaît l’uridine de la molécule d’ARN ; des senseurs cytosoliques, MAD5 (melanoma differentiation-associated gene 5) et LGP2 (laboratory of genetics and physiology 2) qui reconnaissent les ARN double brins ; NOD 2 (nucleotide-binding oligomerization domain 2) qui reconnaît les ARN simple brin ; RIG-I (retinoic acid-inducible gene I) et IFI-T1 (interferon-induced protein with tetratrico-peptide repeats-1) qui reconnaissent l’extrémité 5’ de l’ARN présentant les 3 phosphates du premier nucléotide non-coiffé. L’ensemble des réponses induites représente un frein à l’efficacité de la traduction des protéines codées par l’ARNm et donc à l’efficacité thérapeutique.
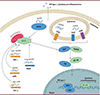 |
Figure 3. Mécanismes de réponses du système immunitaire inné à la présence d’ARN exogène au sein d’une cellule. Dans les endosomes, l’ARN double brin (db) est reconnu par le TLR3 et l’ARN simple brin (sb) par les TLR7/8 en présence du nucléotide uridine dans la séquence. Dans le cytosol, des formes d’ARN double brin plus ou moins longues sont reconnues par MAD5 ou LPG2. Les trois phosphates non coiffés en 5’ des ARNm double brin ou simple brin sont reconnus respectivement par RIG-I et IFI-T1. La stimulation de ces voies est suffisante pour induire une inflammation locale et systémique caractérisée par le relargage de cytokines pro-inflammatoires, comme l’IL (interleukine)-1α/β, l’IL-6, et d’interférons (IFN) de type I (IFN-α/β) via, respectivement, NF-kB et IRF. TLR: Toll-like receptor; TRIF: TIR domain-containing adaptor inducing interferon-β ; NF-kB: nuclear factor-kB; IRF: interferon regulatory factor; MAVS: mitochondrial antiviral-signaling protein; RIG-I: retinoic acid-inducible gene I; IFI-T1: interferon-induced protein with tetratrico-peptide repeats-1; MAD5: melanoma differentiation-associated protein 5; IFN-I: type I interferon; MyD88: myeloid differentiation primary response protein 88; LGP2: laboratory of genetics and physiology 2 (© Héloïse Bonnal). |
Les nanoparticules lipidiques, de par leur mode d’internalisation impliquant les endosomes, stimulent les récepteurs présents à la membrane de ces vésicules, comme le TLR7 qui reconnaît les ARNm (même s’ils sont constitués de bases uridine chimiquement modifiées, comme la N1-méthyl pseudo uridine [25], utilisée dans les vaccins contre le Covid-19). De même, dans les nanoparticules, la structuration des molécules d’ARNm peut conduire à la formation d’ARNm double brin qui seront reconnus par MAD5 et LGP2 dans le cytosol. Au contraire, les vecteurs polymériques, de par leur mécanisme de délivrance direct dans le cytosol sans passer par la voie endocytaire, contournent la réponse liée au TLR. L’organisation supramoléculaire des assemblages blocs copolymères/ARNm, qui préserve la structure simple brin de l’ARNm, ne devrait pas stimuler MAD5 et LGP2. Les ARNm thérapeutiques utilisés étant coiffés, les trois phosphates de l’extrémité de la molécule sont masqués et ne seront pas reconnus par les PRR cytosoliques RIG-I et IFI-T1. La structuration des vecteurs, de même que leur mode d’entrée dans la cellule, se révèlent ainsi déterminants pour contourner la détection des ARNm thérapeutiques par les senseurs du système immunitaire et empêcher leur dégradation et la production de cytokines pro-inflammatoires in vivo, afin d’obtenir une expression forte des protéines codées par l’ARNm [23] (Figure 4).
Modalités d’injection d’ARN thérapeutique
La distribution des ARNm thérapeutiques dans les organes, leur cinétique de traduction en protéine et leur effet thérapeutique sont influencés par la voie utilisée pour leur administration in vivo [26]. La voie d’administration est souvent déterminée en considérant les propriétés physico-chimiques des assemblages vecteurs synthétiques/ARNm et l’application thérapeutique recherchée. L’injection intraveineuse des nanoparticules lipidiques conduit pour la plupart d’entre elles à leur accumulation dans le foie où elles pénètrent dans les hépatocytes par endocytose, suite à l’interaction entre l’apolipoprotéine E (ApoE) circulante, très affine pour les lipides, dont les lipides ionisables complexant l’ARNm, et son récepteur à la surface de ces cellules. La biodistribution particulière des nanoparticules lipidiques dans le foie se fait donc par un ciblage actif, lié au recouvrement passif des complexes contenant les ARNm par l’ApoE sanguine après leur injection. Certains lipides ionisables permettent d’éviter ce mécanisme ciblant le foie [27]. Cependant, le ciblage du foie reste important pour le traitement de différentes maladies, en particulier pour produire des protéines thérapeutiques dans le cadre de maladies métaboliques et hématologiques, ou pour induire la production d’anticorps neutralisant des agents pathogènes ou ciblant des cellules cancéreuses. Comme nous l’avons vu, ces applications thérapeutiques potentielles nécessitent cependant que la réponse immunitaire innée liée à la reconnaissance des molécules d’ARNm soit limitée afin de permettre la répétition des administrations dans le temps si la protéine thérapeutique doit être produite sur le long terme, dans le cadre d’un déficit par exemple.
L’injection intraveineuse peut également être à l’origine de l’accumulation des nanoparticules dans les ganglions lymphatiques et induire une réponse immunitaire contre la protéine produite à partir de l’ARNm, même si celui-ci code une protéine qui est initialement présente dans l’organisme receveur. Bien que ce processus s’avère bénéfique dans le cas d’une vaccination par ARNm contre des cellules cancéreuses exprimant des antigènes tumoraux, il est à proscrire dans le cas de la thérapie par ARNm afin de ne pas compromettre son efficacité.
Une administration topique des molécules d’ARNm thérapeutiques a été explorée afin d’obtenir un effet thérapeutique local après injection, par exemple dans le cœur ou les poumons. Des essais cliniques de phase II (NCT03370887) [28] ont ainsi été conduits en utilisant des molécules d’ARNm codant le VEGF (vascular endothelial growth factor) injectées dans le cœur de patients ayant subi un infarctus pour créer de nouveaux vaisseaux sanguins. De même, un essai clinique de phase I/II (NCT03375047) [29] a évalué l’innocuité et la tolérance de formulations nébulisées dans les poumons de patients atteints de mucoviscidose. Dans cet essai, les formulations lipidiques administrées en une seule fois, encapsulaient trois quantités (8, 16 et 24 mg) d’ARNm codant la protéine CFTR (cystic fibrosis transmembrane conductance regulator) afin de remplacer la protéine mutée responsable de la maladie. Les résultats de cet essai n’ont cependant pas permis de confirmer des résultats antérieurs qui indiquaient une légère amélioration de la fonction respiratoire des patients. L’augmentation de l’efficacité de délivrance d’ARNm dans les poumons reste donc un défi, en raison des barrières importantes rencontrées, comme le mucus. Des améliorations, observées chez l’animal, résultant de la combinaison des molécules d’ARNm avec différents lipides en présence d’excipients et de solutés spécifiques, pourraient être appliquées afin d’augmenter la charge positive des complexes contenant l’ARNm et ainsi faciliter leur passage [30].
Les potentielles applications thérapeutiques
Par rapport aux vaccins à ARNm, la thérapie par ARNm pose plusieurs défis en termes de délivrance, d’efficacité de production protéique et de tolérance, ce qui explique la lenteur du développement de son application.
Les essais cliniques qui ont été entrepris concernent plusieurs approches, comme la thérapie de remplacement de protéines non-fonctionnelles mais aussi de protéines participant à l’édition de gènes, avec par exemple l’utilisation du système CRISPR [2, 26] dans le cadre des maladies génétiques héréditaires, ou des anticorps ou des cytokines pour les maladies acquises.
Thérapie par remplacement de protéines non-fonctionnelles
Les maladies génétiques sont dues à des mutations, acquises ou héritées, de l’ADN qui entraînent l’expression de protéines dysfonctionnelles ou leur absence. Dans certaines maladies, la supplémentation par des protéines thérapeutiques recombinantes peut être suffisante pour traiter les symptômes cliniques, mais ces traitements, bien souvent à l’origine d’effets secondaires, n’offrent pas de possibilités de traitements à long terme. C’est dans ce contexte que la thérapie par ARNm pour le remplacement de protéines non fonctionnelles ou absentes a émergé comme une alternative prometteuse. La thérapie par ARNm permet de restaurer la fonction et les caractéristiques des protéines codées, dont leur capacité de sécrétion, leur localisation intracellulaire ou transmembranaires. L’ARNm sera en effet traduit par les cellules du patient en une protéine qui subira les modifications post-traductionnelles spécifiques de la protéine originale.
Jusqu’à présent, les différents essais cliniques de thérapie de remplacement de protéines par nanoparticules ont concerné des maladies héréditaires affectant des enzymes du métabolisme général dont le déficit en ornithine transcarbamylase (NCT03767270) [31], qui entraîne une accumulation d’ammoniaque dans le sang, le déficit en méthylmalonyl CoA mutase, à l’origine d’une acidémie méthylmalonique (NCT03810690) [32], et le déficit en propionyl-coenzyme A carboxylase, entraînant une acidémie propionique (NCT04159103) [33,34]. Toutes ces maladies sont caractérisées par des déficits génétiques d’enzymes responsables de l’absence de prise en charge de certains produits métaboliques dont l’accumulation se traduit par des symptômes cliniques pouvant être mortels. La supplémentation de ces enzymes par l’expression d’ARNm correspondant, peut ainsi ralentir la progression de la maladie.
Le potentiel thérapeutique des thérapies de remplacement fondées sur l’ARNm a également été testé dans le cadre de plusieurs autres maladies métaboliques, mais ces essais restent limités à des études précliniques sur des animaux. C’est le cas de la tyrosinémie héréditaire de type I, la porphyrie aiguë intermittente, la maladie de Fabry, le syndrome de Grigler Najjar de type I, le déficit en antitrypsine a1, le déficit en citrine, et la maladie de stockage du glycogène de type I. D’autres maladies font l’objet de recherches, telles que des maladies hématologiques, comme l’hémophilie A, l’hémophilie B et le purpura thrombocytopénique, ou des maladies du système nerveux central, comme l’ataxie de Friedreich, ou encore des maladies de peau, comme le déficit en élastine, ou enfin les pertes auditives.
L’utilisation d’ARNm comporte néanmoins l’inconvénient de ne conduire qu’à une production transitoire de la protéine faisant défaut. C’est pourquoi, dans nombre de cas, il peut s’avérer nécessaire de ne pas forcément exprimer une copie fonctionnelle de la protéine mutée mais d’intervenir sur le défaut lui-même au niveau du gène muté.
Thérapies par correction de gène muté
Une autre stratégie thérapeutique consiste à intervenir sur le gène affecté afin de remédier à la mutation qu’il porte. La correction de gènes mutés a bénéficié des outils reposant sur des enzymes récemment identifiées, comme la nucléase Cas9 du système CRISPR/Cas9. En effet, les composants nécessaires à l’édition des gènes, la protéine Cas9 et l’ARN guide ciblant le gène d’intérêt, peuvent désormais être introduits dans les cellules sous la forme d’ARNm vectorisé. Un essai clinique de phase I (NCT04601051) [35] a été entrepris afin d’étudier l’innocuité, la pharmacocinétique et pharmacodynamique d’une formulation lipidique encapsulant ces ARNm dans le cadre du traitement de l’amylose liée à la transthyrétine, une maladie due à l’agrégation de la protéine mutée qui est produite et secrétée exclusivement par le foie. L’objectif de cette étude était de réduire la concentration circulante de transthyrétine mutée. Les résultats ont montré, après une injection unique de nanoparticules encapsulant l’ARNm codant la Cas9 et l’ARN guide (à la dose de 0,3 mg ARNm/kg) ciblant le gène TTR muté codant la transthyrétine toxique, une diminution de plus de 90 % de la concentration de protéine mutée circulante. À noter que le ciblage vers le foie des particules thérapeutiques est facilité par leur opsonisation par l’ApoE dans la circulation sanguine (voir ci-dessus). Parce que l’ARNm n’est exprimé que transitoirement, cette nouvelle approche apparaît plus sûre que l’approche de thérapie génique utilisant un vecteur viral contenant l’ADN codant la Cas9, qui persistera même après l’édition du gène cible et qui accroît le risque de modifications hors cible. Pour la première fois, cette étude démontre ainsi la possibilité de réaliser en utilisant la thérapie par ARNm, une édition de gènes pour corriger une maladie génétique chez l’homme. Elle ouvre ainsi la voie à l’exploration potentielle de ce type de thérapie pour de nombreuses maladies génétiques, en particulier hépatiques, liées à des défauts d’enzymes impliquées dans le métabolisme, et dans des maladies liées aux lipoprotéines. À noter que la Cas9 peut être aussi délivrée sous une forme protéique complexée avec l’ARN guide.
Thérapies en infectiologie et en cancérologie
L’utilisation de l’ARNm pour l’expression de protéines d’intérêt thérapeutique est également envisagée dans d’autres maladies. La production d’anticorps monoclonaux à partir de molécules d’ARNm vectorisées en est un exemple. En effet, un essai clinique de phase I a été conduit avec une formulation de nanoparticules, injectées par voie intraveineuse, comprenant un ARNm codant la séquence d’un anticorps neutralisant le virus Chikungunya (NCT03829384), identifiée chez un patient immunisé [36]. Les résultats de cette étude ont montré la production d’anticorps neutralisants aux trois doses d’ARNm utilisées (0,1, 0,3 et 0,6 mg d’ARNm/kg). Cependant à la plus forte dose, des effets indésirables ont été observés, bien que contrôlables par l’administration de stéroïdes au prix d’une diminution du niveau d’anticorps produits. Une autre application envisagée est celle de l’expression de protéines immunostimulantes pour lutter contre le cancer. Cette approche consiste en l’injection dans les tumeurs d’ARNm codant des protéines (interféron, cytokines) qui stimulent le système immunitaire dans le but de permettre aux lymphocytes T cytotoxiques de détruire les cellules tumorales. Généralement, les essais cliniques évaluant ce type d’approche, associent des anticorps recombinants anti-points de contrôle immunitaire, tels que PD-1 (programmed death-1) ou PD-L1 (programmed death-ligant 1), qui sont produits par fermentation industrielle. De nombreux autres essais cliniques sont en cours, utilisant différentes molécules exprimées à partir de molécules d’ARNm vectorisés par des nanoparticules, comme l’IL-2, l’IL-7 [37], l’IL-23, l’IL-36g, ou la molécule de costimulation OX40 [38].
Conclusion
Initialement, les applications de l’ARNm avaient pour objectif de produire des protéines capables de stimuler le système immunitaire, soit dans un but vaccinal contre des maladies infectieuses, soit pour stimuler des réponses anti-tumorales. L’émergence de l’ARNm, comme plate-forme vaccinale sûre et efficace, dans la course à la mise au point d’un vaccin contre la Covid-19 a démontré les bénéfices mais aussi les risques des formulations nanoparticulaires lipidiques/ARNm. Ces premiers succès ont conduit à des recherches sur les procédés de fabrication de ces composés, leurs conditions de stockage ainsi que sur leurs effets secondaires. Forte de ces réflexions et des solutions mises en œuvre, la communauté scientifique souhaite, à présent, développer l’utilisation des ARNm vers d’autres applications thérapeutiques.
D’ultérieures mises au point sont cependant nécessaires, en particulier en ce qui concerne la nécessité, dans ces nouvelles applications, d’atteindre une quantité efficace de protéine thérapeutique 100 à 1 000 fois supérieure à celle nécessaire pour une protéine vaccinale. Bien que cet objectif n’a pas encore été atteint, l’ARNm occupe déjà une place particulière entre la thérapie génique, par transfert d’ADN, et le traitement par protéine recombinante. Cette thérapie combine en effet certains avantages mais aussi certaines difficultés rencontrées dans ces approches. Par exemple, les problèmes techniques insurmontables en bioréacteur pour la production de protéines multimériques, peuvent être résolus en utilisant des ARNm codant les différentes sous-unités protéiques qui seront traduits par les cellules ciblées. Un avantage de la thérapie par ARNm par rapport à la thérapie génique utilisant l’ADN, est la possibilité de contrôler le niveau et de la durée d’expression de la protéine qu’il code, selon la quantité d’ARNm qui est injectée, ce qui limite les effets secondaires toxiques pouvant résulter d’une surexpression à long terme de protéines. La durée d’expression de la protéine d’intérêt thérapeutique positionne ainsi la thérapie par ARNm comme une technique idéale dans les situations dans lesquelles une expression transitoire ou épisodique de protéines est suffisante, voire souhaitée, comme c’est le cas pour les stratégies d’édition de gènes.
Le potentiel des thérapies par ARNm devrait être étendu avec l’évaluation des ARNm codant des protéines modifiées, leur conférant de nouvelles propriétés, ou des nouvelles protéines chimériques. Certaines protéines recombinantes ont en effet été conçues pour obtenir une longue durée d’action, en fusionnant au domaine thérapeutique de la protéine un domaine augmentant sa demi-vie, une particularité qui peut également être codée par les ARNm. Plus prometteuse est la capacité d’exprimer de nouvelles protéines thérapeutiques, comme des anticorps, des fragments d’anticorps ou d’autres motifs de liaison aux protéines, pouvant éventuellement être associées à un domaine d’adressage subcellulaire, comme par exemple, un domaine de localisation nucléaire, pour optimiser leur action.
La « ReNAissance » des biothérapies par l’ARNm est donc en marche pour valider le champ des maladies pouvant bénéficier de cette nouvelle approche et pour améliorer ou proposer des traitements innovants dans un futur proche.
Liens d’intérêts
Bruno Pitard déclare être à l’origine de brevets et demandes de brevets revendiquant l’utilisation de molécules amphiphiles de copolymères amphiphiles pour la formulation de molécules d’ARN. Bruno Pitard déclare également être co-fondateur d’In-Cell-Art et Irène Pitard être employée d’In-Cell-Art.
Références
- Pitard B.. Nanotaxi® pour les vaccins ARN et ADN. Med Sci (Paris) 2019 ; 35 : 749–752. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Rohner E, Yang R, Foo KS, et al. Unlocking the promise of mRNA therapeutics. Nat Biotechnol 2022; 40 : 1 586–600. [Google Scholar]
- Gupta A, Andresen JL, Manan RS, Langer R. Nucleic acid delivery for therapeutic applications. Adv Drug Deliv Rev 2021; 178 : 113 834. [Google Scholar]
- Labs R, Beilvert F, Barteau B, et al. Nature as a source of inspiration for cationic lipid synthesis. Genetica 2010 ; 138 : 153–168. [CrossRef] [PubMed] [Google Scholar]
- Pitard B, Aguerre O, Airiau M, et al. Virus-sized self-assembling lamellar complexes between plasmid DNA and cationic micelles promote gene transfer. Proc Natl Acad Sci USA 1997 ; 94 : 14412–417. [CrossRef] [PubMed] [Google Scholar]
- Pitard B, Habrant D. Supramolecular Gene Transfection Agents. In: Jerry L. Atwood. Comprehensive Supramolecular Chemistry II. Amsterdam, Netherlands: Elsevier, 2017 : pp. 365–389. [CrossRef] [Google Scholar]
- Jones CH, Androsavich JR, So N, et al. Breaking the mod with RNA – a “RNaissance” of life science. NPJ Genom Med 2024; 9 : 2. [Google Scholar]
- Desigaux L, Sainlos M, Lambert O, et al. Self-assembled lamellar complexes of siRNA with lipidic aminoglycoside derivatives promote efficient siRNA delivery and interference. Proc Natl Acad Sci USA 2007 ; 104 : 16 534–539. [Google Scholar]
- Colombani T, Peuziat P, Dallet L, et al. Self-assembling complexes binary mixtures of lipids with different linkers and nucleic acids promote universal mRNA, DNA and siRNA delivery. J Control Release 2017 ; 249 : 131–142. [CrossRef] [PubMed] [Google Scholar]
- Habrant D, Peuziat P, Colombani T, et al. Design of ionizable lipids to overcome the limiting step of endosomal escape : application in the intracellular delivery of mRNA. DNA and siRNA. J Med Chem 2016 ; 59 : 3 046–062. [Google Scholar]
- Blanchard E, Loomis KH, Bhosle SM, et al. Proximity Ligation Assays for In Situ Detection of Innate Immune Activation : Focus on In Vitro-Transcribed mRNA. Mol Ther Nucleic Acids 2019 ; 14 : 52–66. [CrossRef] [PubMed] [Google Scholar]
- Bhosle SM, Loomis KH, Kirschman JL, et al. Unifying in vitro and in vivo IVT mRNA expression discrepancies in skeletal muscle via mechanotransduction. Biomaterials 2018 ; 159 : 189–203. [CrossRef] [PubMed] [Google Scholar]
- Lindsay KE, Bhosle SM, Zurla C, et al. Visualization of early events in mRNA vaccine delivery in non-human primates via PET-CT and near-infrared imaging. Nat Biomed Eng 2019 ; 3 : 371–380. [CrossRef] [PubMed] [Google Scholar]
- Le Bihan O, Chèvre R, Mornet S, et al. Probing the in vitro mechanism of action of cationic lipid/DNA lipoplexes at a nanometric scale. Nucleic Acids Res 2011 ; 39 : 1 595–609. [Google Scholar]
- Hou X, Zaks T, Langer R and Dong Y. Lipid nanoparticles for mRNA delivery. Nat Rev Mater 2021; 6 : 1 078–94. [Google Scholar]
- Colombani T, Haudebourg T, Decossas M, et al. Lipidic Aminoglycoside Derivatives : A New Class of Immunomodulators Inducing a Potent Innate Immune Stimulation. Adv Sci (Weinh) 2019; 6 : 1 900 288. [CrossRef] [Google Scholar]
- Alameh MG, Tombácz I, Bettini E, et al. Lipid nanoparticles enhance the efficacy of mRNA and protein subunit vaccines by inducing robust T follicular helper cell and humoral responses. Immunity 2021; 54 : 2 877–92. [Google Scholar]
- Ndeupen S, Qin Z, Jacobsen S, et al. The mRNA-LNP platform’s lipid nanoparticle component used in preclinical vaccine studies is highly inflammatory. iScience 2021; 24 : 103 479. [Google Scholar]
- Barmada A, Klein J, Ramaswamy A, et al. Cytokinopathy with aberrant cytotoxic lymphocytes and profibrotic myeloid response in SARS-CoV-2 mRNA vaccine-associated myocarditis. Sci Immunol 2023; 8 : eadh3455. [CrossRef] [PubMed] [Google Scholar]
- Pitard B, Bello-Roufaï M, Lambert O, et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Res 2004 ; 16 : e159. [Google Scholar]
- Pitard B. Capped and uncapped RNA molecules and Block copolymers for intracellular delivery of RNA. Patent 2022 : US20220105203A1. [Google Scholar]
- Chèvre R, Le Bihan O, Beilvert F, et al. Amphiphilic block copolymers enhance the cellular uptake of DNA molecules through a facilitated plasma membrane transport. Nucleic Acids Res 2011 ; 39 : 1610–622. [Google Scholar]
- Colombani T, Haudebourg T, Pitard B. 704/DNA vaccines leverage cytoplasmic DNA stimulation to promote anti-HIV neutralizing antibody production in mice and strong immune response against alpha-fetoprotein in non-human primates. Mol Ther Nucleic Acids 2023; 32 : 743–57. [CrossRef] [PubMed] [Google Scholar]
- Verbeke R, Hogan ML, Loré K, Pardi N. Innate immune mechanisms of mRNA vaccines. Immunity 2022; 55 : 1993–2005. [CrossRef] [PubMed] [Google Scholar]
- Karikó K, Buckstein M, Ni H, Weissman D. Suppression of RNA recognition by Toll-like receptors : the impact of nucleoside modification and the evolutionary origin of RNA. Immunity 2005 ; 23 : 165–175. [CrossRef] [PubMed] [Google Scholar]
- Barbier AJ, Jiang AY, Zhang P, et al. The clinical progress of mRNA vaccines and immunotherapies. Nat Biotechnol 2022; 40 : 840–54. [CrossRef] [PubMed] [Google Scholar]
- Liu S, Cheng Q, Wei T, et al. Membrane-destabilizing ionizable phospholipids for organ-selective mRNA delivery and CRISPR-Cas gene editing. Nat Mater 2021; 20 : 701–10. [CrossRef] [PubMed] [Google Scholar]
- Anttila V, Saraste A, Knuuti J, et al. Direct intramyocardial injection of VEGF mRNA in patients undergoing coronary artery bypass grafting. Mol Ther 2023; 31 : 866–74. [CrossRef] [PubMed] [Google Scholar]
- Rowe SM, Zuckerman JB, Dorgan D et al. Inhaled mRNA therapy for treatment of cystic fibrosis : Interim results of a randomized, double-blind, placebo-controlled phase 1/2 clinical study. J Cys Fibros 2023; 22 : 656–64. [CrossRef] [Google Scholar]
- Jiang AY, Witten J, Raji IO, et al. Combinatorial development of nebulized mRNA delivery formulations for the lungs. Nat Nanotechnol 2024; 19 : 364–75. [CrossRef] [PubMed] [Google Scholar]
- Seker Yilmaz B, Gissen P. Genetic Therapy Approaches for Ornithine Transcarbamylase Deficiency. Biomedicines. 2023; 8 : 2 227. [Google Scholar]
- Hou X, Zaks T, Langer R, Dong Y. Lipid nanoparticles for mRNA delivery. Nat Rev Mater 2021; 6 : 1 078–94. [Google Scholar]
- Attarwala H, Lumley M, Liang M, et al. Translational Pharmacokinetic/Pharmacodynamic Model for mRNA-3927, an Investigational Therapeutic for the Treatment of Propionic Acidemia. Nucleic Acid Ther 2023; 33 : 141–7. [Google Scholar]
- Koeberl D, Schulze A, Sondheimer N, et al. Interim analyses of a first-in-human phase 1/2 mRNA trial for propionic acidaemia. Nature 2024; 628 : 872–7. [CrossRef] [PubMed] [Google Scholar]
- Gillmore JD, Gane E, Taubel J, et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med 2021; 385 : 493–502. [CrossRef] [PubMed] [Google Scholar]
- August A, Attarwala HZ, Himansu S, et al. A phase 1 trial of lipid-encapsulated mRNA encoding a monoclonal antibody with neutralizing activity against Chikungunya virus. Nat Med 2021; 27 : 2 224–33. [Google Scholar]
- BioNtech website. BioNtech mRNA pipeline. BNT153&BNT152: RiboCytokines IL-2 and IL-7 in various solid tumors. https://www.biontech.com/int/en/home/pipeline-and-products/pipeline.html#bnt411-solid-tumors. [Google Scholar]
- Moderna website. Moderna mRNA pipeline. mRNA-2752: OX40/IL-23/IL-36g (Triplet)/solid tumors/lymphoma. https://www.modernatx.com/research/product-pipeline. [Google Scholar]
Liste des figures
 |
Figure 1. Structures chimiques de lipides ionisables et de lipides neutres. A. les lipides ionisables pour la vectorisation d’acides nucléiques incluant le RPR120535, le DLin-MC3-DMA, le SM-102 et l’ALC-035, utilisés sous forme de nanoparticules lipidiques (LNP), respectivement dans le premier médicament (Onpattro®) approuvé par la FDA (Food and Drug Administration) pour le transport de siARN, et dans les premiers vaccins à ARNm Elasomeran et Tozinamera. Le CHOLK est un lipide ionisable dérivé d’un aminosucre naturel couplé à du cholestérol, utilisé sans association avec des lipides neutres. B. Lipides neutres utilisés pour former les LNP incluant le lipide-PEG (ALC-00159), le DSPC (distearoyl phosphatidyl choline) et le cholestérol, généralement au ratio molaire: 35, 16, 46,5, 2,5M/M. |
| Dans le texte | |
 |
Figure 2. Vectorisation d’ARNm thérapeutique utilisant des blocs copolymères. A. Structure chimique de la famille des blocs copolymères tétrafonctionnalisés ionisables. Les blocs hydrophiles (en bleu) et les blocs hydrophobes (en gris) sont reliés entre eux par une molécule centrale chargée positivement. Différentes propriétés physico chimiques peuvent être créées en variant la nature chimique des blocs et de la partie centrale. B. Représentation schématique illustrant l’organisation supramoléculaire d’une molécule d’ARNm en interaction avec les molécules de blocs copolymères, par forces électrostatiques entre les résidus phosphates des nucléotides chargés négativement et les charges positives de la partie centrale. Les blocs hydrophobes s’associant entre eux pour minimiser leur interaction avec l’eau. Dans un but de simplification un seul bloc hydrophile et hydrophobe par molécule est représenté. C. Représentation schématique illustrant le mécanisme de franchissement membranaire de la formulation bloc copolymère/ARNm. L’organisation supramoléculaire particulière va permettre un mécanisme d’internalisation direct dans le cytoplasme des cellules, contrairement aux structures globulaires d’une centaine de nanomètres des nanoparticules qui conduit à une internalisation par endocytose. Le masquage des charges négatives de l’ARNm par les blocs copolymères empêche les répulsions électrostatiques entre l’ARN et l’environnement cellulaire également chargé négativement. L’effet de déshydratation de la surface de la cellule par les blocs hydrophiles entraîne une déformation et une ouverture de la membrane pour la pénétration de la chaîne d’ARNm. Ensuite, les blocs hydrophobes à l’intérieur de la membrane vont créer des espaces pour l’ARNm. Puis, du côté interne de la membrane, les blocs hydrophiles avec leur forte affinité pour les environnements aqueux vont entraîner l‘ARN vers l’intérieur de la cellule (© Héloïse Bonnal). |
| Dans le texte | |
 |
Figure 3. Mécanismes de réponses du système immunitaire inné à la présence d’ARN exogène au sein d’une cellule. Dans les endosomes, l’ARN double brin (db) est reconnu par le TLR3 et l’ARN simple brin (sb) par les TLR7/8 en présence du nucléotide uridine dans la séquence. Dans le cytosol, des formes d’ARN double brin plus ou moins longues sont reconnues par MAD5 ou LPG2. Les trois phosphates non coiffés en 5’ des ARNm double brin ou simple brin sont reconnus respectivement par RIG-I et IFI-T1. La stimulation de ces voies est suffisante pour induire une inflammation locale et systémique caractérisée par le relargage de cytokines pro-inflammatoires, comme l’IL (interleukine)-1α/β, l’IL-6, et d’interférons (IFN) de type I (IFN-α/β) via, respectivement, NF-kB et IRF. TLR: Toll-like receptor; TRIF: TIR domain-containing adaptor inducing interferon-β ; NF-kB: nuclear factor-kB; IRF: interferon regulatory factor; MAVS: mitochondrial antiviral-signaling protein; RIG-I: retinoic acid-inducible gene I; IFI-T1: interferon-induced protein with tetratrico-peptide repeats-1; MAD5: melanoma differentiation-associated protein 5; IFN-I: type I interferon; MyD88: myeloid differentiation primary response protein 88; LGP2: laboratory of genetics and physiology 2 (© Héloïse Bonnal). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




