| Issue |
Med Sci (Paris)
Volume 40, Number 3, Mars 2024
|
|
|---|---|---|
| Page(s) | 267 - 274 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024013 | |
| Published online | 22 March 2024 | |
Sécrétion non conventionnelle
Nouvelles perspectives dans le trafic des protéines
Unconventional protein secretion - new perspectives in protein trafficking
Institut de génomique fonctionnelle,Université de Montpellier, CNRS UMR 5 203. Inserm U1191, Montpellier, France
*
julien.villeneuve@igf.cnrs.fr
L’étude de l’organisation structurale et fonctionnelle des cellules eucaryotes a révélé les compartiments membranaires ainsi que la machinerie nécessaires au trafic vésiculaire des protéines. La plupart des protéines essentielles à la communication intercellulaire contiennent une séquence signal leur permettant d’être incorporées dans la voie de sécrétion conventionnelle, par laquelle les protéines sont transportées séquentiellement dans le réticulum endoplasmique (RE) puis l’appareil de Golgi. Cependant, les cellules eucaryotes sont également dotées de voies de sécrétion alternatives ou voies de sécrétion non conventionnelles, qui mettent en jeu de nombreux acteurs susceptibles de détourner certains compartiments de leurs fonctions principales au profit de fonctions sécrétoires.
Abstract
The characterization of the structural and functional organization of eukaryotic cells has revealed the membrane compartments and machinery required for vesicular protein transport. Most proteins essential for intercellular communication contain an N-terminal signal sequence enabling them to be incorporated into the biosynthetic or conventional secretory pathway, in which proteins are sequentially transported through the endoplasmic reticulum (ER) and the Golgi apparatus. However, major research studies have shown the existence of alternative secretory routes that are independent of the ER-Golgi and designated as unconventional secretory pathways. These pathways involve a large number of players that may divert specific compartments from their primary function in favor of secretory roles. The comprehensive description of these processes is therefore of utmost importance to unveil how proteins secreted through these alternative pathways control cell homeostasis or contribute to disease development.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Julien Villeneuve).
Depuis les découvertes du biologiste américain George Palade, lauréat du prix Nobel de physiologie ou médecine en 1974 pour ses travaux pionniers sur l’organisation structurale et fonctionnelle des cellules, l’un des dogmes fondamentaux de la biologie cellulaire considère que les mécanismes qui orchestrent le trafic vésiculaire, le long de l’axe réticulum endoplasmique (RE) - appareil de Golgi, permettent le transport de la plupart des protéines sécrétées dans le milieu extracellulaire. Cette voie de sécrétion permet l’export d’une grande variété de protéines essentielles à la communication intercellulaire, notamment les facteurs de croissance, les cytokines, les hormones et les neurotransmetteurs, ainsi que les anticorps. Très brièvement, les protéines dont la séquence contient un peptide signal N-terminal sont ciblées et transloquées dans le RE. Dans des sites fonctionnels spécifiques de la membrane du RE, les protéines qui adoptent une conformation tri-dimensionnelle correcte sont encapsulées dans des vésicules de transport COPII (coat protein complex II), qui sont ensuite dirigées vers l’appareil de Golgi [1]. Au sein de l’appareil de Golgi, ces protéines sont triées et acheminées vers leur destination finale, en particulier la membrane plasmique (MP) ou l’espace extracellulaire. Pour leurs travaux majeurs concernant l’identification et la caractérisation des acteurs moléculaires essentiels à ce trafic vésiculaire, les Américains James Rothman et Randy Schekman, et l’Allemand Thomas Südhof, ont reçu le prix Nobel de physiologie ou médecine en 2013 [2]. Jusqu’à récemment, il était admis que le cheminement séquentiel des protéines le long de cette voie de sécrétion, conservée de la levure aux mammifères au cours de l’évolution, représentait la seule voie possible pour le transport des protéines vers la MP et l’espace extracellulaire. Cependant, d’importants travaux de recherche ont mis en évidence des voies de sécrétion supplémentaires que les cellules utilisent pour sécréter, en particulier, des protéines dépourvues de séquence signal, de manière indépendante de l’axe RE-Golgi. Ces voies de sécrétion alternatives, regroupées sous le terme de sécrétion non conventionnelle (UPS, pour unconventional protein secretion), sont généralement « activées » en cas de stress cellulaire. Actuellement, quatre types d’UPS sont répertoriés [3, 4]. Dans les UPS de types I et II, des modes de sécrétion non vésiculaires, les protéines-cargo1 sont directement transloquées à travers la MP, grâce respectivement à la formation de pores (UPS de type I) ou à l’utilisation de transporteurs ABC (ATP binding cassette)2 (UPS de type II). Dans l’UPS de type III, les protéines-cargo sont initialement incorporées dans des compartiments intracellulaires (endosomes tardifs, autophagosomes, lysosomes), qui fusionnent ensuite avec la MP, libérant ainsi leur contenu hors des cellules. L’UPS de type IV, également appelée « Golgi bypass », concerne, quant à elle, le transport de certaines protéines transmembranaires possédant une séquence signal, qui sont donc insérées dans le RE, mais qui sont acheminées à la MP indépendamment de l’appareil de Golgi. Les protéines transmembranaires transportées via l’UPS de type IV incluent, entre autres, des intégrines, des canaux et transporteurs ioniques, tels que les protéines pendrine, protéine transmembranaire échangeuse d’anions, CFTR (cystic fibrosis transmembrane conductance regulator), canal chlorure exprimé à la surface de nombreuses cellules épithéliales, ou la polycystine 2, canal cationique intervenant dans le transport du calcium dans l’épithélium rénal, qui exerce un rôle important notamment au cours de la ciliogénèse et la croissance axonale [5] (Figure 1).
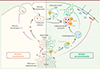 |
Figure 1. Voies de sécrétion conventionnelle et non conventionnelles. La plupart des protéines exportées à la membrane plasmique ou sécrétées dans le milieu extracellulaire possèdent une séquence signal N-terminale et suivent la voie de sécrétion conventionnelle incluant le transport au sein du réticulum endoplasmique (RE) et l’appareil de Golgi. Des protéines cytosoliques dépourvues de séquence signal peuvent cependant être exportées spécifiquement et activement par les cellules en empruntant différentes voies de sécrétion non conventionnelles (type I à IV). Dans la voie de sécrétion non conventionnelle de type III, les protéines-cargo peuvent être incorporées à différents compartiments intracellulaires, soit après translocation à l’aide de protéines-canal (indiquées en orange), soit après un remodelage membranaire (indiqué en jaune). CMA : chaperone-mediated autophagy ; ERGIC : ER-Golgi intermediate compartment ; MAPS : misfolded-associated protein secretion ; MVB : multivesicular body ; THU : TMD10-channeled UPS (illustration réalisée avec Biorender). |
Les premières études qui ont révélé ces voies de sécrétion non conventionnelles portaient sur le clonage du gène codant l’interleukine 1b (IL-1b). Ces études ont en effet montré que la séquence protéique de l’IL-1b ne comporte pas de séquence signal [6, 7], et que cette cytokine est libérée via une voie de sécrétion qui est indépendante du RE-Golgi [8]. Aujourd’hui, de nombreuses familles de protéines sécrétées de manière non conventionnelle ont été identifiées aussi bien chez la levure que chez de nombreux organismes multicellulaires, des plantes aux mammifères. Ces protéines, une fois sécrétées, jouent un rôle essentiel dans l’adaptation cellulaire à divers types de stress, dans l’organisation tissulaire, dans l’immunité, et dans le contrôle métabolique. Des altérations dans leur sécrétion peuvent contribuer à la progression tumorale ainsi qu’à diverses maladies inflammatoires, métaboliques ou neurodégénératives [9]. La compréhension des mécanismes fondamentaux sous-tendant les différentes voies d’UPS, leur régulation et leur intégration avec d’autres voies de trafic intracellulaire, revêt donc une importance majeure. Cette revue met l’accent sur les voies UPS de type I et III, qui sont les mieux caractérisées à ce jour.
Les voies de sécrétion non conventionnelle de type I
Le facteur de croissance des fibroblastes 2 (FGF2) est l’une des protéines sécrétées via l’UPS de type I pour lesquelles les mécanismes moléculaires impliqués sont bien caractérisés. La protéine FGF2 est recrutée au feuillet interne de la MP grâce à l’interaction d’acides aminés basiques, notamment les résidus K (lysine) 127, R (arginine) 128 et K133, avec le phosphatidylinositol 4, 5-bisphosphate (PI (4,5) P2) de la MP [10]. Cette interaction favorise l’oligomérisation du facteur FGF2, qui implique deux résidus cystéine (C77 et C95) formant des ponts disulfures intermoléculaires [11], ce qui conduit à la formation d’un pore membranaire. D’autres éléments sont également nécessaires à la sécrétion de la protéine FGF2 : la kinase Tec et la sous-unité α1 de la Na,K-ATPase, qui interagit physiquement avec la protéine FGF2 et facilite son recrutement au feuillet interne de la MP. Le transport vectoriel de la protéine FGF2 au travers de la membrane est assuré par des cycles d’assemblage-désassemblage de ses oligomères, couplés à son interaction avec les protéoglycanes héparane sulfates situés sur le feuillet externe de la MP. Ces événements de translocation ont été reconstitués in vitro, permettant d’établir la machinerie moléculaire minimale requise pour la translocation de la protéine [12]. Ils ont également été visualisés individuellement sur des cellules vivantes par la technique de microscopie TIRF3, ce qui a permis d’établir certains paramètres spatio-temporels de la sécrétion du facteur FGF2 [13].
D’autres exemples de protéines transloquées à travers la MP via l’UPS de type I comprennent l’IL-1b, la protéine Tau, ou la protéine Tat du VIH (virus de l’immunodéficience humaine). De manière similaire à la sécrétion de la protéine FGF2, la protéine Tat du VIH et la protéine Tau sont transloquées après leur recrutement au feuillet interne de la MP par interaction avec le PI(4,5)P2 et, dans le cas de la protéine Tau, par sa capacité à se lier aux protéoglycanes héparane sulfates situés sur le feuillet externe de la MP [14, 15]. L’IL-1b est, quant à elle, transportée à travers la MP des macrophages grâce à la formation d’un canal constitué de la protéine gasdermine D (GSDMD), un processus qui nécessite auparavant le clivage des protéines précurseurs de l’IL-1b et de la GSDMD. Le domaine N-terminal de la GSDMD ainsi produit forme, après son recrutement à la MP via une interaction avec les phosphoinositides et son oligomérisation, un pore qui permet la sécrétion de l’IL-1b mature (mIL-1b) [16].
Les voies de sécrétion non conventionnelle de type III
Contrairement à l’UPS de type I, l’UPS de type III se caractérise par l’implication de compartiments intermédiaires dans lesquels des protéines dépourvues de peptide signal sont incorporées. Les organites concernés peuvent être des autophagosomes, des endosomes ou des lysosomes qui, en réponse à certaines conditions de stress, acquièrent de nouvelles propriétés pour être convertis en compartiments sécrétoires [3].
L’incorporation de protéines cytosoliques dans ces compartiments peut reposer sur un remodelage membranaire. Par exemple, lors du processus de macroautophagie4, les substrats cytoplasmiques qui nécessitent d’être éliminés sont englobés et séquestrés dans une structure membranaire appelée phagophore qui, après élongation et fermeture, forme l’autophagosome. Des études fondées sur des approches génétiques (délétion de gènes codant des facteurs essentiels au processus d’autophagie comme ATG5 [autophagy related 5]) ou pharmacologiques (inhibiteurs de l’autophagie, tels que la wortmannine ou la 3’méthyladénine qui inhibent la PI3 kinase [phosphatidylinositol 3 kinase]) suggèrent que les autophagosomes sont impliqués dans l’UPS de nombreux éléments, comme la protéine acb1 chez la levure, des médiateurs de l’inflammation, l’enzyme dégradant l’insuline (IDE), des agrégats protéiques toxiques (Tau, α-synucléine), et même des particules virales [17]. Bien que les résultats de plusieurs études suggèrent que ces éléments issus du cytosol soient incorporés dans des autophagosomes, caractérisés par la présence du marqueur autophagique LC3 (microtubule-associated protein 1A/1B-light chain 3) [18, 19], aucune de ces études n’a démontré la fusion de ces autophagosomes avec la MP. Les autophagosomes pourraient en effet fusionner avec d’autres vésicules intermédiaires, telles que les endosomes tardifs, les corps multivésiculaires (MVB) ou des lysosomes sécrétoires. Ces vésicules intermédiaires libéreraient ensuite leur contenu dans l’espace extracellulaire par exocytose. Des protéines cytosoliques peuvent également être séquestrées dans des endosomes tardifs après invagination de leur membrane. Ces protéines sont ensuite incorporées dans de petites vésicules bourgeonnant à l’intérieur de ces endosomes, un processus qui aboutit à la formation des MVB. Les vésicules intraluminales ainsi formées, aussi appelées exosomes, peuvent être ensuite libérées dans l’espace extracellulaire après fusion des MVB avec la MP [20].
À côté de ces processus de remodelage membranaire, plusieurs protéines-canaux ont été identifiées comme des acteurs essentiels à l’incorporation de protéines cytosoliques dans différents compartiments intracellulaires.
Dans l’autophagie médiée par les chaperonnes (CMA), les protéines cytosoliques à éliminer sont adressées directement dans la lumière des lysosomes. Ces protéines, qui présentent un motif canonique, KFERQ, sont reconnues par la protéine chaperonne HSC70 (heat shock cognate 70), qui les adresse ensuite vers les lysosomes. Leur internalisation dans les lysosomes est permise par l’oligomérisation du récepteur lysosomique LAMP2A (lysosomal-associated membrane protein 2A), ce qui forme un canal de translocation [21]. Bien que la CMA ait été identifiée comme une voie de dégradation sélective, un mécanisme similaire permettrait la libération de l’IL-1b, qui présente également des motifs de type KFERQ, par les cellules après sa translocation dans des lysosomes sécrétoires [18, 22].
Dans les maladies neurodégénératives, des protéines cytosoliques présentant un repliement anormal, comme la protéine Tau, la superoxyde dismutase 1 (SOD1) ou l’α-synucléine, sont exportées hors des cellules par un mécanisme appelé MAPS (misfolding-associated protein secretion). Ce mécanisme de sécrétion serait activé lorsque d’autres mécanismes de contrôle qualité des protéines (par exemple, la dégradation par le protéasome ou l’autophagie) échouent à prévenir une accumulation excessive de protéines toxiques. Ces protéines mal conformées, sujettes à l’agrégation, sont reconnues par la désubiquitinase USP19. Elles sont ensuite recrutées par le complexe formé par la protéine chaperonne HSC70 et la protéine de choc thermique DNAJC5 (DnaJ heat shock protein family (Hsp40) member C5) ancrée dans la membrane des endosomes tardifs ou des lysosomes. Une machinerie de translocation, qui reste à identifier, permettrait alors le transport de ces protéines dans la lumière de ces compartiments [23].
Un autre exemple de voie UPS de type III repose sur l’oligomérisation de la protéine transmembranaire TMED10 (transmembrane P24 trafficking protein 10), qui permet la translocation des membres de la famille de l’IL-1 et des galectines 1 et 3 dans le compartiment intermédiaire entre le RE et l’appareil de Golgi (ERGIC) [24]. Le compartiment ERGIC, récemment identifié comme une source de membranes nécessaire à la biogénèse des autophagosomes [25], pourrait contribuer à l’UPS de protéines-cargo qui y ont été incorporées [24].
Contrôle et régulation de la sécrétion non conventionnelle
Une grande diversité de mécanismes hétérogènes semble donc à l’œuvre au sein des cellules eucaryotes pour permettre la sécrétion active et spécifique de protéines dépourvues de séquence signal N-terminale. Une même protéine-cargo peut ainsi être dirigée vers des voies de sécrétion différentes. C’est le cas notamment de l’IL-1b, dont la sécrétion peut reposer sur l’UPS de type I, après translocation à travers la MP via un pore formé par la protéine GSDMD [16], mais également sur l’UPS de type III, après son incorporation à l’intérieur des lysosomes via la CMA [22], ou du compartiment ERGIC, grâce au pore formé par la protéine TMED10 [24]. Le type cellulaire, les conditions physiopathologiques, ainsi que les voies de signalisation activées, permettraient d’engager une protéine-cargo vers une voie de sécrétion particulière, afin de mobiliser les quantités de protéine-cargo adéquates en réponse à un stress cellulaire donné. Il a été ainsi montré qu’au cours de la réponse immunitaire, l’activation du récepteur de l’immunité innée TLR4 (toll-like receptor 4) des monocytes par les lipopolysaccharides bactériens favorise une libération modérée d’IL-1b par l’UPS de type III, tandis qu’une stimulation simultanée des récepteurs TLR2, TLR4 et TLR7/8 favorise une sécrétion massive de la cytokine par l’UPS de type I [26]. Comprendre comment une protéine-cargo peut être dirigée différemment vers telle ou telle voie de sécrétion reste un enjeu majeur.
Certains facteurs, communs à de nombreux organismes, tels que la famille de protéines GRASP (trafficking regulator and scaffold protein tamalin), semblent agir comme des acteurs moléculaires essentiels pour l’export de plusieurs protéines-cargo sécrétées par différentes voies UPS. Les protéines GRASP sont présentes dans l’appareil de Golgi, où elles jouent un rôle majeur dans son organisation [27, 28]. Cependant, dans les cellules de mammifères, lors d’un stress métabolique, l’une de ces protéines, GRASP55, peut être relocalisée vers d’autres organites comme les autophagosomes, les MVB, les lysosomes, ou même le RE, favorisant ainsi les UPS de types III et IV [29, 30]. La relocalisation de la protéine GRASP55 est étroitement modulée par des modifications post-traductionnelles, notamment des phosphorylations [30]. Chez la levure, la protéine orthologue grh1 n’est relocalisée que dans des compartiments spécifiquement dédiés à l’UPS, les compartiments CUPS (compartment for unconventional protein secretion), qui sont formés de novo en réponse à une carence nutritionnelle [31].
Il semble que l’activation de voies UPS différentes repose sur des voies de signalisation particulières, ainsi que sur certains stress cellulaires. C’est le cas de la production d’espèces réactives de l’oxygène (ROS) au cours de stress oxydants, ainsi que lors du stress du RE [32–35].
L’activation différentielle des voies UPS s’inscrit ainsi dans une réponse adaptative de la cellule, au cours de laquelle certains facteurs et compartiments intracellulaires sont activés ou mobilisés. Dans un réseau complexe de cascades de signalisation et de voies de trafic membranaire interconnectées, l’identification de facteurs communs qui sont impliqués dans les différentes voies UPS sera essentielle pour comprendre comment ces voies sont intégrées aux autres fonctions cellulaires.
Les lysosomes sécrétoires
Les lysosomes occupent une position particulière au carrefour de multiples voies de trafic intracellulaire, là où convergent des protéines-cargo délivrées par les voies autophagique, endocytique et sécrétoire (RE/Golgi) (Figure 2). Cette position centrale confère aux lysosomes un rôle clé non seulement dans les voies conventionnelles, mais aussi dans les voies de sécrétion non conventionnelles [36, 37]. Traditionnellement perçus comme des organites dégradatifs5, les lysosomes se révèlent être des structures très dynamiques participant à de nombreux processus cellulaires et établissant des contacts membranaires avec la plupart des autres compartiments intracellulaires. Ils fonctionnent, par exemple, comme des plateformes de signalisation contrôlant l’activation de programmes transcriptionnels essentiels pour la modulation du métabolisme énergétique [38]. Ils sont également dotés de propriétés d’exocytose après leur transport le long du réseau de microtubules et leur fusion avec la MP [36]. La localisation des lysosomes dans les cellules détermine leur pH intraluminal, les lysosomes périphériques étant moins acides que les lysosomes proches du noyau de la cellule [39].
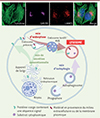 |
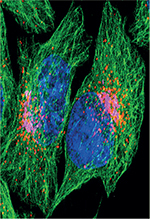
Figure 2. Les lysosomes, carrefour de multiples voies de trafic intracellulaire. Les images de microscopie confocale (en haut) montrent les lysosomes (visualisés en rouge grâce au marqueur LAMP1 [lysosome associated membrane protein 1]) dispersés dans le cytosol, mais principalement localisés dans la zone périnucléaire, à proximité de l’appareil de Golgi (visualisé en magenta grâce au marqueur GM130 [Golgi matrix protein 130]). Le réseau de microtubules et le noyau sont visualisés respectivement en vert et en bleu, grâce au marqueur tubuline et au DAPI. (En bas) Les protéines-cargo contenant un peptide signal N-terminal telles que les protéines lysosomiques (i.e. protéases, transporteurs, etc.) sont acheminées dans les lysosomes via la voie biosynthétique RE-Golgi. Le matériel extracellulaire et les protéines transmembranaires de la membrane plasmique sont adressés aux lysosomes via la voie d’endocytose. Les substrats cytosoliques peuvent être incorporés dans les lysosomes après séquestration dans les autophagosomes et transport dans la voie d’autophagie. MVB : multivesicular body (illustration réalisée avec Biorender.) |
Des lysosomes sécrétoires sont présents dans la plupart des types cellulaires, et l’exocytose lysosomique représente une forme ubiquitaire d’exocytose régulée par le calcium. Cette exocytose implique une machinerie de fusion spécifique, à laquelle participent les protéines VAMP7 (vesicle-associated membrane protein 7), syntaxine-4, SNAP23 (synaptosome associated protein 23) et synaptotagmine VII [36].
Ces compartiments intracellulaires jouent un rôle essentiel dans l’export de certains virus [40], et l’exocytose lysosomique favorise l’élimination d’agrégats de protéines toxiques mal repliées lors de situations de stress protéotoxique, ou de substrats toxiques non digérés dans les maladies liées à la surcharge des lysosomes [41, 42].
Un défi majeur consiste donc à comprendre comment les lysosomes acquièrent ces propriétés sécrétoires. Il est probable qu’en réponse à un stress cellulaire ou à des demandes particulières, une sous-population de lysosomes soit détournée de sa fonction initiale vers la sécrétion. L’identification de déterminants moléculaires susceptibles d’être activés ou recrutés dans les lysosomes est ainsi essentielle pour comprendre comment ces organites sont orientés vers des processus sécrétoires plutôt que dégradatifs (Figure 3).
 |
Figure 3. Fonctions et propriétés des lysosomes. Les travaux pionniers de Christian de Duve (prix Nobel de physiologie ou médecine en 1974 avec Georges Palade et Albert Claude) ont permis d’identifier les lysosomes [45]. Ces organites intracellulaires ont alors été décrits comme des compartiments acides qui renferment des protéases et d’autres enzymes hydrolytiques, permettant la dégradation de divers substrats extracellulaires et intracellulaires. Des études récentes ont montré que les lysosomes sont également dotés de nombreuses autres propriétés, dont la modulation est susceptible de convertir ces compartiments dégradatifs en compartiments sécrétoires (illustration réalisée avec Biorender). |
Le rôle central des lysosomes sécrétoires, non dégradatifs, dans les voies d’UPS illustre la plasticité et les propriétés dynamiques de certains compartiments intracellulaires pouvant être remodelés, détournés [36], voire créés de novo, comme dans le cas des CUPS [31], en réponse à des conditions physiopathologiques spécifiques.
Conclusion
Les processus de transport le long de l’axe RE-appareil de Golgi constituent une acquisition déterminante au cours de l’évolution des espèces, pour la localisation à la MP et la sécrétion d’une grande diversité de protéines essentielles à la communication intercellulaire. Quels avantages évolutifs supplémentaires ont pu résulter de l’acquisition des mécanismes sous-tendant l’UPS ? Il est probable que, sous l’effet d’une pression de sélection constante, les voies de l’UPS aient offert aux cellules des modes de sécrétion plus variés, directs et rapides, permettant une réponse efficace à certaines contraintes environnementales ou à des stress cellulaires. Il est également envisageable que les voies d’UPS aient initialement évolué pour permettre la clairance de protéines cytosoliques, empêchant ainsi une accumulation excessive de facteurs toxiques à l’intérieur des cellules. Par la suite, ce processus a pu être exploité pour la sécrétion d’autres protéines cytosoliques agissant de manière autocrine ou paracrine une fois libérées dans le milieu extracellulaire. Il est ainsi important d’identifier, chez des organismes divers, d’autres protéines susceptibles d’être exportées hors des cellules par les voies d’UPS et de comprendre leur rôle dans la communication intercellulaire.
Au-delà de la signification évolutive de l’UPS, de nombreux autres défis majeurs restent à relever. Il sera notamment essentiel de déterminer les mécanismes participant à la sélection des protéines-cargo dans le cytosol. En effet, contrairement au peptide signal, essentiel pour l’adressage des protéines-cargo dans la voie de sécrétion RE-Golgi (identifié par Günter Blobel, prix Nobel de physiologie ou médecine en 1999 [43])6, les principes de sélection et de reconnaissance des protéines-cargo pour l’UPS restent mal caractérisés. Les facteurs externes, les voies de signalisation et les régulateurs des différentes voies d’UPS [44] restent également à définir. De même, comment certains compartiments intracellulaires peuvent être mobilisés et détournés de leur fonction principale au profit d’un processus de sécrétion demeure une question primordiale.
Bien que les recherches récentes aient apporté des avancées significatives et que certains principes fondamentaux émergent, il est essentiel de poursuivre l’exploration des mécanismes moléculaires sous-tendant l’UPS afin de comprendre le rôle de ce processus dans l’homéostasie cellulaire, et de sa perturbation dans le développement de nombreuses maladies.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Ce travail a été réalisé avec le soutien de l’Inserm, le CNRS, l’Université de Montpellier, la Fondation Vaincre Alzheimer, l’Association France Parkinson, l’Association France Alzheimer et maladies apparentées, et de l’Agence nationale de la recherche (ANR).
La technique TIRF (total internal reflection fluorescence) utilise les propriétés d’une onde évanescente pour exciter et éclairer sélectivement des fluorophores situés dans une zone restreinte de l’échantillon. Elle permet l’observation de molécules proches de, ou localisées dans la membrane plasmique.
Références
- Lee MCS, Miller EA, Goldberg Jet al. Bi-directional protein transport between the ER and Golgi. Annu Rev Cell Dev Biol 2004 ; 20 : 87–123. [CrossRef] [PubMed] [Google Scholar]
- Pfeffer SRA Prize for Membrane Magic. Cell 2013 ; 155(1): 203–206. [Google Scholar]
- Filaquier A, Marin P, Parmentier ML, et al. Roads and hubs of unconventional protein secretion. Curr Opin Cell Biol 2022; 75 : 102 072. [Google Scholar]
- Zhang M, Schekman RCell biology. Unconventional secretion, unconventional solutions. Science 2013 ; 340 : 559–561. [NASA ADS] [CrossRef] [PubMed] [Google Scholar]
- Gee HY, Kim J, Lee MGUnconventional secretion of transmembrane proteins. Semin Cell Dev Biol 2018 ; 83 : 59–66. [CrossRef] [PubMed] [Google Scholar]
- Auron PE, Webb AC, Rosenwasser LJ, et al. Nucleotide sequence of human monocyte interleukin 1 precursor cDNA. Proc Natl Acad Sci U S A 1984 ; 81(7): 907–911. [Google Scholar]
- Furutani Y, Notake M, Yamayoshi M, et al. Cloning and characterization of the cDNAs for human and rabbit interleukin-1 precursor. Nucleic Acids Res 1985 ; 13(5): 869–882. [Google Scholar]
- Rubartelli A, Cozzolino F, Talio M, et al. A novel secretory pathway for interleukin-1 beta, a protein lacking a signal sequence. EMBO J 1990 ; 9(1): 503–510. [Google Scholar]
- Chiritoiu-Butnaru M, Stewart SE, Zhang M, et al. Editorial : Unconventional protein secretion : From basic mechanisms to dysregulation in disease. Front Cell Dev Biol 2022; 10 : 1088002. [CrossRef] [PubMed] [Google Scholar]
- Temmerman K, Ebert AD, Müller HM, et al. A direct role for phosphatidylinositol-4,5-bisphosphate in unconventional secretion of fibroblast growth factor 2. Traffic Cph Den 2008 ; 9(1): 204–217. [Google Scholar]
- Müller HM, Steringer JP, Wegehingel S, et al. Formation of disulfide bridges drives oligomerization, membrane pore formation, and translocation of fibroblast growth factor 2 to cell surfaces. J Biol Chem 2015 ; 290(8): 925–937. [Google Scholar]
- Steringer JP, Lange S, Čujová S, et al. Key steps in unconventional secretion of fibroblast growth factor 2 reconstituted with purified components. eLife 2017; 6 : e28985. [CrossRef] [PubMed] [Google Scholar]
- Dimou E, Cosentino K, Platonova E, et al. Single event visualization of unconventional secretion of FGF2. J Cell Biol 2019 ; 218 : 683–699. [CrossRef] [PubMed] [Google Scholar]
- Zeitler M, Steringer JP, Müller HM, et al. HIV-Tat Protein Forms Phosphoinositide-dependent Membrane Pores Implicated in Unconventional Protein Secretion. J Biol Chem 2015 ; 290(21): 976–984. [Google Scholar]
- Katsinelos T, Zeitler M, Dimou E, et al. Unconventional Secretion Mediates the Trans-cellular Spreading of Tau. Cell Rep 2018 ; 23 : 2039–2055. [CrossRef] [PubMed] [Google Scholar]
- Evavold CL, Ruan J, Tan Y, et al. The Pore-Forming Protein Gasdermin D Regulates Interleukin-1 Secretion from Living Macrophages. Immunity 2018 ; 48(35–44): e6. [CrossRef] [PubMed] [Google Scholar]
- Kimura T, Jia J, Claude-Taupin A, et al. Cellular and molecular mechanism for secretory autophagy. Autophagy 2017 ; 13(1): 084–085. [Google Scholar]
- Zhang M, Kenny SJ, Ge L, et al. Translocation of interleukin-1β into a vesicle intermediate in autophagy-mediated secretion. eLife 2015; 4 : e11205. [CrossRef] [PubMed] [Google Scholar]
- Dupont N, Jiang S, Pilli M, et al. Autophagy-based unconventional secretory pathway for extracellular delivery of IL-1β. EMBO J 2011 ; 30(4): 701–711. [Google Scholar]
- Vietri M, Radulovic M, Stenmark H. The many functions of ESCRTs. Nat Rev Mol Cell Biol 2020; 21 : 25–42. [CrossRef] [PubMed] [Google Scholar]
- Arias E, Cuervo AMChaperone-mediated autophagy in protein quality control. Curr Opin Cell Biol 2011 ; 23 : 184–189. [CrossRef] [PubMed] [Google Scholar]
- Sitia R, Rubartelli A. The unconventional secretion of IL-1β : Handling a dangerous weapon to optimize inflammatory responses. Semin Cell Dev Biol 2018 ; 83 : 12–21. [CrossRef] [PubMed] [Google Scholar]
- Xu Y, Cui L, Dibello A, et al. DNAJC5 facilitates USP19-dependent unconventional secretion of misfolded cytosolic proteins. Cell Discov 2018 ; 4 : 11. [CrossRef] [PubMed] [Google Scholar]
- Zhang M, Liu L, Lin X, et al. A Translocation Pathway for Vesicle-Mediated Unconventional Protein Secretion. Cell 2020; 181 : 637–52.e15. [CrossRef] [PubMed] [Google Scholar]
- Ge L, Melville D, Zhang M, et al. The ER-Golgi intermediate compartment is a key membrane source for the LC3 lipidation step of autophagosome biogenesis. eLife 2013; 2 : e00947. [CrossRef] [PubMed] [Google Scholar]
- Semino C, Carta S, Gattorno M, et al. Progressive waves of IL-1β release by primary human monocytes via sequential activation of vesicular and gasdermin D-mediated secretory pathways. Cell Death Dis 2018 ; 9(1): 088. [CrossRef] [Google Scholar]
- Grond R, Veenendaal T, Duran JM, et al. The function of GORASPs in Golgi apparatus organization in vivo. J Cell Biol 2020; 219 : e202004191. [CrossRef] [PubMed] [Google Scholar]
- Zhang Y, Seemann J. Rapid degradation of GRASP55 and GRASP65 reveals their immediate impact on the Golgi structure. J Cell Biol 2021; 220 : e202007052. [CrossRef] [PubMed] [Google Scholar]
- Gee HY, Noh SH, Tang BL, et al. Rescue of ΔF508-CFTR trafficking via a GRASP-dependent unconventional secretion pathway. Cell 2011 ; 146 : 746–760. [CrossRef] [PubMed] [Google Scholar]
- Nüchel J, Tauber M, Nolte JL, et al. An mTORC1-GRASP55 signaling axis controls unconventional secretion to reshape the extracellular proteome upon stress. Mol Cell 2021; 81 : 3275–93.e12. [CrossRef] [PubMed] [Google Scholar]
- Bruns C, McCaffery JM, Curwin AJ, et al. Biogenesis of a novel compartment for autophagosome-mediated unconventional protein secretion. J Cell Biol 2011 ; 195 : 979–992. [CrossRef] [PubMed] [Google Scholar]
- Cruz-Garcia D, Brouwers N, Malhotra V, et al. Reactive oxygen species triggers unconventional secretion of antioxidants and Acb1. J Cell Biol 2020; 219 : e201905028. [CrossRef] [PubMed] [Google Scholar]
- Chiritoiu M, Brouwers N, Turacchio G, et al. GRASP55 and UPR Control Interleukin-1β Aggregation and Secretion. Dev Cell 2019 ; 49(145–55): e4. [CrossRef] [PubMed] [Google Scholar]
- Evavold CL, Hafner-Bratkovič I, Devant P, et al. Control of gasdermin D oligomerization and pyroptosis by the Ragulator-Rag-mTORC1 pathway. Cell 2021; 184 : 4495–511.e19. [CrossRef] [PubMed] [Google Scholar]
- Li X, Gulbins E, Zhang Y. Oxidative stress triggers Ca-dependent lysosome trafficking and activation of acid sphingomyelinase. Cell Physiol Biochem Int J Exp Cell Physiol Biochem Pharmacol 2012 ; 30 : 815–826. [CrossRef] [PubMed] [Google Scholar]
- Tancini B, Buratta S, Delo F, et al. Lysosomal Exocytosis : The Extracellular Role of an Intracellular Organelle. Membranes 2020; 10 : 406. [CrossRef] [PubMed] [Google Scholar]
- Villeneuve J, Bassaganyas L, Lepreux S, et al. Unconventional secretion of FABP4 by endosomes and secretory lysosomes. J Cell Biol 2018 ; 217 : 649–665. [CrossRef] [PubMed] [Google Scholar]
- Ballabio A, Bonifacino JS. Lysosomes as dynamic regulators of cell and organismal homeostasis. Nat Rev Mol Cell Biol 2020; 21 : 101–18. [CrossRef] [PubMed] [Google Scholar]
- Johnson DE, Ostrowski P, Jaumouillé V, et al. The position of lysosomes within the cell determines their luminal pH. J Cell Biol 2016 ; 212 : 677–692. [CrossRef] [PubMed] [Google Scholar]
- Ghosh S, Dellibovi-Ragheb TA, Kerviel A, et al. β-Coronaviruses Use Lysosomes for Egress Instead of the Biosynthetic Secretory Pathway. Cell 2020; 183 : 1520–35.e14. [CrossRef] [PubMed] [Google Scholar]
- Medina DL, Fraldi A, Bouche V, et al. Transcriptional activation of lysosomal exocytosis promotes cellular clearance. Dev Cell 2011 ; 21 : 421–430. [CrossRef] [PubMed] [Google Scholar]
- Trajkovic K, Jeong H, Krainc D. Mutant Huntingtin Is Secreted via a Late Endosomal/Lysosomal Unconventional Secretory Pathway. J Neurosci 2017 ; 37(9): 000–012. [Google Scholar]
- Anderson D, Walter P. Blobel’s nobel : a vision validated. Cell 1999 ; 99 : 557–558. [CrossRef] [PubMed] [Google Scholar]
- Bassaganyas L, Popa SJ, Horlbeck M, et al. New factors for protein transport identified by a genome-wide CRISPRi screen in mammalian cells. J Cell Biol 2019 ; 218(3): 861–879. [Google Scholar]
- de Duve C.. The lysosome turns fifty. Nat Cell Biol 2005 ; 7 : 847–849. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Voies de sécrétion conventionnelle et non conventionnelles. La plupart des protéines exportées à la membrane plasmique ou sécrétées dans le milieu extracellulaire possèdent une séquence signal N-terminale et suivent la voie de sécrétion conventionnelle incluant le transport au sein du réticulum endoplasmique (RE) et l’appareil de Golgi. Des protéines cytosoliques dépourvues de séquence signal peuvent cependant être exportées spécifiquement et activement par les cellules en empruntant différentes voies de sécrétion non conventionnelles (type I à IV). Dans la voie de sécrétion non conventionnelle de type III, les protéines-cargo peuvent être incorporées à différents compartiments intracellulaires, soit après translocation à l’aide de protéines-canal (indiquées en orange), soit après un remodelage membranaire (indiqué en jaune). CMA : chaperone-mediated autophagy ; ERGIC : ER-Golgi intermediate compartment ; MAPS : misfolded-associated protein secretion ; MVB : multivesicular body ; THU : TMD10-channeled UPS (illustration réalisée avec Biorender). |
| Dans le texte | |
 |
Figure 2. Les lysosomes, carrefour de multiples voies de trafic intracellulaire. Les images de microscopie confocale (en haut) montrent les lysosomes (visualisés en rouge grâce au marqueur LAMP1 [lysosome associated membrane protein 1]) dispersés dans le cytosol, mais principalement localisés dans la zone périnucléaire, à proximité de l’appareil de Golgi (visualisé en magenta grâce au marqueur GM130 [Golgi matrix protein 130]). Le réseau de microtubules et le noyau sont visualisés respectivement en vert et en bleu, grâce au marqueur tubuline et au DAPI. (En bas) Les protéines-cargo contenant un peptide signal N-terminal telles que les protéines lysosomiques (i.e. protéases, transporteurs, etc.) sont acheminées dans les lysosomes via la voie biosynthétique RE-Golgi. Le matériel extracellulaire et les protéines transmembranaires de la membrane plasmique sont adressés aux lysosomes via la voie d’endocytose. Les substrats cytosoliques peuvent être incorporés dans les lysosomes après séquestration dans les autophagosomes et transport dans la voie d’autophagie. MVB : multivesicular body (illustration réalisée avec Biorender.) |
| Dans le texte | |
 |
Figure 3. Fonctions et propriétés des lysosomes. Les travaux pionniers de Christian de Duve (prix Nobel de physiologie ou médecine en 1974 avec Georges Palade et Albert Claude) ont permis d’identifier les lysosomes [45]. Ces organites intracellulaires ont alors été décrits comme des compartiments acides qui renferment des protéases et d’autres enzymes hydrolytiques, permettant la dégradation de divers substrats extracellulaires et intracellulaires. Des études récentes ont montré que les lysosomes sont également dotés de nombreuses autres propriétés, dont la modulation est susceptible de convertir ces compartiments dégradatifs en compartiments sécrétoires (illustration réalisée avec Biorender). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




