| Issue |
Med Sci (Paris)
Volume 40, Number 3, Mars 2024
|
|
|---|---|---|
| Page(s) | 248 - 250 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024003 | |
| Published online | 22 March 2024 | |
Un rôle du microbiote dans la sensibilité à l’endométriose
Impact of the microbiota in endometriosis sensitivity
Équipe Des gamètes à la naissance : génomique, épigénétique et physiopathologie de la reproduction, Inserm U1016, CNRS UMR 8104, Institut Cochin, Université de Paris, Paris, France
L’endométriose est une maladie gynécologique fréquente, affectant environ 10 % des femmes, qui se manifeste par la douleur et l’infertilité. On estime que la moitié des infertilités féminines sont associées à l’endométriose. Réciproquement, environ 40 % des femmes affectées par l’endométriose sont infertiles.
L’endométriose est caractérisée par la présence de tissu semblable à l’endomètre (endometrial-like cells) en dehors de l’utérus, formant des lésions, généralement sur le péritoine ou sur les organes abdominaux. On distingue trois types d’endométriose selon la localisation ou la profondeur d’implantation des lésions : l’endométriose péritonéale superficielle, l’endométriose ovarienne, et l’endométriose infiltrante profonde. L’hypothèse la plus courante sur l’origine de l’endométriose s’appuie sur un phénomène de menstruations rétrogrades : à chaque période de menstruation, des fragments d’endomètre atteindraient la cavité péritonéale en passant par les trompes de Fallope. Chez les femmes développant une endométriose, ces fragments seraient en mesure de s’implanter, de se développer, voire d’envahir d’autres organes, en formant un tissu utérin ectopique, structurellement similaire au tissu utérin eutopique. Les lésions d’endométriose vont ensuite répondre aux stimulations hormonales mensuelles, et après quelques années, entraîner un aspect « recroquevillé » des organes de la cavité abdominale limitant leurs mouvements normaux (péristaltisme intestinal, motilité et fonction musculaire du rectum et du vagin, etc.). Dans ces conditions, les rapports sexuels, la miction, la défécation peuvent devenir très douloureux, en particulier au moment des menstruations, car la libération d’œstrogènes par l’ovaire continue d’agir sur ces fragments d’utérus ectopiques.
L’endométriose est une maladie complexe, dans laquelle des facteurs génétiques et environnementaux interagissent. Du point de vue génétique, l’héritabilité de l’endométriose est estimée à 50 %, ce qui a suscité des efforts internationaux d’analyses pangénomiques d’association (genome wide association studies, GWAS) depuis 2010. Une quarantaine de locus impliqués dans l’endométriose ont été identifiés, mais leur combinaison explique moins de 10 % de la génétique de l’endométriose [1]. Parmi les facteurs environnementaux, l’implication des perturbateurs endocriniens a été évoquée [2]. L’exposition au diéthylstilbestrol1 pourrait induire un accroissement modéré du risque d’endométriose [3]. Parmi les perturbateurs endocriniens les plus étudiés, les benzopyrènes, le bisphénol A, et les phtalates semblent augmenter le risque de développer l’endométriose [4–6], tandis que l’exposition aux polychlorobiphényles (PCB) ou à la 2,3,7,8-tétrachlorodibenzo-p-dioxine ne semble pas augmenter ce risque.
Le microbiote utérin est un autre facteur environnemental impliqué dans l’endométriose [7]. Dans une étude dont les résultats ont été publiés récemment [8], les auteurs ont d’abord analysé l’expression des gènes dans les fibroblastes de l’endomètre utérin et dans ceux des lésions ovariennes d’endométriose, et ils ont comparé leurs résultats à ceux de trois autres études publiés précédemment. Treize gènes modifiés ont été retrouvés dans toutes les études. Les auteurs se sont focalisés sur TAGLN, qui code la transgéline, une protéine impliquée dans la réticulation de l’actine, en particulier dans les fibroblastes. Ils ont montré la présence d’une faible quantité de cette protéine dans l’utérus de femmes sans endométriose, d’une quantité plus élevée dans l’utérus eutopique de femmes souffrant d’endométriose, et d’une quantité maximale dans la lésion ovarienne elle-même. Ils ont ensuite exploré la fonction de la transgéline, et montré que cette protéine active la prolifération des trophoblastes et des cellules endométriales, ainsi que la mobilité des trophoblastes [8]. Or la voie de signalisation par le TGF-β (transforming growth factor beta) active le gène codant la transgéline [9]. Les auteurs proposent alors que la surexpression de TAGLN est associée à l’augmentation de la concentration du TGF-β dans le microenvironnement de l’endomètre. Ils formulent ensuite l’hypothèse, fragile à ce stade, qu’une infection bactérienne pourrait être à l’origine de cette augmentation. Dans la suite de l’étude, l’expression de TAGLN devient un simple marqueur de l’activation de différentes cascades de signalisation par le TGF-β, incluant celles de l’inflammation. Néanmoins, c’est cette partie de l’étude qui comporte les résultats scientifiques ayant un impact médical majeur.
Une analyse de plusieurs dizaines de microbiotes d’endomètre de femmes souffrant d’endométriose et de femmes témoins a révélé une présence de la bactérie Fusobacterium 2 chez 63 % des patientes, mais chez moins de 10 % des témoins [8]. Des résultats obtenus dans un modèle murin ont ensuite permis d’établir une relation de causalité entre la présence de cette bactérie et la survenue de l’endométriose. Dans l’expérience réalisée par les auteurs de l’article, l’utérus de souris donneuses est infecté (ou non) par Fusobacterium pendant une semaine, puis ces souris subissent une ablation de l’utérus deux semaines après le début de l’infection. Le tissu utérin est ensuite broyé, et une quantité définie de ce tissu est injectée à des souris receveuses par voie intrapéritonéale. Ces souris développent alors constamment des lésions similaires à celles de l’endométriose de la femme, avec une accumulation de macrophages activés, une activation de la voie du TGF-β et par conséquent de la transgéline [10] (Figure 1). Il convient de préciser que l’infection par des bactéries d’une autre espèce, telle que Lactobacillus, ne produit pas les mêmes effets [8]. Les auteurs ont ensuite utilisé un traitement antibiotique (métronidazole ou chloramphénicol) chez les souris receveuses, entre la quatrième et la cinquième semaine après l’inoculation, et montrent que 21 jours après ce traitement, les lésions présentes chez ces souris sont très réduites, en nombre et en volume, ainsi que le nombre de macrophages activés, ce qui suggère la possibilité d’un traitement limitant l’extension de la maladie et ses conséquences inflammatoires chez les femmes souffrant d’endométriose [10].
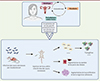 |
Figure 1. Expérience montrant le rôle de certaines bactéries du microbiote de l’endomètre dans l’endométriose. La bactérie Fusobacterium est présente chez plus de 60 % des femmes souffrant d’endométriose, et chez seulement 10 % des autres femmes. Dans un modèle murin d’endométriose, la contamination, par cette bactérie, de l’utérus de souris donneuses induit, chez des souris receveuses du tissu infecté (injecté par voie intrapéritonéale), des lésions d’endométriose plus étendues et en plus grand nombre que chez des souris témoins, qui ont reçu des broyats d’utérus de donneuses non infectées [8]. |
Cette étude enrichit la physiopathologie de l’endométriose, en suggérant que l’infection bactérienne par Fusobacterium induit la production du TGF-β, ce qui déclenche une réponse physiologique aboutissant notamment à l’activation du gène codant la transgéline. Cette protéine, qui interagit avec le cytosquelette d’actine, module le fonctionnement des cellules endométriales, leur prolifération, leur adhérence, et les auteurs de l’article la considèrent comme un possible acteur d’une réponse inflammatoire. L’antibiothérapie devient ainsi une option de traitement de l’endométriose, au moins pour les femmes, nombreuses, chez qui la maladie est associée à une infection de l’endomètre par Fusobacterium.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Lalami I, Abo C, Borghese B, et al. Genomics of endometriosis : From genome wide association studies to exome sequencing. Int J Mol Sci 2021; 22 : 7 297. [Google Scholar]
- Rumph JT, Stephens VR, Archibong AE, et al. Environmental endocrine disruptors and endometriosis. Adv Anat Embryol Cell Biol 2020; 232 : 57–78. [CrossRef] [PubMed] [Google Scholar]
- Al Jishi T, Sergi C : Current perspective of diethylstilbestrol (DES) exposure in mothers and offspring. Reprod Toxicol 2017; 71 : 71–7. [CrossRef] [PubMed] [Google Scholar]
- Matsunawa M, Amano Y, Endo K, et al. The aryl hydrocarbon receptor activator benzo [a] pyrene enhances vitamin D3 catabolism in macrophages. Toxicol Sci 2009 ; 109 : 50–58. [CrossRef] [PubMed] [Google Scholar]
- Rashidi BH, Amanlou M, Lak TB, et al. A case-control study of bisphenol A and endometrioma among subgroup of Iranian women. J Res Med Sci 2017 ; 22 : 7. [CrossRef] [PubMed] [Google Scholar]
- Nazir S, Usman Z, Imran M, et al. Women diagnosed with endometriosis show high serum levels of diethyl hexyl phthalate. J Hum Reprod Sci 2018 ; 11 : 131–136. [CrossRef] [PubMed] [Google Scholar]
- Leonardi M, Hicks C, El-Assaad F, et al. Endometriosis and the microbiome : a systematic review. BJOG 2020; 127 : 239–49. [CrossRef] [PubMed] [Google Scholar]
- Muraoka A, Suzuki M, Hamaguchi T, et al. Fusobacterium infection facilitates the development of endometriosis through the phenotypic transition of endometrial fibroblasts. Sci Transl Med 2023 ; 15 : eadd1531. [CrossRef] [PubMed] [Google Scholar]
- Yu H, Konigshoff M, Jayachandran A, et al. Transgelin is a direct target of TGF-β/Smad3-dependent epithelial cell migration in lung fibrosis. FASEB J 2008 ; 22 : 1 778–89. [CrossRef] [Google Scholar]
- Assinder SJ, Stanton JA, Prasad PD. Transgelin : an actin-binding protein and tumour suppressor. Int J Biochem Cell Biol 2009 ; 41 : 482–486. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Expérience montrant le rôle de certaines bactéries du microbiote de l’endomètre dans l’endométriose. La bactérie Fusobacterium est présente chez plus de 60 % des femmes souffrant d’endométriose, et chez seulement 10 % des autres femmes. Dans un modèle murin d’endométriose, la contamination, par cette bactérie, de l’utérus de souris donneuses induit, chez des souris receveuses du tissu infecté (injecté par voie intrapéritonéale), des lésions d’endométriose plus étendues et en plus grand nombre que chez des souris témoins, qui ont reçu des broyats d’utérus de donneuses non infectées [8]. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




