| Issue |
Med Sci (Paris)
Volume 40, Number 2, Février 2024
|
|
|---|---|---|
| Page(s) | 161 - 166 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023219 | |
| Published online | 27 February 2024 | |
Impact de la vaccination sur l’évolution de Bordetella pertussis
Impact of vaccination on the evolution of Bordetella pertussis
Université Claude Bernard Lyon 1 LBBE, UMR 5558, CNRS, VAS, Villeurbanne, France
* florian.lecorvaisier@gmail.com, florian.lecorvaisier@univ-lyon1.fr
Les vaccins contre la coqueluche sont commercialisés et utilisés dans la plupart des pays du monde depuis déjà plusieurs décennies. L’histoire des vaccins anticoquelucheux est particulière, les traditionnels vaccins cellulaires ayant été remplacés par des vaccins acellulaires dans de nombreux pays développés au cours des deux décennies passées. Selon leur composition, ces vaccins ont un effet important sur l’évolution de l’agent étiologique de la coqueluche, la bactérie Bordetella pertussis. Cette évolution se traduit par des changements génétiques et phénotypiques chez la bactérie, et a eu comme conséquences la résurgence de la coqueluche dans de nombreux pays ainsi que l’apparition de nouvelles souches échappant aux vaccins. L’émergence de nouvelles souches par pression vaccinale illustre ainsi l’importance de la prise en compte de la biologie de l’évolution de la bactérie dans l’élaboration de nouveaux vaccins.
Abstract
Vaccines against pertussis, or whooping cough, have been commercialized and used in most countries worldwide for decades. The history of these vaccines is distinctive, marked by the transition from whole-cell vaccines to acellular vaccines in many developed countries over the last two decades. This particular history has had a significant impact on the evolution of Bordetella pertussis, the etiological agent of whooping cough. Both genetic and phenotypic changes appeared, with the emergence of novel alleles for antigens targeted by the vaccines and changes in the expression of these antigens. The main consequence of these changes is the resurgence of whooping cough in many countries and the appearance of strains capable of evading vaccine-induced immunity. The emergence of novel strains under vaccine pressure underscores the importance of considering biological evolution in the conception of new vaccines and vaccine strategies.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© OMS).
La coqueluche est une maladie infectieuse des voies respiratoires strictement humaine et causée par la bactérie Bordetella pertussis. Comme de nombreuses maladies humaines, l’origine de la coqueluche serait zoonotique. Les espèces du genre Bordetella infectent différentes espèces animales, principalement des mammifères mais certaines peuvent également infecter des oiseaux (comme B. avium). La lignée de Bordetella pertussis aurait divergé pour devenir spécialiste de l’hôte Homo sapiens, provoquant aujourd’hui la maladie appelée coqueluche [1]. Longtemps un fléau principalement chez les jeunes enfants, la coqueluche est combattue depuis maintenant presque un siècle par la vaccination.
L’effet de la vaccination sur la dynamique épidémiologique de la coqueluche a déjà fait l’objet de questionnements. Autrefois maladie extrêmement prévalente, l’utilisation répandue des vaccins a conduit à une diminution globale du nombre de cas dans de nombreux pays. Par exemple, en Angleterre et au Pays de Galles, le nombre de cas déclarés par an est progressivement passé de plus de 90 000 en 1956 à moins de 10 000 dans les années 1990, et à moins de 1 000 dans les années 2000 [2]. La vaccination a cependant eu des conséquences moins prévisibles, comme un changement dans le mode de transmission (c’est-à-dire qui infecte qui, et comment), ou l’âge moyen auquel les enfants contractent généralement la maladie [3] (→).
(→) Voir la Synthèse de N. Guiso, m/s n° 4, avril 2007, page 399
Ces conséquences de la vaccination peuvent être regroupées en « effets à court terme », qu’on pourrait aussi appeler « conséquences écologiques ». Les effets à plus long terme, ou « conséquences évolutives », de la vaccination anticoquelucheuse ont commencé à être observés plus récemment. Ces effets sont fortement liés à l’histoire particulière des vaccins développés contre la coqueluche.
Histoire de la vaccination anticoquelucheuse
L’histoire des vaccins anticoquelucheux commence dans les années 1930 lorsque deux scientifiques américaines, Pearl Kendrick (1890-1980) et Grace Eldering (1900-1988), développent le premier vaccin efficace contre B. pertussis [4]. À la suite de leurs travaux pionniers, la recherche sur les vaccins avancera dans de nombreux pays et, dans les années 1940-1950, la plupart des pays développés intégreront un vaccin anticoquelucheux dans leur calendrier vaccinal. Les pays en voie de développement les rejoindront quelques années ou décennies plus tard.
À cette époque, les vaccins qui sont élaborés sont des vaccins cellulaires, également appelés vaccins à cellules entières (ou WCV, pour whole-cell vaccine). Ce procédé implique l’inactivation de la bactérie qui est ensuite injectée dans l’organisme. Cette méthode est alors considérée comme hautement efficace, mais elle peut induire des effets secondaires parfois dramatiques. Parmi ceux-ci, on recense des réactions inflammatoires locales, une fièvre légère ou, plus rarement, une fièvre élevée pouvant être accompagnée de convulsions et de vomissements [5-7]. Ces vaccins cellulaires ont également été suspectés d’être à l’origine d’encéphalopathies et responsables de cas de mort subite du nourrisson. Cependant, ces effets ont par la suite été dissociés de l’emploi des vaccins cellulaires (pour une revue des symptômes induits par la vaccination cellulaire, voir [8, 9]).
Néanmoins, en 1974-1975, au Japon, deux décès suivant l’administration d’un vaccin anticoquelucheux conduiront le gouvernement à suspendre temporairement l’utilisation des WCV [10]. Des chercheurs Japonais vont alors développer les premiers vaccins acellulaires (ACV, pour acellular vaccine). Ces vaccins entreront dans le calendrier vaccinal japonais en 1981 [10]. Les ACV se différencient des WCV par leur composition : alors que les WCV sont constitués de la bactérie entière ou de ses constituants, les ACV ne contiennent que quelques antigènes. Ces ACV sont ainsi considérés comme plus sûrs mais ils sont également plus onéreux que les WCV. Ils seront néanmoins adoptés par la majorité des pays développés dans les années 1990-2000, tandis que la plupart des pays en voie de développement continueront d’utiliser les traditionnels WCV. En France, les vaccins acellulaires seront d’abord introduits dans le calendrier vaccinal en 1998, pour être utilisés sous forme de rappels. Ils commenceront à être utilisés pour la primo-vaccination en 2001 et remplaceront totalement les WCV dès 2004 [11, 12].
Les antigènes inclus dans les ACV ont été sélectionnés pour leur rôle protecteur et leur immunogénicité. Ces antigènes sont au nombre de cinq : la toxine pertussique (PTX), l’hémagglutinine filamenteuse (FHA), la pertactine (PRN), et les fimbriae de type 2 et de type 3 (Fim2 et Fim3). Les vaccins actuellement sur le marché comprennent certains ou l’ensemble de ces antigènes : il existe ainsi des ACV contenant uniquement la PTX (ACV1), ou la PTX et la FHA (ACV2), ou la PTX, la FHA et la PRN (ACV3), ou les cinq antigènes (ACV5) ( Figure 1 ). Les vaccins anticoquelucheux actuellement commercialisés portent également des antigènes d’autres agents pathogènes, notamment Corynebacterium diphtheriae (agent de la diphtérie) et Clostridium tetani (agent du tétanos) (vaccins acellulaires DTaP ou cellulaires DTwP) [11]. En France, depuis 2018, les nouveau-nés sont vaccinés par un vaccin hexavalent protégeant contre la diphtérie, la coqueluche, le tétanos, la poliomyélite, l’infection à Haemophilus influenzae de type b et l’hépatite B [13].
 |
Figure 1. Composition en « poupées russes » des différents types de vaccins acellulaires utilisés. ACV : acellular vaccine ; PTX : toxine pertussique ; FHA : hémagglutinine filamenteuse ; PRN : pertactine ; FIM : fimbriae. |
Il existe donc deux grandes familles de vaccins anticoquelucheux : les vaccins cellulaires (historiques) et les vaccins acellulaires (plus récents) dont quatre types ont été développés. Les pays n’utilisent pas tous les mêmes vaccins, et cela a comme conséquence des pressions de sélection différentes menant à la sélection de nouvelles souches de B. pertussis.
Sélection de nouveaux allèles de B. pertussis après vaccination
Depuis environ deux décennies, plusieurs pays signalent une recrudescence des cas de coqueluche, malgré une couverture vaccinale généralement stable et élevée. Plusieurs études relient ces résurgences de l’infection à l’émergence de nouvelles souches de B. pertussis résultant de l’utilisation de vaccins [14-19].
Chez B. pertussis, la pertactine, une protéine de sa membrane externe, est codée par le gène prn. La toxine pertussique est quant à elle codée par différents gènes, dont ptxA. La majorité des vaccins utilisés dans le monde sont produits à partir de souches portant les l’allèle prn1 de prn, et l’allèle ptxA2 de ptxA. Il existe cependant des vaccins utilisant des souches pourvues d’autres allèles et l’allèle ptxA2 ne constitue que 54 % des souches vaccinales [20]. Lors de leur isolement, ces souches vaccinales présentaient le profil allélique typique des souches sauvages alors en circulation dans les populations, ce qui n’est plus le cas aujourd’hui.
L’allèle majoritaire de prn pendant la période pré-vaccinale, qui est utilisé aujourd’hui pour la formulation des vaccins, est l’allèle prn1. Depuis quelques années, l’émergence et la propagation d’un nouvel allèle, prn2, absent des vaccins, ont été largement documentées dans plusieurs pays comme l’Australie [21], le Japon [19], la Russie [22], le Royaume-Uni [23], la Suède [24] ou encore la Finlande [25]. Le lien entre la vaccination et l’émergence de ce nouvel allèle fait peu de doute, ce dernier apparaissant dans chacun de ces pays après l’introduction de la vaccination. Au Danemark, l’allèle prn2 a été détecté pour la première fois au début des années 1970, après l’introduction d’un WCV dans le pays. Cet allèle deviendra largement majoritaire dans les années 1990, jusqu’à ce que l’allèle prn1 disparaisse complétement en 2000. En 2003, le Danemark remplacera son vaccin cellulaire par un vaccin acellulaire, un ACV1, dépourvu de PRN. Quelques années plus tard, l’allèle prn1 sera de nouveau retrouvé dans les données épidémiologiques [26]. Il apparaît donc que, lorsqu’une population est immunisée par un vaccin contenant l’allèle prn1, l’allèle prn2 est favorisé. En revanche, en l’absence de pression vaccinale contre cet allèle, l’allèle prn1 reapparaît. Ce dernier confère certainement un avantage adaptatif à la bactérie au sein d’une population non immunisée contre la PRN.
La toxine pertussique est constituée de deux domaines : le domaine B, responsable de l’adhérence de la toxine à la surface de la cellule cible, et le domaine A, qui supporte l’activité enzymatique (toxique) de la protéine et pénètre dans la cellule [27]. Le domaine A est codé par le gène ptxA. L’allèle pré-vaccinal qui a été utilisé dans de nombreuses préparations vaccinales est l’allèle ptxA2. Cependant l’émergence d’un nouvel allèle, ptxA1, a été signalée dans de nombreux pays, dont le Danemark [26], l’Italie [28], le Japon [19] et le Royaume-Uni [23]. Comme pour l’allèle prn2 de prn, l’allèle ptxA1 a émergé dans ces pays suite à l’introduction des vaccins. L’exemple de la Serbie est, à ce titre, éclairant. La particularité de la Serbie est en effet d’avoir modifié la composition de son WCV au cours de son histoire. Jusqu’en 1985, le WCV serbe contenait deux souches exprimant ptxA2 et, au cours des années 1960 et 1970, on a pu observer l’émergence et la propagation de souches exprimant l’allèle ptxA1. En 1985, deux nouvelles souches contenant l’allèle ptxA1 ont été ajoutées au vaccin et la proportion de souches portant l’allèle ancestral ptxA2 a de nouveau augmenté [29]. L’utilisation de l’allèle ptxA2 dans les vaccins semble donc avoir exercé une pression de sélection favorisant un nouvel allèle, ptxA1. Cependant, l’ajout de ce nouvel allèle dans le WCV a créé un environnement propice à la réémergence de l’allèle ptxA2, bien qu’il soit toujours présent dans le vaccin. La réémergence de l’allèle ptxA2, pourtant présent dans les vaccins, est un phénomène qui n’a pas encore été compris. Si l’on compare à la PRN, le vaccin serbe utilisé avant 1985 contenait l’allèle prn1, et on a observé l’émergence de souches prn2. En 1985, deux souches prn2 ont été introduites dans le vaccin, causant alors l’émergence d’un nouvel allèle, prn11 [29]. Les causes de la sélection d’un nouvel allèle non vaccinal pour la PRN mais pas pour la PTX restent à déterminer.
Perte d’expression de la pertactine par B. pertussis
Un phénomène autre que l’émergence d’allèles non vaccinaux a également été décrit : la perte d’expression de la pertactine (PRN). En effet, l’émergence de souches déficientes en PRN (ou PRN-) a été signalée dans de nombreux pays. Les vaccins ACV et WCV ne semblent cependant pas exercer la même pression de sélection sur les souches PRN-.
Le Brésil et l’Argentine sont deux pays utilisant toujours des vaccins de type WCV. Des ACV sont également disponibles dans ces deux pays mais ils sont peu utilisés. En Argentine, une étude fondée sur 350 souches collectées entre 2000 et 2017 n’a mis en évidence que deux souches PRN- isolées en 2016, dont l’une provenait d’un bébé qui avait été vacciné par un ACV [30]. De même, au Brésil, l’étude de 511 souches collectées entre 2000 et 2016 n’a révélé que trois souches PRN- [31]. En Europe, la Russie et, dans une moindre mesure, la Pologne, utilisent toujours un WCV. En Russie, sur 75 souches collectées entre 2001 et 2009, aucune n’était PRN- [32]. En Pologne, cependant, parmi les 188 souches isolées entre 1959 et 2016, quatre d’entre elles étaient PRN-, ce qui représente 15,4 % des souches collectées sur la période 2010-2016. Notons que pendant cette période, la proportion d’ACV a dépassé celle des WCV pour la primo-vaccination dans ce pays. [33]. Les vaccins de type WCV ne semblent donc pas créer de pression de sélection en faveur des souches PRN-.
L’Australie et le Japon représentent deux exemples-type du rôle des ACV dans la sélection de souches PRN-. En Australie, les ACV (ACV3-5) ont remplacé totalement les WCV dès 1999. Les premières souches PRN- ont été identifiées en 2008, représentant alors 5 % des souches collectées [34]. Ce chiffre va rapidement augmenter pour atteindre 89,7 % sur la période 2013-2017 [35]. Le délai entre l’introduction de la vaccination par ACV et l’émergence des souches PRN- peut être dû au temps de renouvellement de la population et/ou au temps requis pour la perte de l’immunité acquise avec les vaccins WCV qui circulaient avant 1999.
Le Japon est le premier pays à avoir introduit la vaccination par ACV dans son calendrier vaccinal, dès 1981. C’est pendant la période 1995-1999 que les premières souches PRN- seront isolées, représentant alors 5 % des souches collectées. Cette proportion augmentera les années suivantes, pour culminer à 41 % des souches isolées entre 2005 et 2007 [36, 37]. Par la suite, la proportion de souches PRN- va continuellement diminuer, pour atteindre 8 % sur la période 2014-2016 [37]. Cette dynamique particulière peut s’expliquer par la composition des ACV utilisés au Japon. Avant 2012, cinq vaccins ACV circulaient au Japon, parmi lesquels seulement trois contenaient la PRN. En conséquence, une partie de la population n’a pas développé d’immunité vaccinale contre la PRN, expliquant la proportion faible de souches PRN- par rapport à l’Australie. En 2012 deux nouveaux vaccins dépourvus de PRN ont été mis sur le marché et largement distribués. Cela a conduit à ce que la plupart des enfants nés après cette date ne développent pas d’immunité contre la PRN, ce qui explique, en partie, la diminution de la proportion de souches PRN-, la pression de sélection ayant été relâchée. En 2015, de nouveaux vaccins comprenant la PRN ont été mis sur le marché. Il est donc possible qu’on observe à nouveau une augmentation de la prévalence des souches PRN- mais le manque de données ne permet pas de conclure pour l’instant.
L’Australie et le Japon ne sont que deux exemples de pays dans lesquels on retrouve ce phénomène d’émergence de souches PRN- à la suite de l’introduction des ACV. Celle-ci a été documentée dans d’autres pays, comme en Nouvelle-Zélande [38], aux États-Unis [39] ou au Canada [40]. En Europe, une corrélation temporelle a même été établie entre la durée depuis l’introduction de la vaccination et la proportion de souches PRN- en circulation [11].
La perte de la PRN semble résulter de modifications génétiques plutôt que d’une plasticité phénotypique : les souches perdent leur capacité à produire la PRN, et pas simplement à contrôler sa production. Parmi les mécanismes identifiés, on peut citer l’introduction d’éléments transposables dans la séquence codante du gène prn, des mutations non-sens, des délétions de séquences de plusieurs milliers de bases, ou encore une perte complète du gène prn [11, 36, 39]. Cela signifie que l’émergence de souches PRN- n’est pas issue de la propagation clonale d’une même souche, mais que plusieurs événements indépendants d’acquisition de la déficience en PRN ont lieu dans différents pays, voire au sein d’un même pays. Il s’agit donc d’un exemple typique de convergence évolutive, produisant un même résultat sans que son origine soit commune, indiquant une forte pression de sélection contre la production de la PRN ( Figure 2 ).
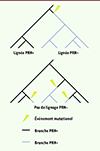 |
Figure 2. Deux scénarios d’apparition du phénotype « déficience en PRN ». En haut, le scénario de la dispersion monoclonale : la déficience en PRN (PRN-) apparaît une fois dans la phylogénie de Bordetella pertussis, et toutes les souches PRN- partagent le même ancêtre commun. En bas, le scénario de la convergence évolutive : la déficience en PRN apparaît plusieurs fois dans la phylogénie de B. pertussis par des mécanismes variés et les souches PRN- ne partagent pas d’ancêtre commun. PRN : pertactine. |
Surexpression de la toxine pertussique par B. pertussis
La toxine pertussique (PTX) est l’un des principaux facteurs de virulence de B. pertussis, et tous les vaccins, WCV comme ACV, contiennent la PTX. Dans la bactérie, la production de la toxine est contrôlée par l’opéron ptx, constitué de plusieurs gènes sous le contrôle du promoteur ptxP. En population pré-vaccinale, l’allèle majoritaire de ptxP était ptxP1. Cependant, depuis l’introduction de la vaccination, de nombreuses études ont signalé l’émergence d’un nouvel allèle, ptxP3, notamment en Australie [34], au Danemark [26], en Italie [28], au Japon [19], aux Pays-Bas [41] et en Suède [42].
L’allèle ptxP3 serait associé à une plus forte production de PTX et donc à une plus grande virulence [41]. L’émergence de souches produisant d’importantes quantités de PTX s’expliquerait par le mode d’action des vaccins acellulaires. Les ACV permettent d’éviter les formes graves de la coqueluche, en particulier par la production d’anticorps spécifiques de la toxine. En revanche, ils échoueraient à bloquer la colonisation et la transmission de la bactérie. Ils induisent en effet une réponse de type Th1/Th2 alors que l’immunité acquise naturellement ou induite par les WCV induit une réponse Th1/Th17, cette dernière permettant de réduire la colonisation [43].
Les ACV réduisent donc la mortalité associée à la production de la PTX (puisqu’ils diminuent les symptômes qu’elle induit) mais ne freinent pas la propagation de la bactérie. Celle-ci pourrait donc, en théorie, produire de très grandes quantités de toxine sans induire de formes graves de la maladie chez l’hôte vacciné. Des souches produisant plus de toxine - et donc, plus virulentes - pourraient donc être sélectionnées et émerger [44].
Course à l’armement contre les pathogènes
Il existe une théorie en biologie de l’évolution qui énonce que pour coexister dans un environnement, deux espèces antagonistes doivent continuellement s’adapter mutuellement. C’est la théorie dite de la « Reine Rouge » [45]. Dans le cas de la coqueluche, la sélection naturelle a fait son œuvre en sélectionnant des souches de B. pertussis capables de résister à l’immunité induite par les WCV. En revanche, pour l’espèce humaine, cible de la bactérie, aucune modification pouvant compenser cette évolution n’a pour l’instant été décrite.
Les vaccins WCV historiques ont progressivement été remplacés par les ACV. Ces nouveaux vaccins ne furent pas développés selon une approche évolutive mais plutôt selon une approche médicale. Leur objectif n’était pas de créer de nouvelles pressions contre la bactérie, étant donné que les souches employées pour produire les ACV sont généralement identiques à celles utilisées pour produire les WCV. L’objectif principal était donc plutôt d’obtenir des vaccins provoquant moins d’effets secondaires que les WCV tout en restant aussi efficaces. Alors que le premier point est globalement considéré comme une réussite par la communauté scientifique et médicale, le deuxième point a souvent été remis en question dans la littérature scientifique et reste encore débattu. Des expériences sur les babouins ont montré que les ACV échouent à protéger contre l’infection par la bactérie et sa transmission [43]. Des observations au sein de la population humaine remettent néanmoins en question cette conclusion, l’utilisation massive des ACV étant associée à une diminution des cas de coqueluche dans les pays utilisant cette forme de vaccin [46].
Conclusion
Au cours des décennies suivant l’introduction des vaccins anticoquelucheux, au milieu du xxe siècle, le génotype et le phénotype des souches circulantes de B. pertussis ont été modifiés. L’allèle prn1, majoritairement exprimé par les souches avant l’avènement des vaccins, a été remplacé par l’allèle prn2, et l’allèle ptxA2 par l’allèle ptxA1. Les vaccins acellulaires ACV entraînent la sélection de souches ne produisant plus la pertactine, l’un des antigènes communément inclus dans ces vaccins, et de nouvelles souches, produisant plus de toxine pertussique, ont émergé.
Les vaccins représentent certainement la plus puissante des armes dont dispose l’humanité pour combattre les agents pathogènes, suivie de près par les antibiotiques. L’efficacité de certains vaccins reçoit depuis quelques décennies le contre-coup de l’évolution. Face aux promesses d’un monde où il serait possible d’éliminer les maladies à prévention vaccinale, la sélection complique cette tâche prométhéenne et nous rappelle que le vivant est plongé dans une lutte constante pour survivre et se reproduire, favorisant les microbes capables d’évoluer afin d’échapper au filtre des antibiotiques ou des vaccins.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Linz B, Ivanov YV, Preston A, et al. Acquisition and loss of virulence-associated factors during genome evolution and speciation in three clades of Bordetella species. BMC Genomics 2016 ; 17 : 767. [CrossRef] [PubMed] [Google Scholar]
- Choi YH, Campbell H, Amirthalingam G, et al. Investigating the pertussis resurgence in England and Wales, and options for future control. BMC Med 2016 ; 14 : 121. [CrossRef] [PubMed] [Google Scholar]
- Guiso N. Impact de la vaccination sur l’épidémiologie des maladies infectieuses : exemple de la coqueluche. Med Sci (Paris) 2007 ; 23 : 399–403. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Shapiro-Shapin CG. Pearl Kendrick, Grace Eldering, and the Pertussis Vaccine. Emerg Infect Dis 2010 ; 16 : 1273–1278. [CrossRef] [PubMed] [Google Scholar]
- Miller CL, Pollock TM, Clewer ADE. Whooping-cough vaccination : An assessment. Lancet 1974 ; 304 : 510–513. [CrossRef] [Google Scholar]
- Cody CL, Baraff LJ, Cherry JD, et al. Nature and Rates of Adverse Reactions Associated with DTP and DT Immunizations in Infants and Children. Pediatrics 1981 ; 68 : 650–660. [CrossRef] [PubMed] [Google Scholar]
- Strom J. Further experience of reactions, especially of a cerebral nature, in conjunction with triple vaccination : a study based on vaccinations in Sweden 1959–65. BMJ 1967 ; 4 : 320–323. [CrossRef] [PubMed] [Google Scholar]
- Boulesteix J. Tolérance et efficacité du vaccin anti-coquelucheux entier. Médecine et Maladies Infectieuses 1995 ; 25 : 1299–1304. [CrossRef] [Google Scholar]
- Trollfors B. Bordetella Pertussis Whole Cell Vaccines-Efficacy and Toxicity. Acta Paediatrica 1984 ; 73 : 417–425. [CrossRef] [Google Scholar]
- Nakayama T. Vaccine chronicle in Japan. J Infect Chemother 2013 ; 19 : 787–798. [CrossRef] [PubMed] [Google Scholar]
- Barkoff A-M, Mertsola J, Pierard D, et al. Pertactin-deficient Bordetella pertussis isolates : evidence of increased circulation in Europe, 1998 to 2015. Eurosurveillance 2019; 24 : 1700832. [Google Scholar]
- Belchior E, Guillot S, Poujol I, et al. Comparison of whole-cell versus acellular pertussis vaccine effectiveness in school clusters of pertussis, France, 2013. Médecine et Maladies Infectieuses 2020; 50 : 617–9. [CrossRef] [Google Scholar]
- Ministère de la Santé et de la Prévention. Calendrier des vaccinations et recommandations vaccinales 2023. Paris, 2023. https://sante.gouv.fr/prevention-en-sante/preserver-sa-sante/vaccination/calendrier-vaccinal. [Google Scholar]
- Lefrancq N, Bouchez V, Fernandes N, et al. Global spatial dynamics and vaccine-induced fitness changes of Bordetella pertussis. Sci Transl Med 2022; 14 : eabn3253. [CrossRef] [PubMed] [Google Scholar]
- Brandal LT, Vestrheim DF, Bruvik T et al. Evolution of Bordetella pertussis in the acellular vaccine era in Norway, to 2019. Eur J Clin Microbiol Infect Dis 1996 ; 2022(41): 913–924. [Google Scholar]
- Lesne E, Cavell BE, Freire-Martin I, et al. Acellular Pertussis Vaccines Induce Anti-pertactin Bactericidal Antibodies Which Drives the Emergence of Pertactin-Negative Strains. Front Microbiol 2020; 11 : 2108. [CrossRef] [PubMed] [Google Scholar]
- Jayasundara D, Lee E, Octavia S, et al. Emergence of pertactin-deficient pertussis strains in Australia can be explained by models of vaccine escape. Epidemics 2020; 31 : 100 388. [Google Scholar]
- Etskovitz H, Anastasio N, Green E, et al. Role of Evolutionary Selection Acting on Vaccine Antigens in the Re-Emergence of Bordetella Pertussis. Diseases 2019 ; 7 : 35. [CrossRef] [PubMed] [Google Scholar]
- Zomer A, Otsuka N, Hiramatsu Y, et al. Bordetella pertussis population dynamics and phylogeny in Japan after adoption of acellular pertussis vaccines. Microb Genom 2018 ; 4 : e000180. [PubMed] [Google Scholar]
- Bart MJ, Harris SR, Advani A, et al. Global Population Structure and Evolution of Bordetella pertussis and Their Relationship with Vaccination. mBio 2014; 5 : e01074–14. [PubMed] [Google Scholar]
- Octavia S, Sintchenko V, Gilbert GL, et al. Newly Emerging Clones of Bordetella pertussis Carrying prn2 and ptxP3 Alleles Implicated in Australian Pertussis Epidemic in 2008–2010. J Infect Dis 2012 ; 205 : 1220–1224. [CrossRef] [PubMed] [Google Scholar]
- Borisova O, Kombarova SY, Zakharova NS, et al. Antigenic Divergence between Bordetella pertussis Clinical Isolates from Moscow, Russia, and Vaccine Strains. Clin Vaccine Immunol 2007 ; 14 : 234–238. [CrossRef] [PubMed] [Google Scholar]
- Fry NK, Neal S, Harrison TG, et al. Genotypic Variation in the Bordetella pertussis Virulence Factors Pertactin and Pertussis Toxin in Historical and Recent Clinical Isolates in the United Kingdom. Infect Immun 2001 ; 69 : 5520–5528. [CrossRef] [PubMed] [Google Scholar]
- Hallander HO, Advani A, Donnelly D, et al. Shifts of Bordetella pertussis Variants in Sweden from 1970 to 2003, during Three Periods Marked by Different Vaccination Programs. J Clin Microbiol 2005 ; 43 : 2856–2865. [CrossRef] [PubMed] [Google Scholar]
- Elomaa A, Advani A, Donnelly D, et al. Strain Variation among Bordetella pertussis Isolates in Finland, Where the Whole-Cell Pertussis Vaccine Has Been Used for 50 Years. J Clin Microbiol 2005 ; 43 : 3681–3687. [CrossRef] [PubMed] [Google Scholar]
- Petersen RF, Dalby T, Dragsted DM, et al. Temporal Trends in Bordetella pertussis Populations, Denmark, 1949–2010. Emerg Infect. Dis 2012 ; 18 : 767–774. [Google Scholar]
- Scanlon K, Skerry C, Carbonetti N. Role of Major Toxin Virulence Factors in Pertussis Infection and Disease Pathogenesis In: Fedele G, Ausiello CM editors. Pertussis Infection and Vaccines. Advances in Experimental Medicine and Biology. Cham: Springer International Publishing, 2019 : 35–51. [CrossRef] [PubMed] [Google Scholar]
- Loconsole D, De Robertis AL, Morea A, et al. Resurgence of pertussis and emergence of the ptxP3 toxin promoter allele in South Italy. Pediat Infect Dis J 2018 ; 37 : e126–e131. [CrossRef] [PubMed] [Google Scholar]
- Dakic G, Kallonen T, Elomaa A, et al. Bordetella pertussis vaccine strains and circulating isolates in Serbia. Vaccine 2010 ; 28 : 1188–1192. [CrossRef] [PubMed] [Google Scholar]
- Carriquiriborde F, Regidor V, Aispuro PM, et al. Rare Detection of Bordetella pertussis Pertactin-Deficient Strains in Argentina. Emerg Infect Dis 2019 ; 25 : 2048–2054. [CrossRef] [PubMed] [Google Scholar]
- Leite D, Camargo CH, Kashino SS, et al. Prevalence and characterization of pertactin deficient Bordetella pertussis strains in Brazil, a whole-cell vaccine country. Vaccine : X 2021; 8 : 100103. [CrossRef] [Google Scholar]
- Kurova N, Njamkepo E, Brun D, et al. Monitoring of Bordetella isolates circulating in Saint Petersburg, Russia between 2001 and 2009. Res Microbiol 2010 ; 161 : 810–815. [CrossRef] [PubMed] [Google Scholar]
- Polak M, Zasada AA, Mosiej E, et al. Pertactin-deficient Bordetella pertussis isolates in Poland — a country with whole-cell pertussis primary vaccination. Microbes Infect 2019 ; 21 : 170–175. [CrossRef] [PubMed] [Google Scholar]
- Lam C, Octavia S, Ricafort L, et al. Rapid Increase in Pertactin-deficient Bordetella pertussis Isolates. Australia. Emerg Infect Dis 2014 ; 20 : 626–633. [Google Scholar]
- Xu Z, Octavia S, Luu LDW, et al. Pertactin-Negative and Filamentous Hemagglutinin-Negative Bordetella pertussis, Australia, 2013–2017. Emerg Infect Dis 2019 ; 25 : 1196–1199. [CrossRef] [PubMed] [Google Scholar]
- Otsuka N, Han H-J, Toyoizumi-Ajisaka H, et al. Prevalence and genetic characterization of pertactin-deficient Bordetella pertussis in Japan. PLoS ONE 2012 ; 7 : e31985. [CrossRef] [PubMed] [Google Scholar]
- Hiramatsu Y, Miyaji Y, Otsuka N, et al. Significant Decrease in Pertactin-Deficient Bordetella pertussis Isolates. Japan. Emerg Infect Dis 2017 ; 23 : 699–701. [CrossRef] [PubMed] [Google Scholar]
- Ring N, Davies H, Morgan J, et al. Comparative genomics of Bordetella pertussis isolates from New Zealand, a country with an uncommonly high incidence of whooping cough. Microb Genom 2022; 8 : 000756. [PubMed] [Google Scholar]
- Pawloski LC, Queenan AM, Cassiday PK, et al. Prevalence and Molecular Characterization of Pertactin-Deficient Bordetella pertussis in the United States. Clin Vaccine Immunol 2014 ; 21 : 119–125. [CrossRef] [PubMed] [Google Scholar]
- Tsang RSW, Shuel M, Cronin K, et al. The evolving nature of Bordetella pertussis in Ontario, Canada, 2009–2017: strains with shifting genotypes and pertactin deficiency. Can J Microbiol 2019 ; 65 : 823–830. [CrossRef] [PubMed] [Google Scholar]
- Mooi FR, van Loo IHM, van Gent M, et al. Bordetella pertussis Strains with Increased Toxin Production Associated with Pertussis Resurgence. Emerg Infect Dis 2009 ; 15 : 1206–1213. [CrossRef] [PubMed] [Google Scholar]
- Advani A, Gustafsson L, Åhrén C, et al. Appearance of Fim3 and ptxP3-Bordetella pertussis strains, in two regions of Sweden with different vaccination programs. Vaccine 2011 ; 29 : 3438–3442. [CrossRef] [PubMed] [Google Scholar]
- Warfel JM, Zimmerman LI, Merkel TJ. Acellular pertussis vaccines protect against disease but fail to prevent infection and transmission in a nonhuman primate model. Proc Natl Acad Sci USA 2014 ; 111 : 787–792. [CrossRef] [PubMed] [Google Scholar]
- Gandon S, Mackinnon MJ, Nee S, et al. Imperfect vaccines and the evolution of pathogen virulence. Nature 2001 ; 414 : 751–756. [CrossRef] [PubMed] [Google Scholar]
- Van Valen L.A new evolutionary law. Evolutionary Theory 1973 ; 1 : 1–30. [Google Scholar]
- Domenech de Cellès M, Magpantay FMG, King AA, et al. The pertussis enigma : reconciling epidemiology, immunology and evolution. Proc R Soc B 2016; 283 : 20 152 309. [Google Scholar]
Liste des figures
 |
Figure 1. Composition en « poupées russes » des différents types de vaccins acellulaires utilisés. ACV : acellular vaccine ; PTX : toxine pertussique ; FHA : hémagglutinine filamenteuse ; PRN : pertactine ; FIM : fimbriae. |
| Dans le texte | |
 |
Figure 2. Deux scénarios d’apparition du phénotype « déficience en PRN ». En haut, le scénario de la dispersion monoclonale : la déficience en PRN (PRN-) apparaît une fois dans la phylogénie de Bordetella pertussis, et toutes les souches PRN- partagent le même ancêtre commun. En bas, le scénario de la convergence évolutive : la déficience en PRN apparaît plusieurs fois dans la phylogénie de B. pertussis par des mécanismes variés et les souches PRN- ne partagent pas d’ancêtre commun. PRN : pertactine. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




