| Issue |
Med Sci (Paris)
Volume 39, Number 12, Décembre 2023
|
|
|---|---|---|
| Page(s) | 928 - 930 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2023173 | |
| Published online | 18 December 2023 | |
Sécrétion hormonale des phéochromocytomes
Une dangereuse histoire d’exocytose mal contrôlée
Hormone secretion in pheochromocytoma: A dangerous story of poorly controlled vesicular exocytosis
1
CNRS, université de Strasbourg, institut des neurosciences cellulaires et intégratives, Strasbourg, France
2
Département de chirurgie viscérale, métabolique et cancérologique, Inserm NGERE-U1256, université de Lorraine, centre hospitalier régional universitaire de Nancy, hôpital Brabois adultes, Vandœuvre-lès-Nancy, France
Regroupées sous forme glandulaire ou disséminées dans l’organisme, les cellules neuroendocrines libèrent des hormones dans la circulation sanguine, et contrôlent ainsi de nombreuses fonctions vitales. Après avoir été synthétisées dans la cellule, ces hormones sont stockées à l’intérieur de grandes vésicules : les granules de sécrétion. La sécrétion neuroendocrine est déclenchée par un processus d’exocytose étroitement contrôlé, dépendant de la concentration locale de l’ion calcium. L’étape ultime est la fusion des granules de sécrétion avec la membrane plasmique, entraînant la libération extracellulaire des hormones contenues dans ces granules (Figure 1). Les tumeurs neuroendocrines s’accompagnent fréquemment d’un dysfonctionnement de cette sécrétion à l’origine d’une hypersécrétion hormonale anarchique, qui peut avoir de graves conséquences médicales pour les personnes développant ces tumeurs [1].
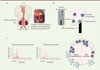 |
Figure 1. Analyse de la sécrétion de cellules de phéochromocytomes humains et de cellules chromaffines non tumorales par ampérométrie à fibre de carbone. A. Le phéochromocytome dérive des cellules chromaffines constituant la partie médullaire de la glande surrénale. L’image montre une glande surrénale humaine, coupée en deux longitudinalement, dans laquelle s’est développé un phéochromocytome, repérable à sa couleur rouge foncé caractéristique (astérisque). B..Les cellules de phéochromocytomes ainsi que les cellules chromaffines non tumorales (prélevées en dehors de la zone tumorale) sont mises en culture, puis leur activité sécrétrice est enregistrée individuellement par ampérométrie à fibre de carbone. La cellule est stimulée par une molécule induisant la sécrétion grâce à une pipette de stimulation placée à proximité. Les granules de sécrétion qui contiennent les catécholamines fusionnent avec la membrane plasmique pour libérer le contenu granulaire. L’oxydation des catécholamines est alors détectée par la fibre de carbone placée au contact de la cellule. C. Exemples d’enregistrements ampérométriques d’une cellule de phéochromocytome humain et d’une cellule non tumorale, stimulées pendant 10 secondes par une application de nicotine 100 µM. Chaque pic (traits rouges) correspond à la libération d’un granule de sécrétion, et renseigne donc sur le nombre d’évènements d’exocytose dans la cellule. Noter le plus grand nombre de pics ampérométriques pour la cellule tumorale, indiquant une exocytose plus active que celle de la cellule non tumorale. |
Le phéochromocytome est une tumeur neuroendocrine qui se développe à partir des cellules chromaffines de la glande médullosurrénale (Figure 1A), et qui se caractérise par une sécrétion excessive de catécholamines (principalement noradrénaline et adrénaline). Les personnes ayant un phéochromocytome présentent généralement une triade symptomatique typique (céphalées, palpitations et sudation), liée à un excès de catécholamines circulantes. Elles risquent également de développer une hypertension artérielle sévère ainsi que des complications cardiaques, telles que des myocardites et cardiomyopathies [2]. La prévalence du phéochromocytome dans les autopsies est d’environ 1/2 000, tandis que son incidence dans la population générale est inférieure à 1 nouveau cas par an pour 100 000 personnes, ce qui suggère que cette tumeur est sous-diagnostiquée [3].
Étonnamment, aucune étude n’avait jusqu’alors été réalisée afin de caractériser les mécanismes cellulaires et moléculaires qui induisent et maintiennent l’hypersécrétion hormonale des phéochromocytomes. A priori, il pourrait s’agir d’un simple effet de masse dû à la prolifération des cellules tumorales au sein de la glande médullosurrénale. On peut cependant douter qu’une augmentation du nombre de cellules entraîne nécessairement une augmentation de la sécrétion hormonale. Une autre possibilité impliquerait un dérèglement de la sécrétion, permettant aux cellules tumorales d’échapper au contrôle physiologique de ce processus. Afin de tester cette hypothèse, nous avons mis en culture des cellules tumorales de phéochromocytomes humains prélevées lors de l’exérèse chirurgicale, et nous avons analysé l’activité sécrétrice de ces cellules individuellement en utilisant la technique d’ampérométrie à fibre de carbone [4] (Figure 1B). Cette technique électrochimique n’avait jusqu’alors jamais été utilisée pour analyser des cellules tumorales de phéochromocytome humain. Elle est pourtant appropriée à l’étude de ces cellules, car elle permet de mesurer, à l’échelle unicellulaire, le nombre d’évènements d’exocytose et leur cinétique, et de calculer la quantité moyenne de catécholamines libérée par granule de sécrétion [5].
Par cette technique, nous avons montré que pour 73 % des phéochromocytomes testés, les cellules tumorales présentent entre deux et quatre fois plus d’évènements d’exocytose que les cellules non tumorales (Figure 1C). De plus, l’analyse de la cinétique des signaux ampérométriques nous a permis de conclure que la sécrétion des catécholamines par les cellules tumorales de certains patients est plus rapide [4]. Ces résultats montrent que l’hypersécrétion de catécholamines par les phéochromocytomes est due, au moins en partie, à une augmentation du nombre et de la vitesse des évènements d’exocytose par cellule tumorale1. Au cours d’une autre étude, nous avons également mis en évidence une corrélation entre l’intensité du signal tumoral de 18F-FDOPA, un traceur radioactif utilisé en imagerie médicale pour le diagnostic du phéochromocytome, et la mesure ampérométrique de l’exocytose des cellules tumorales chez les mêmes patients. Ce résultat suggère que la suractivité d’exocytose des catécholamines dans les cellules tumorales s’accompagne d’une augmentation de la captation de 18F-FDOPA par ces cellules. Ainsi la mesure de cette captation pourrait-elle constituer un indicateur du taux d’hypersécrétion de la tumeur [6].
Afin d’identifier les acteurs moléculaires de ce dérèglement de la sécrétion des catécholamines, nous avons réalisé une analyse protéomique par spectrométrie de masse et établi le profil d’expression différentiel des fractions protéiques membranaires et cytosoliques préparées à partir de phéochromocytomes et du tissu médullosurrénalien non tumoral issu des mêmes personnes. Cette analyse a révélé une modification significative de l’expression de 175 protéines impliquées dans le processus d’exocytose des granules de sécrétion ou dans le métabolisme des catécholamines [4]. Parmi les protéines les plus surexprimées dans les tumeurs, on trouve des protéines contrôlant différentes étapes du trafic des granules de sécrétion, incluant leur transport dans la cellule, leur arrimage aux sites d’exocytose, leur amorçage et leur fusion avec la membrane plasmique [4]. En analysant une étude transcriptomique précédemment réalisée sur 60 phéochromocytomes et 6 médullosurrénales saines, nous avons identifié 64 gènes codant des protéines dont l’expression varie entre cellules tumorales et non tumorales dans notre étude protéomique [7]. Le taux d’expression de 58 de ces 64 gènes (91 %) variait dans le même sens que l’expression protéique codée par ces gènes, validant ainsi la robustesse de notre crible protéomique. Il est donc probable que l’augmentation de la sécrétion hormonale dans les cellules de phéochromocytome résulte, au moins en partie, d’une expression anormale des gènes impliqués dans le contrôle de l’exocytose. Nos travaux ont ainsi permis de mieux comprendre la perte du contrôle de la sécrétion des catécholamines dans les cellules de phéochromocytome. Il reste à préciser quelles étapes de l’exocytose sont impliquées dans l’hypersécrétion qui caractérise ces cellules tumorales. Il conviendra également d’étudier si des mécanismes similaires sont à l’origine de l’hypersécrétion hormonale dans d’autres types de tumeurs neuroendocrines.
L’hypersécrétion de catécholamines par la tumeur est un aspect important à prendre en compte dans la prise en charge médicale des personnes ayant un phéochromocytome. Aujourd’hui, en attendant l’exérèse chirurgicale de la tumeur, un traitement anti-hypertenseur (principalement avec des inhibiteurs de canaux calciques, α-bloquants et β-bloquants) est instauré afin d’agir sur les conséquences de cette sécrétion excessive. Il conviendrait cependant d’envisager un traitement capable d’inhiber directement et spécifiquement l’hypersécrétion du phéochromocytome. Des résultats préliminaires obtenus in vitro indiquent que le pasiréotide, un analogue de la somatostatine actuellement prescrit pour traiter les personnes présentant une acromégalie ou une maladie de Cushing, réduit efficacement la sécrétion des catécholamines par les cellules de phéochromocytomes humains en diminuant le nombre d’évènements d’exocytose [8]. Un traitement préchirurgical (ou même peropératoire) agissant directement sur cette sécrétion dans les cellules tumorales pourrait être préconisé pour des patients présentant un phéochromocytome à très forte activité sécrétrice ou un phéochromocytome métastatique résistant aux médicaments anti-hypertenseurs ou inhibiteurs calciques conventionnels, d’autant plus qu’une sécrétion excessive de catécholamines a aussi un impact négatif sur la survie des patients présentant un phéochromocytome métastatique [9].
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Une courte présentation vidéo de ce travail de recherche par Stéphane Gasman est disponible sur YouTube (https://www.youtube.com/watch?v=ir0jy1lK27c).
Références
- Gratzl M, Breckner M, Prinz C. Mechanisms of storage and exocytosis in neuroendocrine tumors. Endocr Pathol 2004 ; 15 : 1–16. [Google Scholar]
- Farrugia FA, Charalampopoulos A. Pheochromocytoma. Endocr Regul 2019 ; 53 : 191–212. [CrossRef] [PubMed] [Google Scholar]
- Platts JK, Drew PJ, Harvey JN. Death from phaeochromocytoma: lessons from a post-mortem survey. J R Coll Physicians Lond 1995 ; 29 : 299–306. [PubMed] [Google Scholar]
- Houy S, Streit L, Drissa I, et al. Dysfunction of calcium-regulated exocytosis at a single-cell level causes catecholamine hypersecretion in patients with pheochromocytoma. Cancer Lett 2022; 215765. [CrossRef] [PubMed] [Google Scholar]
- Mosharov EV, Sulzer D. Analysis of exocytotic events recorded by amperometry. Nat Methods 2005 ; 2 : 651–658. [CrossRef] [PubMed] [Google Scholar]
- Moog S, Houy S, Chevalier E, et al. 18F-FDOPA PET/CT uptake parameters correlate with catecholamine secretion in human pheochromocytomas. Neuroendocrinology 2018 ; 107 : 228–236. [CrossRef] [PubMed] [Google Scholar]
- Lopez-Jimenez E, Gomez-Lopez G, Leandro-Garcia LJ, et al. Research resource: Transcriptional profiling reveals different pseudohypoxic signatures in SDHB and VHL-related pheochromocytomas. Mol Endocrinol 2010 ; 24 : 2382–2391. [CrossRef] [PubMed] [Google Scholar]
- Streit L, Moog S, Hugel S, et al. Somatostatin analogue pasireotide (SOM230) inhibits catecholamine secretion in human pheochromocytoma cells. Cancer Lett 2021; 524 : 232–44. [Google Scholar]
- Hescot S, Curras-Freixes M, Deutschbein T, et al. Prognosis of malignant pheochromocytoma and paraganglioma (MAPP-Prono study): A European network for the study of adrenal tumors retrospective study. J Clin Endocrinol Metab 2019 ; 104 : 2367–2374. [CrossRef] [PubMed] [Google Scholar]
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Analyse de la sécrétion de cellules de phéochromocytomes humains et de cellules chromaffines non tumorales par ampérométrie à fibre de carbone. A. Le phéochromocytome dérive des cellules chromaffines constituant la partie médullaire de la glande surrénale. L’image montre une glande surrénale humaine, coupée en deux longitudinalement, dans laquelle s’est développé un phéochromocytome, repérable à sa couleur rouge foncé caractéristique (astérisque). B..Les cellules de phéochromocytomes ainsi que les cellules chromaffines non tumorales (prélevées en dehors de la zone tumorale) sont mises en culture, puis leur activité sécrétrice est enregistrée individuellement par ampérométrie à fibre de carbone. La cellule est stimulée par une molécule induisant la sécrétion grâce à une pipette de stimulation placée à proximité. Les granules de sécrétion qui contiennent les catécholamines fusionnent avec la membrane plasmique pour libérer le contenu granulaire. L’oxydation des catécholamines est alors détectée par la fibre de carbone placée au contact de la cellule. C. Exemples d’enregistrements ampérométriques d’une cellule de phéochromocytome humain et d’une cellule non tumorale, stimulées pendant 10 secondes par une application de nicotine 100 µM. Chaque pic (traits rouges) correspond à la libération d’un granule de sécrétion, et renseigne donc sur le nombre d’évènements d’exocytose dans la cellule. Noter le plus grand nombre de pics ampérométriques pour la cellule tumorale, indiquant une exocytose plus active que celle de la cellule non tumorale. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




