| Issue |
Med Sci (Paris)
Volume 39, Number 12, Décembre 2023
|
|
|---|---|---|
| Page(s) | 921 - 923 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2023168 | |
| Published online | 18 December 2023 | |
« A star is reborn »
Nouvelles avancées sur les fonctions de la cellule étoilée du foie
A star is reborn : New advances on the functions of the hepatic stellate cell
Centre de recherche sur l’inflammation, Inserm U 1149, université Paris Cité, faculté de médecine, site Bichat, Paris, France
Initialement, la cellule étoilée du foie avait un nom moins poétique, le lipocyte, en référence à son contenu très riche en vacuoles lipidiques. Découverte par Kupffer en 1876, elle fut décrite par l’anatomopathologiste japonais Ito dans les espaces périsinusoïdaux de Disse, qui séparent les hépatocytes des cellules endothéliales (Figure 1). Dans le foie normal, la cellule étoilée représente environ 5 à 8 % des cellules hépatiques, et stocke l’essentiel de la vitamine A de l’organisme au sein de ses gouttelettes lipidiques. Dans les années 1980, plusieurs groupes lui attribuèrent une bien plus mauvaise réputation en lui faisant jouer le « rôle titre » dans la fibrogenèse. Depuis lors, les chercheurs se sont surtout focalisés sur cette activité fibrogénique des cellules étoilées, essayant de décrypter le mécanisme du contrôle de leur activation. Lors d’une agression aiguë ou chronique du foie, les cellules étoilées perdent leur contenu en vitamine A et acquièrent un phénotype myofibroblastique leur conférant une activité de prolifération, de contractilité, de production en excès de matrice extracellulaire, en particulier de collagène, et de sécrétion de facteurs inflammatoires et immunomodulateurs (Figure 2). Si la lésion hépatique persiste, l’activation des cellules étoilées aboutit à la formation d’une cicatrice fibreuse. En revanche, lorsque l’agression hépatique cesse, la fibrose peut régresser, les myofibroblastes mourant alors par apoptose ou sénescence, ou retournant à leur phénotype quiescent initial [1].
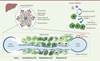 |
Figure 1. Représentation d’un lobule hépatique et des cellules étoilées contenues dans l’espace de Disse. Les cellules étoilées sécrètent la neurotrophine-3 (NT-3) qui, via le récepteur TRKB de l’hépatocyte, induit la synthèse de la cycline D1 et la prolifération hépatocytaire. La présence plus abondante du récepteur TRKB à la surface des hépatocytes de la zone 2 explique leur capacité proliférative accrue par rapport à ceux des deux autres zones. |
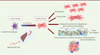 |
Figure 2. Les cellules étoilées du foie activées lors d’une agression hépatique induisent une mort des hépatocytes. Les cellules étoilées acquièrent alors un phénotype myofibroblastique, caractérisé par : prolifération, contractilité, production en excès de matrice extracellulaire, chimiotactisme, et sécrétion de facteurs inflammatoires et immunomodulateurs aboutissant à une fibrose hépatique. |
La cellule étoilée : un acteur majeur du renouvellement hépatocytaire
Ainsi, depuis presque quarante ans, c’est bien plus le versant Mr Hyde des cellules étoilées que celui du Dr Jekyll qui fit l’objet des articles scientifiques les concernant. Il était temps de nuancer ce tableau à charge ! Les cellules étoilées relarguent un grand nombre de facteurs de croissance comme HGF (hepatocyte growth factor), WNT9A ou VEGF (vascular endothelial growth factor), connus pour induire la prolifération hépatocytaire [2]. À ce titre, il était déjà établi qu’elles contribuent à la régénération hépatique. De fait, les rongeurs dont l’activation des cellules étoilées a été empêchée expérimentalement présentent un défaut de régénération du foie. Depuis, des travaux récents de transcriptomique 2.0 (analyse à l’échelle unicellulaire) ont révélé une hétérogénéité des cellules étoilées le long du lobule hépatique [3], qui est l’unité fonctionnelle du foie. Le lobule hépatique est limité d’un côté par une veine centrale, et de l’autre par une veine porte, une artère hépatique et un canal biliaire. Entre ces deux pôles s’échelonnent des travées d’hépatocytes adossés aux cellules endothéliales, et dont les fonctions diffèrent en fonction de leur localisation dans le lobule, définissant la zonation du foie [4] (→).
(→) Voir la Nouvelle de S. Benhamouche et al., m/s n° 11, novembre 2006, page 904
On distingue ainsi trois zones du lobule : une zone périportale (zone 1), dans laquelle les hépatocytes assurent la gluconéogenèse et la β-oxydation, une zone centrolobulaire (zone 3), responsable notamment de la glycolyse, de la lipogenèse et de la biosynthèse des acides biliaires, et une zone médiolobulaire (zone 2), dont les hépatocytes jouent un rôle essentiel dans le métabolisme du fer, de l’insuline et des xénobiotiques [5–7]. Le foie est un organe quiescent : le renouvellement des hépatocytes y est lent (leur durée de vie est d’environ 300 jours). Après bien des débats contradictoires, il semble que les hépatocytes de la zone médiolobulaire détiennent la palme des meilleures capacités prolifératives homéostatiques (i.e., en dehors d’un contexte d’agression hépatique) [8, 9]. Mais par quel mécanisme ? Une collaboration entre plusieurs équipes américaines a permis de montrer, par une stratégie d’ablation cellulaire beaucoup plus efficace que toutes celles utilisées jusqu’alors, que la sécrétion de la neurotrophine 3 par les cellules étoilées stimule la prolifération préférentielle des hépatocytes de cette zone [10].
Un scénario digne de « Star wars » !
Les auteurs ont injecté des lymphocytes T ciblant et détruisant spécifiquement les cellules produisant la protéine EGFP (enhanced green fluorescent protein), qu’ils ont avec humour appelés Jedi (pour just eGFP death-inducing T cells), à des souris synthétisant cette protéine sous le contrôle du promoteur du gène Pdgfrb (platelet-derived growth factor receptor β), dont l’expression est spécifique des cellules étoilées. La quasi-totalité des cellules étoilées était ainsi détruite en dix jours, conduisant à une diminution progressive de la masse hépatique, de l’expression globale hépatocytaire de la cycline D1, et à une perte de la prolifération des hépatocytes de la zone 2 du foie quiescent [10]. L’analyse comparée des foies déplétés en cellules étoilées et des foies témoins a permis d’identifier la neurotrophine 3 (NT-3) comme le principal agent mitogène responsable de l’activation de la cycline D1 et de la prolifération hépatocytaire, via le récepteur TRKB (tropomyosine-related kinase), un récepteur à activité tyrosine kinase dont les neurotrophines sont les ligands (Figure 1). Les cellules étoilées sont réparties le long de l’axe porto-central du lobule hépatique, où elles semblent produire NT-3 de façon homogène. Ainsi, si l’effet prolifératif induit par les cellules étoilées est limité aux hépatocytes de la zone 2, c’est parce que ceux-ci sont enrichis en TRKB (Figure 1). Les auteurs ont vérifié que l’administration exogène de NT-3 permettait de restaurer l’expression de la cycline D1 et la masse hépatocytaire des souris dont le foie est dépourvu de cellules étoilées. Il est fort probable que d’autres mitogènes participent néanmoins au maintien de la masse hépatocytaire, la déplétion des cellules étoilées étant également responsable d’une diminution significative de l’expression de gènes cibles de la voie de signalisation Wnt [10]. De même, peut-on anticiper l’existence d’un dialogue, essentiel à la zonation métabolique du foie, entre cellules étoilées et cellules endothéliales. En attendant de mieux comprendre ces interactions, replacer les cellules étoilées au cœur de l’homéostasie hépatique a permis qu’elles retrouvent un peu de leur aura.
Complexité du rôle des cellules étoilées au cours de l’hépato-carcinogenèse
Les cellules étoilées semblent jouer un rôle complexe dans la carcinogenèse. C’est ce que montre en effet un article publié en 2022 [11]. Si la plupart des publications suggéraient jusqu’ici un rôle pro-oncogénique des cellules étoilées activées, le mécanisme restait inconnu, et l’induction de leur sénescence avait même donné des résultats contradictoires, restreignant pour certains, ou au contraire promouvant pour d’autres, le cancer du foie. Les auteurs ont utilisé des approches génétiques complémentaires pour activer ou inhiber les cellules étoilées, ou encore pour réduire leur nombre, au cours du développement du carcinome hépatocellulaire. Ils ont ainsi pu mettre en évidence le rôle à la fois pro-tumoral et anti-tumoral des cellules étoilées dans ce processus. Un changement dynamique entre deux sous-populations de cellules étoilées permet de comprendre cet antagonisme fonctionnel. Le nombre des cellules étoilées qui sécrètent des cytokines (cellules cyHSC), notamment HGF, augmente en cas de fibrose ou de cirrhose, et ces cellules ont un rôle suppresseur de tumeur, alors que celui des cellules étoilées de type myofibroblastique (cellules myHSC) enrichies en collagène de type 1 augmente à partir d’un certain seuil de fibrose dans l’environnement pré-tumoral. C’est ce déséquilibre entre les deux sous-populations cellulaires au profit des cellules myHSC qui contribue à la prolifération et à la mort hépatocytaire, deux facteurs de risque connus de cancer du foie. La cirrhose est une sorte de bombe à retardement : 90 % des carcinomes hépatocellulaires se développent sur ce terrain. Il est donc possible que chaque tumeur apparaissant sur un foie cirrhotique soit le résultat du déséquilibre local entre ces deux sous-types de cellules étoilées. Une modification de leur proportion, défavorable aux cellules cyHSC et favorable aux cellules myHSC, à un stade avancé de la maladie chronique du foie confèrerait ainsi un risque élevé de développer un cancer du foie. De nombreux questionnements subsistent, cette étude n’ayant pas permis de supprimer spécifiquement les cellules cyHSC et s’étant focalisée sur les facteurs HGF et collagène de type 1 comme marqueurs respectifs des cellules cyHSC et des cellules myHSC, alors que d’autres médiateurs existent probablement. Néanmoins, ces travaux éclairent la cellule « star » du foie d’une lumière nouvelle, soulignant à la fois l’aspect dynamique et la complexité de son rôle, bénéfique en situation physiologique ou pathologique de bas grade, délétère au fur et à mesure de la progression de la maladie chronique du foie. Pour rester dans les références cinématographiques, « a star is reborn » !
Liens d’intérêt
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Kisseleva T, Cong M, Paik Y, et al. Myofibroblasts revert to an inactive phenotype during regression of liver fibrosis. Proc Natl Acad Sci USA 2012 ; 109 : 9448–9453. [CrossRef] [PubMed] [Google Scholar]
- Michalopoulos GK, Bhushan B. Liver regeneration : biological and pathological mechanisms and implications. Nat Rev Gastroenterol Hepatol 2021, 18 : 40–55. [CrossRef] [PubMed] [Google Scholar]
- Kitto LJ, Henderson NC. Hepatic stellate cell regulation of liver regeneration and repair. Hepatol Commun 2020; 5 : 358–70. [Google Scholar]
- Benhamouche S, Decaens T, Perret C, Colnot S. Voie Wnt/β-caténine et zonation métabolique du foie : un nouvel acteur pour un ancien concept. Med Sci (Paris) 2006 ; 22 : 904–906. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Halpern KB, Shenhav R, Matcovitch-Natan O, et al. Single-cell spatial reconstruction reveals global division of labour in the mammalian liver. Nature 2017 ; 542 : 352–356. [CrossRef] [PubMed] [Google Scholar]
- Ben-Moshe, Shapira Y, Moor AE, et al. Spatial sorting enables comprehensive characterization of liver zonation. Nat Metab 2019, 1 : 899–911. [CrossRef] [PubMed] [Google Scholar]
- Aizarani N, Saviano A, Sagar L, et al. A human liver cell atlas reveals heterogeneity and epithelial progenitors. Nature 2019 ; 572 : 199–204. [CrossRef] [PubMed] [Google Scholar]
- He L, Pu W, Liu X, et al. Proliferation tracing reveals regional hepatocyte generation in liver homeostasis and repair. Science 2021; 371 : eabc4346. [CrossRef] [PubMed] [Google Scholar]
- Wei Y, Wang YG, Jia Y, et al. Liver homeostasis is maintained by midlobular zone 2 hepatocytes. Science 2021; 371 : eabb 1625. [CrossRef] [Google Scholar]
- Trinh VQ, Lee TF, Lemoinne S, et al. Hepatic stellate cells maintain liver homeostasis through paracrine neurotrophin-3 signaling that induces hepatocyte proliferation. Science Signaling 2023; eadf6696. [CrossRef] [PubMed] [Google Scholar]
- Filliol A, Saito A, Nair D, et al. Opposing roles of hepatic stellate cell subpopulations in hepatocarcinogenesis. Nature 2022; 610 : 356–65. [CrossRef] [PubMed] [Google Scholar]
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Représentation d’un lobule hépatique et des cellules étoilées contenues dans l’espace de Disse. Les cellules étoilées sécrètent la neurotrophine-3 (NT-3) qui, via le récepteur TRKB de l’hépatocyte, induit la synthèse de la cycline D1 et la prolifération hépatocytaire. La présence plus abondante du récepteur TRKB à la surface des hépatocytes de la zone 2 explique leur capacité proliférative accrue par rapport à ceux des deux autres zones. |
| Dans le texte | |
 |
Figure 2. Les cellules étoilées du foie activées lors d’une agression hépatique induisent une mort des hépatocytes. Les cellules étoilées acquièrent alors un phénotype myofibroblastique, caractérisé par : prolifération, contractilité, production en excès de matrice extracellulaire, chimiotactisme, et sécrétion de facteurs inflammatoires et immunomodulateurs aboutissant à une fibrose hépatique. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




