| Issue |
Med Sci (Paris)
Volume 39, Number 8-9, Août–Septembre 2023
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 681 - 685 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2023105 | |
| Published online | 11 September 2023 | |
Découverte de la pierre angulaire assurant la coordination de la synthèse de la paroi bactérienne avec le métabolisme central
Discovery of the cornerstone ensuring the coordination of the synthesis of the bacterial wall with the central metabolism
1
Master 2 Microbiologie intégrative et fondamentale, Aix Marseille université, Marseille, France
2
Aix Marseille université, CNRS, LCB UMR7283, IMM, Marseille, France
a fabian.debard@etu.univ-amu.fr
b quentin.desicy-huiez@etu.univ-amu.fr
c samya.kehiha@etu.univ-amu.fr
d janis.laudouze@etu.univ-amu.fr
e marvin.vizzari@etu.univ-amu.fr
f latifi@imm.cnrs.fr
L’enveloppe cellulaire est un composant essentiel des bactéries. Elle est fondamentale pour le maintien de la forme cellulaire, la résistance aux conditions difficiles, voire extrêmes, et la détection des signaux environnementaux. Porteuse de nombreux systèmes de défense et d’attaque, l’enveloppe participe aussi à la pathogénicité bactérienne.
Il existe deux profils majoritaires d’enveloppes bactériennes [1]. Chez les bactéries à Gram négatif comme Escherichia coli, l’enveloppe est composée d’une membrane plasmique, d’une mince couche de peptidoglycane (PG) contenue dans l’espace périplasmique et d’une membrane externe. Chez les bactéries à Gram positif comme Bacillus subtilis, l’enveloppe est composée d’une membrane plasmique et d’une couche épaisse de PG, qui est alors le constituant majeur de la paroi (Figure 1A).
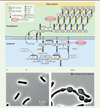 |
Figure 1. La biosynthèse du peptidoglycane chez Bacillus subtilis. (A) La formation du PG débute dans le cytoplasme avec la synthèse des précurseurs. L’UDP-GlcNac [hexagone bleu] et l’UDP-MurNac [hexagone jaune] sont les deux principaux précurseurs. La GlmR interagit d’abord avec la GlmS [flèche discontinue] et stimule la synthèse de l’UDP-GlcNac. Ensuite, l’UDP-MurNAc est lié à une chaîne peptidique après plusieurs réactions au cours desquelles différentes enzymes interviennent. La synthèse se poursuit au niveau de la membrane plasmique avec la formation du lipide I par fusion du phospho-MurNAc-pentapeptide avec l’undécaprényl phosphate lié à la membrane. La fusion de l’UDP-GlcNAc au lipide I forme le lipide II. Ce dernier est ensuite transloqué par une flippase du côté extérieur de la membrane. Il est pris en charge par les penicilin-binding proteins (PBP), qui permettent son insertion dans le PG mature ainsi que le clivage de l’undécaprényl phosphate qui est ensuite recyclé. Chaque ovale blanc représente une enzyme impliquée dans une étape de la biosynthèse. Certains antibiotiques comme les β-lactamines inhibent l’action des PBP, ce qui bloque l’incorporation du lipide II au peptidoglycane préexistant. La bacitracine, quant à elle, bloque la translocation des précurseurs en empêchant leur fixation à l’undécaprényl phosphate (figure réalisée avec Biorender). (B) Images de microscopie à contraste de phase de bactéries B. subtilis sauvages (WT, à gauche) ou dépourvues du gène glmR (ΔglmR, à droite), cultivées en présence de gluconate [4]. |
Permettant de maintenir l’intégrité cellulaire en formant une réelle barrière protectrice, le PG est un polymère glyco-peptidique qui forme un réseau tridimensionnel au sein de l’enveloppe. En effet, ce dernier est composé d’un enchevêtrement de chaînes glycanes complexes reliées par des ponts peptidiques. De nombreuses étapes sont nécessaires pour obtenir la structure finale du peptidoglycane à partir de précurseurs cytoplasmiques tels que l’uridine diphosphate N-acétylglucosamibe (UDP-GlcNAc) et l’acide uridine-diphosphate-N-acétylmuramique (UDP-MurNac), des nucléotides couplés à des oses. Ces précurseurs sont exportés à l’extérieur de la membrane pour être assemblés par les « penicillin-binding proteins » (PBP) et reliés entre eux par des ponts peptidiques. Les PBP sont donc des enzymes essentielles assurant le maillage du PG. Elles sont majoritairement ciblées par des antibiotiques tels que la pénicilline qui appartient à la famille des bêta-lactamines. Puisqu’il est conservé chez la majorité des bactéries [2], le PG est une bonne cible thérapeutique pour le développement de nouvelles molécules antibiotiques à large spectre.
Étant une structure complexe, la paroi implique une synthèse faisant intervenir plusieurs précurseurs et nécessite un apport conséquent en énergie. Au cours de cette synthèse, des intermédiaires moléculaires qui proviennent du métabolisme du carbone, comme l’UDP-GlcNac et l’UDP-MurNac, sont utilisés pour la synthèse de composants lipidiques précurseurs du PG, après leur fixation sur l’undécaprényl diphosphate, donnant successivement les lipides I et II (Figure 1A). Ainsi, les mécanismes de synthèse et de dégradation du PG doivent être finement régulés pendant le cycle cellulaire bactérien en fonction de la biodisponibilité en carbone et sont donc étroitement liés au métabolisme central. L’analyse des mécanismes permettant la synchronisation de la synthèse du PG au métabolisme cellulaire global est donc cruciale pour une meilleure compréhension de la formation de cette structure essentielle des bactéries. Récemment, la protéine GlmR (glucosamine-6-phosphate regulator) a été identifiée comme une protéine clé modulant la synthèse du PG en fonction de la nature des substrats carbonés présents dans le milieu [3]. La GlmR est particulièrement étudiée chez Bacillus subtilis, une bactérie ubiquitaire aérobie stricte en forme de bacille. Cette bactérie est non pathogène, facile à cultiver et à manipuler, ce qui en fait un modèle de choix pour l’étude des bactéries à Gram positif [3]. La GlmR est également présente chez de nombreuses autres bactéries, notamment les bactéries pathogènes Listeria monocytogenes et Staphylococcus aureus. Récemment, le rôle de la GlmR a été élucidé et un modèle de son mode d’action a été proposé [4].
Découverte de la GlmR chez B. subtilis
Les bactéries hétérotrophes peuvent utiliser des sources de carbone variées. Chez B. subtilis, la protéine Crh (pour catabolite repression HPr) est importante pour l’adaptation aux différentes sources de carbone. Elle participe à l’assimilation et au transport des sucres et son activité est stimulée en présence de ces derniers. Le rôle des autres gènes (dont glmR) de l’opéron contenant crh a été étudié pour déterminer leur impact éventuel dans l’adaptation aux changements métaboliques. L’utilisation d’approches génétiques, en étudiant une souche dépourvue du gène glmR (ΔglmR), a permis de montrer que le gène glmR est essentiel à la croissance de B. subtilis en présence de sources de carbone non glucidiques, qui sont des intermédiaires du cycle de Krebs ou de la voie métabolique des pentoses phosphates [5].
Entretien avec Anne Galinier

Anne Galinier est directrice de recherche au CNRS. Elle a fondé son équipe au sein du laboratoire de chimie bactérienne (LCB) à Marseille à la suite de son post-doctorat. Son équipe se concentre sur la compréhension des mécanismes permettant de réguler les processus cellulaires en fonction des conditions nutritionnelles de l’environnement. Ces études sont réalisées chez l’organisme modèle Bacillus subtilis.
Est-ce que vous pouvez nous présenter votre parcours académique et de chercheuse ?
En ce qui concerne mon parcours académique, il est classique. J’ai eu mon Baccalauréat à 17 ans et j’ai continué à l’université. Après l’obtention de ma thèse à 25 ans, je suis partie en post-doctorat pendant deux ans, puis j’ai intégré le CNRS à Lyon. J’y suis restée pendant quatre ans avant de fonder mon équipe à Marseille. Actuellement je dirige une équipe composée de six personnes.
Sur quoi travaillez-vous actuellement ?
Au laboratoire, nous nous intéressons à l’adaptation des bactéries au changement de milieu extérieur et notre modèle d’étude est une bactérie que l’on retrouve dans le sol qui s’appelle Bacillus subtilis.
Avez-vous obtenu de nouvelles données sur le rôle de YvcJ ?
En ce moment, nous testons l’hypothèse selon laquelle YvcJ pourrait se lier à l’ARN.
Pensez-vous que la GlmR possède d’autres rôles cellulaires que ceux déjà découverts ?
À ce jour, je ne suis pas sûre car aucune piste ne laisse penser que la GlmR puisse posséder un autre rôle.
Pensez-vous que la GlmR pourrait être une bonne cible thérapeutique ?
Oui, la GlmR peut être une bonne cible thérapeutique parce que, chez certains pathogènes comme le staphylocoque doré, elle est essentielle. L’avantage de la GlmR est que, d’une part, elle est essentielle chez certains pathogènes et, d’autre part, elle n’est essentielle que dans certaines conditions de croissance. Par exemple, on peut imaginer que dans un microbiote où il y a de nombreuses bactéries qui vivent en présence de sources de carbone différentes, on pourrait cibler tel pathogène ou telle bactérie plutôt qu’un/une autre.
Quel est le moment qui vous a le plus marqué dans votre carrière ?
Le moment où j’ai eu le plus grand choc, c’est en 1998 lors de la découverte du génome de Bacillus subtilis. Tout un pan de recherche s’offrait à nous. Je me rappelle du congrès auquel j’ai assisté : on nous a révélé tout le génome et les possibilités qui en découlaient et pour moi, c’était un moment particulier.
Qu’aimez-vous le plus dans votre métier ?
Ce que j’aime, c’est la possibilité d’interagir avec plein de jeunes et de faire des choses différentes. Mais si je devais choisir, je dirais que c’est la liberté.
Selon vous, quelles sont les nouvelles techniques qui vont devenir indispensables pour l’étude de votre sujet ?
Je pense à tout ce qui est dynamique au niveau de la microscopie : l’importance de savoir quand les choses se passent et le fait d’avoir un visuel. Au niveau aussi des approches globales. Avant, on avait une approche globale mais figée. Maintenant, on peut avoir une approche globale dynamique et je pense que c’est ça qui va vraiment permettre de comprendre ce qui se passe à un temps t, dans des conditions expérimentales données.
Comment avez-vous vécu le fait qu’il ait fallu attendre une dizaine d’années pour connaître le rôle de la GlmR ?
Au cours de ces années, je n’ai pas travaillé que sur la GlmR. Il y avait de nombreux autres sujets sur lesquels travaillait l’équipe. Je pense qu’une qualité pour être chercheur, c’est la patience et la pugnacité.
L’attente durant ces années ne m’a pas paru si longue. En effet, nous faisions des petites découvertes de temps en temps, des choses enthousiasmantes. Il se peut qu’on ait eu des moments de découragement mais, au final, je ne les ai pas vus passer.
Quels sont vos projets de recherche pour le futur ?
Cela dépend des financements que je vais pouvoir obtenir, ils vont guider certains projets plutôt que d’autres. On essaie de développer un pan de recherche un peu plus appliqué mais on reste quand même sur de la recherche fondamentale. L’objectif reste d’implémenter les connaissances sur notre bactérie : Bacillus subtilis.
Quels sont les principaux conseils que vous donneriez à des futurs chercheurs ?
Il ne faut rien lâcher, mais ce conseil, je le donnerai pour beaucoup de choses de la vie. Si on a envie de faire quelque chose, il ne faut pas hésiter : on y va et puis on voit ce qu’il se passe. En tout cas, on ne joue pas sa vie, donc on peut se tromper, on peut faire des mauvais choix mais rien n’est définitif. Il faut avoir la pêche et y aller, ne pas avoir peur.
Est-ce que vous pensez qu’aujourd’hui les femmes occupent un rôle plus important dans la recherche par rapport à votre début de carrière ?
C’est difficile à dire car, au laboratoire de chimie bactérienne, il y a toujours eu près d’une douzaine d’équipes, et on a toujours été un petit tiers à être des femmes cheffes d’équipe. Donc, j’aurais tendance à dire que oui. Je ne suis pas sûre, mais l’histoire a montré que les femmes avaient de plus en plus de facilité à poursuivre des études et à faire carrière.
Que pensez-vous de la recherche en France ?
Je pense qu’elle est de très bonne qualité. On n’a pas du tout à rougir face à nos collègues étrangers. Le problème est que parfois notre activité est un peu polluée par beaucoup de choses annexes comme des formulaires à remplir. Cependant, je pense que la formation en France est très bonne. Il y a de bons laboratoires, un bon réseau et je suis ravie d’être chercheuse au CNRS.
Le rôle de la GlmR dans le maintien de la morphologie cellulaire a également été mis en évidence chez B. subtilis. En effet, une souche ΔglmR, cultivée en présence de sources de carbone non glucidiques, présente des morphologies aberrantes de type « bulles » ou filaments observables par microscopie optique et conduisant à terme à une lyse cellulaire (Figure 1B). Ces formes particulières sont la conséquence d’un défaut de formation du septum au cours de la division cellulaire ou d’un défaut du maintien de l’équilibre entre la synthèse et la dégradation de la paroi cellulaire. Dans ces bactéries mutées, l’apparition spontanée de clones révertants qui ne présentent plus de défaut de morphogenèse lors de croissance sur des substrats non glucidiques est fréquente. Ces clones possèdent des mutations dites suppressives, qui restaurent le phénotype sauvage, et dont la caractérisation permet de mieux comprendre les mécanismes moléculaires liés à l’adaptation des bactéries à leur milieu. L’analyse des mutants suppresseurs dans la souche ΔglmR a mis en évidence des mutations principalement localisées dans des gènes impliqués dans le métabolisme du carbone comme la glycolyse. Cette voie libère de l’énergie en utilisant des sources de carbone glucidiques (comme le glucose et le fructose). Cependant, il a été montré que chez B. subtilis, la GlmR est essentielle à la croissance en présence de substrats non glucidiques. Ce résultat peut s’expliquer par le fait que la néoglucogenèse et la glycolyse partagent les mêmes enzymes. La néoglucogenèse étant une voie métabolique qui génère du glucose à partir de substrats non glucidiques [5], il est possible de conclure que la GlmR joue un rôle dans la néoglucogenèse.
L’interaction entre la GlmR et les précurseurs du PG varie en fonction de la source de carbone
Une analyse bio-informatique de la séquence protéique de la GlmR a permis de prédire un motif de liaison aux dinucléotides [6]. Afin de valider ces données bio-informatiques et d’identifier les interactions de la GlmR avec des substrats potentiels, une technique de biochimie qui permet de déterminer des interactions protéines-protéines et protéines-ligands (autres que des protéines) a été réalisée. Toutefois, cette dernière n’a révélé aucune interaction entre la GlmR et les dinucléotides analysés, invalidant la prédiction bio-informatique. En revanche, ces études ont permis de mettre en évidence l’interaction de la GlmR avec des ligands dont la structure se rapprochent des dinucléotides, les sucres UDP (UDP-Glc et UDP-GlcNAc) [7]. La capacité de la GlmR à interagir avec l’UDP-GlcNAc, ainsi que l’observation que le mutant ΔglmR présente une sensibilité accrue à la bacitracine, un antibiotique qui inhibe la synthèse du PG, suggèrent que la GlmR joue un rôle important dans la synthèse du PG [8].
L’interaction entre GlmR et GlmS dépend de la concentration intracellulaire d’UDP-GlcNac
Il a été observé que certaines des mutations suppressives retrouvées chez le mutant ΔglmR avaient pour conséquence la surproduction de la protéine GlmS [8]. La GlmS est une enzyme nécessaire à la synthèse d’UDP-GlcNAc, qui participe à la biosynthèse du PG (Figure 1A). L’interaction entre GlmR et GlmS de B. subtilis a été observée lorsque ces deux protéines ont été co-produites chez E. coli [8], puis confirmée in vitro [4]. Remarquablement, il a été montré qu’en interagissant avec la GlmS, la GlmR en stimule l’activité et que cette stimulation est inhibée lorsque la concentration d’UDP-GlcNAc est élevée [4].
La concentration cellulaire de la GlmS étant finement régulée, les auteurs ont étudié la possible interaction entre la GlmR et des facteurs connus pour réguler la GlmS. Parmi ces candidats, les études se sont portées sur la protéine YvcJ dont l’orthologue chez E. coli régule l’activité de la GlmS. L’interaction entre YvcJ et GlmR a été montrée in vitro par plusieurs approches. Un modèle fonctionnel expliquant la relation tripartite entre les trois facteurs, GlmR, GlmS et YvcJ a été proposé (Figure 2). (1) En présence d’une source de glucose, la concentration d’UDP-GlcNAc n’est pas limitante. Ce dernier en se fixant à YvcJ et GlmR permet la formation d’un complexe composé de ces deux protéines, l’activité de la GlmS n’est alors pas stimulée. (2) En présence d’une source de carbone non glucidique, la concentration d’UDP-GlcNAc diminue, ce qui entraine la libération de la GlmR qui peut alors interagir avec la GlmS, stimuler son activité et induire la production d’UDP-GlcNAc. Ainsi, via son interaction avec la GlmS, la GlmR permet d’adapter la synthèse d’UDP-GlcNAc, donc du PG, à la nature de la source de carbone disponible.
 |
Figure 2. Représentation de la régulation de la GlmS par la GlmR en fonction de la source de carbone. Lors de la croissance de B. subtilis sur un milieu contenant des intermédiaires de la glycolyse comme le glucose, la concentration de fructose-6-phosphate (F6P) n’est pas limitante et la GlmS transforme le F6P en glucosamine-6-phosphate. La concentration intracellulaire d’UDP-GlcNAc est alors forte, et celui-ci interagit avec la GlmR et YvcJ permettant l’interaction entre ces deux protéines et empêchant ainsi la GlmR de stimuler l’activité de la GlmS (A). En revanche, en présence d’intermédiaires du cycle de Krebs ou de la voie des pentoses phosphates, la quantité de F6P produite par la néoglucogenèse est faible. L’interaction entre YvcJ et la GlmR n’est pas possible car le niveau intracellulaire en UDP-GlcNAc est faible. La GlmT interagit alors avec la GlmS induisant la transformation du F6P et la synthèse de l’UDP-GlcNAc (B). |
Conclusion
Depuis sa découverte en 2005, l’étude approfondie de la GlmR a permis de mettre en évidence son rôle fondamental dans la régulation de la biosynthèse du peptidoglycane de B. subtilis en fonction de la nature des sources de carbone et donc du métabolisme mis en jeu. Ces données ont ainsi montré que la synthèse de la paroi cellulaire et la morphogenèse bactérienne sont strictement coordonnées au métabolisme central.
Les homologues de la GlmR sont très répandus chez les bactéries pathogènes telles que M. tuberculosis, S. aureus et L. monocytogenes. L’absence de la GlmR chez M. tuberculosis provoque une diminution de la virulence, une modification de la paroi bactérienne et une sensibilité exacerbée pour les β-lactames [6]. Chez le pathogène opportuniste S. aureus, la GlmR est strictement essentielle à la croissance et la survie de ce pathogène dans son hôte [10]. Toutes ces observations suggèrent que cette protéine pourrait constituer une cible de choix pour le développement de nouveaux antibiotiques.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Silhavy TJ, Kahne D, Walker S. The Bacterial Cell Envelope. Cold Spring Harbor Perspectives in Biology 2010 ; 2 : a000414. [CrossRef] [PubMed] [Google Scholar]
- Egan A, Errington J, Vollmer W. Regulation of peptidoglycan synthesis and remodelling. Nat Rev Microbiol 2020; 18: 446–60. [CrossRef] [PubMed] [Google Scholar]
- Errington J, van der Aart LT. Microbe Profile: Bacillus subtilis: model organism for cellular development, and industrial workhorse. Microbiology 2020; 166: 425–27. [CrossRef] [PubMed] [Google Scholar]
- Foulquier E, Pompeo F, Byrne D, et al. Uridine Diphosphate N-Acetylglucosamine Orchestrates the Interaction of GlmR with Either YvcJ or GlmS in Bacillus Subtilis. Sci Rep 2020; 10: 15938. [CrossRef] [PubMed] [Google Scholar]
- Görke B, Foulquier E, Galinier A. YvcK of Bacillus subtilis is required for a normal cell shape and for growth on Krebs cycle intermediates and substrates of the pentose phosphate pathway. Microbiology 2005 ; 151 : 3777–3791. [CrossRef] [PubMed] [Google Scholar]
- Hanukoglu I. Proteopedia: Rossmann Fold: A Beta-Alpha-Beta Fold at Dinucleotide Binding Sites. Biochemistry and Molecular Biology Education 2015 ; 43 : 206–209. [CrossRef] [PubMed] [Google Scholar]
- Foulquier E, Galinier A. YvcK, a Protein Required for Cell Wall Integrity and Optimal Carbon Source Utilization. Binds Uridine Diphosphate-Sugars. Sci Rep 2017 ; 7 : 4139. [Google Scholar]
- Touzé T, Mengin-Lecreulx D. Undecaprenyl Phosphate Synthesis. EcoSal Plus 2008; 3: 10.1128/ecosalplus.4.7.1.7. [Google Scholar]
- Patel V, Wu Q, Chandrangsu P, et al. A Metabolic Checkpoint Protein GlmR Is Important for Diverting Carbon into Peptidoglycan Biosynthesis in Bacillus Subtilis. PLoS Genet 2018 ; 14 : e1007689. [CrossRef] [PubMed] [Google Scholar]
- Chaudhuri RR, Allen AG, Owen PJ, et al. Comprehensive identification of essential Staphylococcus aureus genes using Transposon-Mediated Differential Hybridisation (TMDH). BMC genomics 2009 ; 10 : 291. [CrossRef] [PubMed] [Google Scholar]
© 2023 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. La biosynthèse du peptidoglycane chez Bacillus subtilis. (A) La formation du PG débute dans le cytoplasme avec la synthèse des précurseurs. L’UDP-GlcNac [hexagone bleu] et l’UDP-MurNac [hexagone jaune] sont les deux principaux précurseurs. La GlmR interagit d’abord avec la GlmS [flèche discontinue] et stimule la synthèse de l’UDP-GlcNac. Ensuite, l’UDP-MurNAc est lié à une chaîne peptidique après plusieurs réactions au cours desquelles différentes enzymes interviennent. La synthèse se poursuit au niveau de la membrane plasmique avec la formation du lipide I par fusion du phospho-MurNAc-pentapeptide avec l’undécaprényl phosphate lié à la membrane. La fusion de l’UDP-GlcNAc au lipide I forme le lipide II. Ce dernier est ensuite transloqué par une flippase du côté extérieur de la membrane. Il est pris en charge par les penicilin-binding proteins (PBP), qui permettent son insertion dans le PG mature ainsi que le clivage de l’undécaprényl phosphate qui est ensuite recyclé. Chaque ovale blanc représente une enzyme impliquée dans une étape de la biosynthèse. Certains antibiotiques comme les β-lactamines inhibent l’action des PBP, ce qui bloque l’incorporation du lipide II au peptidoglycane préexistant. La bacitracine, quant à elle, bloque la translocation des précurseurs en empêchant leur fixation à l’undécaprényl phosphate (figure réalisée avec Biorender). (B) Images de microscopie à contraste de phase de bactéries B. subtilis sauvages (WT, à gauche) ou dépourvues du gène glmR (ΔglmR, à droite), cultivées en présence de gluconate [4]. |
| Dans le texte | |
 |
Figure 2. Représentation de la régulation de la GlmS par la GlmR en fonction de la source de carbone. Lors de la croissance de B. subtilis sur un milieu contenant des intermédiaires de la glycolyse comme le glucose, la concentration de fructose-6-phosphate (F6P) n’est pas limitante et la GlmS transforme le F6P en glucosamine-6-phosphate. La concentration intracellulaire d’UDP-GlcNAc est alors forte, et celui-ci interagit avec la GlmR et YvcJ permettant l’interaction entre ces deux protéines et empêchant ainsi la GlmR de stimuler l’activité de la GlmS (A). En revanche, en présence d’intermédiaires du cycle de Krebs ou de la voie des pentoses phosphates, la quantité de F6P produite par la néoglucogenèse est faible. L’interaction entre YvcJ et la GlmR n’est pas possible car le niveau intracellulaire en UDP-GlcNAc est faible. La GlmT interagit alors avec la GlmS induisant la transformation du F6P et la synthèse de l’UDP-GlcNAc (B). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




