| Issue |
Med Sci (Paris)
Volume 39, Number 8-9, Août–Septembre 2023
|
|
|---|---|---|
| Page(s) | 632 - 642 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023097 | |
| Published online | 11 September 2023 | |
Les vestibulopathies périphériques
De nouveaux modèles d’étude
Animal models of balance pathologies: New tools to study peripheral vestibulopathies
1
Aix Marseille université-CNRS, Laboratoire de neurosciences cognitives, LNC UMR 7291, Marseille, France
2
Groupements de recherche (GDR) Vertige, Unité CNRS GDR2074, Marseille, France
*
brahim.tighilet@univ-amu.fr
**
christian.chabbert@univ-amu.fr
Les vestibulopathies périphériques (VP) ou désordres vestibulaires périphériques (DVP) sont diagnostiqués surtout selon leur expression clinique, mais l’hétérogénéité des symptômes vestibulaires rend difficile la stratification des patients pour leur prise en charge thérapeutique. Les modèles animaux constituent un moyen d’identifier des critères d’évaluation clinique afin d’analyser la cinétique d’expression du syndrome vertigineux et d’évaluer les bénéfices des stratégies thérapeutiques, qu’elles soient pharmacologiques ou rééducatives. La question de la prédictibilité de ces modèles est donc cruciale pour l’identification de biomarqueurs comportementaux et biologiques qui pourraient être exploités en clinique. Dans cette revue, nous proposons un état des lieux des différents modèles animaux de VP, et discutons de leur pertinence pour la compréhension des mécanismes physiopathologiques impliqués et le développement de nouvelles approches thérapeutiques plus ciblées.
Abstract
The different types of peripheral vestibulopathies (PVs) or peripheral vestibular disorders (PVDs) are essentially diagnosed on the basis of their clinical expression. The heterogeneity of vestibular symptoms makes it difficult to stratify patients for therapeutic management. Animal models of PVs are a good mean to search for clinical evaluation criteria allowing to objectively analyze the kinetics of expression of the vertigo syndrome and to evaluate the benefits of therapeutic strategies, whether they are pharmacological or rehabilitative. The question of the predictability of these animal models is therefore crucial for the identification of behavioral and biological biomarkers that could then be used in the human clinic. In this review, we propose an overview of the different animal models of PVs, and discuss their relevance for the understanding of the underlying pathophysiological mechanisms and the development of new and more targeted therapeutic approaches.
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Brahim Tighilet).
La notion de « prédictibilité »
La notion de prédictibilité d’un modèle d’étude en biologie réfère à sa capacité à prédire et/ou reproduire au plus près, in vivo, in vitro ou in silico, les évènements biologiques et les symptômes (corrélats fonctionnels) qui seront retrouvés chez l’homme. Dans le cas des modèles de désordres vestibulaires, il va s’agir de prédire, sur la base d’observations expérimentales, les conséquences biologiques et fonctionnelles de l’administration d’un composé pharmacologique d’intérêt ou d’une approche rééducative [1].
Cette notion revêt toute son importance dans le cas des vestibulopathies périphériques, référencées dans l’International Classification of Diseases sous les codes H81.0 à H81.9 [2]. Ces maladies se caractérisent par des épisodes brusques d’altérations fonctionnelles, constituées de désordres statiques et dynamiques pouvant inclure des pertes d’équilibre postural, des troubles de la locomotion, des désorientations spatiales, des déficits des réflexes vestibulo-oculaires provoquant l’expression d’un nystagmus1, ainsi que des altérations des fonctions végétatives et cognitives [3]. Les symptômes s’atténuent progressivement, chacun avec sa propre cinétique, conduisant généralement à une disparition quasi totale du syndrome. Ce phénomène de récupération comportementale est appelé « compensation vestibulaire » [4].
Une des caractéristiques communes aux vestibulopathies périphériques est, dans la majorité des cas, l’absence d’identification des causes de la maladie. Cela résulte en grande partie du fait que les organes sensoriels de l’oreille interne, à cause de leur confinement au sein de l’os temporal, ne sont accessibles, chez le patient, ni aux dosages, ni aux enregistrements électrophysiologiques directs, et très partiellement à l’imagerie médicale de haute résolution. Ainsi, en dehors de certaines situations (ototoxicité2 médicamenteuse, trauma du rocher, fistule ou atélectasie vestibulaire3), les principales vestibulopathies périphériques répertoriées ne disposent que d’étiologies supposées.
À cause de ce manque d’informations sur leurs étiologies respectives, les différentes entités cliniques, regroupées sous le terme de vestibulopathies périphériques (VP) ou d’atteintes vestibulaires périphériques, sont distinguées uniquement sur la base de leurs symptômes. Ces symptômes sont, par ailleurs, très hétérogènes pour une même entité clinique, chaque paramètre variant avec sa propre cinétique. Il n’existe aujourd’hui que très peu de biomarqueurs spécifiques pouvant être évalués par imagerie clinique, par dosage, ou par des enregistrements électrophysiologiques, permettant de confirmer ou d’infirmer l’appartenance d’un désordre vestibulaire à une classe précise. On manque ainsi cruellement de paramètres cliniques fiables et acceptés pour, d’une part, suivre précisément le décours du syndrome vertigineux, et, d’autre part, apprécier les bénéfices d’approches thérapeutiques, qu’elles soient pharmacologiques ou rééducationnelles. Les échecs récents de nombreux essais cliniques de candidats médicaments à propriétés antivertigineuses en sont l’illustration.
Le développement de modèles animaux d’atteintes vestibulaires a réellement commencé avec les travaux du médecin et biologiste français Pierre-Marie-Jean Flourens (1794-1867). Il a été le premier à établir, grâce à ses travaux chez le pigeon, un lien direct entre les dommages des capteurs vestibulaires de l’oreille interne et les déficits posturo-locomoteurs caractéristiques observés chez les patients vertigineux. Dès lors, les chercheurs se sont attachés, sur la base d’un rationnel épidémiologique, à reproduire chez l’animal des conditions d’agression du système vestibulaire périphérique et à sélectionner celles induisant la symptomatologie la plus proche de celle rencontrée chez le patient. À partir des années 1960, les premiers enregistrements électrophysiologiques, réalisés au niveau des noyaux vestibulaires du tronc cérébral d’animaux ayant subi une lésion vestibulaire unilatérale, ont permis de montrer que les symptômes constituant le syndrome vestibulaire découlaient d’un déséquilibre électrophysiologique entre les noyaux vestibulaires intacts et les noyaux vestibulaires désafférentés, avec une activité électrique spontanée faible du côté désafférenté et intense du côté intact (Figure 1) [5]. Fort de ce constat, plusieurs modèles animaux mimant les situations neurophysiologiques à la base du syndrome ont dès lors été développés.
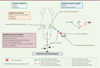 |
Figure 1. Déséquilibre électrophysiologique sous-tendant le syndrome vestibulaire. Après lésion vestibulaire, les noyaux vestibulaires ipsilatéraux à la lésion présentent un déficit d’excitabilité, à l’inverse des noyaux vestibulaires controlatéraux à la lésion. Cet effet s’explique par les neurones secondaires vestibulaires qui relient les noyaux vestibulaires bilatéraux : les neurones excitateurs de types I et les neurones inhibiteurs de type II qui reçoivent une excitation différentielle du nerf vestibulaire (selon le côté lésé ou non lésé). Il en découle un déséquilibre électrophysiologique qui sous-tend le syndrome vestibulaire composé de plusieurs symptômes : perceptivo-cognitifs, végétatifs, oculomoteurs et posturo-locomoteurs (figure créée avec Biorender.com). |
Modèles animaux de vestibulopathies périphériques
Les modèles animaux de VP peuvent être classés en différentes catégories selon qu’ils miment les conditions pathogéniques supposées, ou qu’ils reproduisent les situations neurophysiologiques à la base du syndrome vertigineux. Une classification sur cette base est proposée ci-dessous.
Modèles animaux mimant les conditions pathogéniques supposées
Modèles d’infections virales ou bactériennes
Les pertes auditives et les atteintes vestibulaires font partie des comorbidités bien établies des infections virales et bactériennes [6]. Parmi les maladies vestibulaires, telles que la névrite, plusieurs hypothèses ont été avancées. La plus communément admise reste une origine virale. Des études post-mortem ont en effet révélé la présence de l’herpès simplex virus type 1 (HSV-1) dans les ganglions vestibulaires [7]. Les mécanismes par lesquels les atteintes des capteurs de l’oreille interne se produisent ne sont cependant pas clairement établis. Différents modèles d’infections virales ou bactériennes de l’oreille interne ont été développés [8, 9]. Ces modèles, qui ne génèrent pas toujours de syndrome vertigineux et qui manquent de reproductibilité, ne font pas partie de l’arsenal des modèles animaux utilisés dans les études précliniques pour des tests d’efficacité de candidats médicaments.
Modèles d’atteintes ototoxiques
Le terme ototoxicité fait référence à la propriété de certains composés d’être toxiques, en particulier pour l’oreille (oto en latin), incluant à la fois la cochlée et le vestibule. Lorsqu’elle affecte spécifiquement le vestibule, l’ototoxicité peut entraîner des vertiges et des instabilités et potentiellement conduire à de graves incapacités [10]. En fonction de la dose et de la durée de l’administration du composé ototoxique, les conséquences peuvent être réversibles, ou irréversibles. Les mécanismes cellulaires et moléculaires à l’origine de l’ototoxicité n’ont été décryptés que pour quelques familles de composés. Ils restent indéterminés dans la plupart des cas, qu’ils soient d’origine alimentaire ou médicamenteuse. Les composés pour lesquels des propriétés ototoxiques ont été décrites comprennent des antibiotiques, tels que la gentamicine, la streptomycine et la tobramycine, les diurétiques, tels que le furosémide, les agents de chimiothérapie à base de sels de platine, tels que le cisplatine, le carboplatine et la vincristine, ainsi que d’autres composés chimiques, tels que l’iminodipropionitrile-3,3′ (IDPN). Des modèles de rongeurs [11] (Figure 2A) ont permis de mieux comprendre la cinétique et les mécanismes à l’origine du phénomène d’ototoxicité. Les modèles d’ototoxicité aux aminoglycosides ne sont cependant pas utilisés dans les programmes de recherche et développement pour tester des approches protectrices ou régénératrices car ils manquent de reproductibilité en raison de différences interindividuelles de résistance. Notons qu’un modèle d’injection transtympanique de cisplatine a été récemment développé dans le but de contourner ses effets secondaires sur le rein, qui, en générant de fortes douleurs, empêchent un suivi des déficits posturo-locomoteurs liés aux atteintes vestibulaires proprement dites [12].
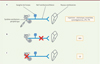 |
Figure 2. Les modèles vestibulaires utilisés en recherche. Différents modèles animaux induisant une asymétrie électrophysiologique entre les noyaux vestibulaires bilatéraux ont été mis au point afin d’étudier le syndrome vestibulaire. A. Injections de composés ototoxiques (antibiotiques, chimiques et agents chimio-thérapeutiques), injection transtympanique d’arsanilate, infection par le cytomégalovirus, injection de lipopolysaccharide (LPS) et injection de tétrodotoxine (TTX). B. Neurectomie vestibulaire unilatérale (NVU) définie par une section chirurgicale du nerf vestibulaire détruisant le ganglion de Scarpa. C. Labyrinthectomie unilatérale chirurgicale (LU) définie par une destruction des récepteurs vestibulaires avec préservation du ganglion de Scarpa (figure créée avec Biorender.com). |
L’administration transtympanique d’arsanilate, un dérivé de l’arsenic, provoque, en quelques jours, une destruction progressive et irréversible des épithéliums sensoriels vestibulaires [13]. Bien que les mécanismes neurotoxiques à l’origine de cette ototoxicité ne soient pas encore élucidés, ce modèle se rapproche des atteintes vestibulaires que l’on rencontre en clinique humaine, telles que la névrite, les labyrinthites (inflammations du nerf vestibulocochléaire), ou le vieillissement vestibulaire (perte progressive des cellules sensorielles, des neurones primaires ou de leurs contacts synaptiques), ou encore le Schwanôme vestibulaire de haut grade (une tumeur bénigne de la gaine de myéline du nerf cochléo-vestibulaire à évolution progressive). Lorsqu’elle est réalisée de manière unilatérale, cette destruction chimique des épithéliums génère, chez l’animal, un syndrome vestibulaire caractéristique des vestibulopathies périphériques unilatérales rencontrées chez l’homme, associant déficits posturo-locomoteurs et vestibulo-oculaires. L’administration bilatérale, simultanée ou séquentielle, d’arsanilate permet de reproduire une aréflexie vestibulaire bilatérale similaire à celle rencontrée chez l’homme à la suite de l’administration massive d’aminoglycosides, ou après une chimiothérapie lourde. Les animaux présentent également des déficits cognitifs de perte de mémoire et de navigation spatiale [14, 15] caractéristiques qui sont observés chez les patients en double aréflexie vestibulaire [16].
Modèles d’atteintes ischémiques
Des situations d’ischémies, localisées dans l’oreille interne, sont suspectées d’être à l’origine de désordres vestibulaires de types névrite, labyrinthite ou maladie de Ménière4 [17, 18]. De telles situations d’ischémie pourraient résulter de sténose ou de thromboses des artères cérébrales (artère cérébelleuse antéro-inférieure [AICA], artère cérébelleuse postéro-inférieure [PICA]), qui vascularisent les organes de l’oreille interne. Des modèles d’ischémie provoquée de l’oreille interne ont été développés chez le rongeur, et des études de résistance ont été réalisées [19, 20]. Bien qu’extrêmement intéressants, ces modèles sont, en raison de leur difficulté d’approche, peu compatibles avec les études de criblage de composés pharmacologiques. D’autres modèles visant à reproduire les dommages excitotoxiques5, principalement par déafférentation des cellules ciliées de l’oreille interne résultant de la libération massive de glutamate par les cellules ciliées en souffrance ischémique, ont été en revanche développés [21] (voir ci-dessous).
Modèles d’hydrops endolymphatique
La présence de gonflement du compartiment endolymphatique de l’oreille interne a été décrite pour la première fois il y a près de quatre-vingt ans, dans des études post-mortem d’histopathologie réalisées chez des patients présentant une maladie de Ménière [22]. Ces gonflements (ou hydrops), qui touchent à la fois les compartiments cochléaire et vestibulaire, provoquent, à des stades avancés, des destructions complètes des organes sensoriels. Leur présence, validée par imagerie par résonance magnétique anatomique dans l’oreille interne, fait désormais partie des outils utilisés en routine pour le diagnostic de la maladie de Ménière [23]. On ne connaît toujours pas l’origine de l’hydrops endolymphatique, ni comment il peut être contrôlé afin de réduire les symptômes qui lui sont associés, et ainsi protéger les organes sensoriels de l’oreille interne [24]. Différents modèles animaux ont été développés au cours des trente dernières années pour tenter de reproduire à la fois les conséquences fonctionnelles et les dommages tissulaires associés à l’hydrops [25]. Ces modèles ont tous pour dénominateur commun une modulation de l’homéostasie ionique de l’endolymphe. En effet, l’injection d’endolymphe synthétique dans la scala media 6, afin d’augmenter le volume de l’endolymphe, ou l’ablation chirurgicale du sac endolymphatique, pour bloquer sa réabsorption, permettent de générer des hydrops endolymphatiques. L’hydrops endolymphatique peut également être induit par une rétention hydrique grâce à l’administration d’hormones antidiurétiques. C’est le cas de l’aldostérone qui provoque un hydrops par réabsorption de sodium (Na+) et de chlore (Cl-) par les récepteurs dédiés présents dans le labyrinthe. La vasopressine agit, quant à elle, sur le couple récepteur V2 (le récepteur de la vasopressine) associé à l’aquaporine-2, présent dans le sac endolymphatique. Bien que ces modèles n’induisent pas toujours de déficits auditifs ou vestibulaires chez les animaux, ils ont néanmoins permis de confirmer que des administrations locales de composés susceptibles d’agir sur l’osmolarité de l’endolymphe, tels que les diurétiques, sont capables de réduire significativement l’hydrops [26]. Le degré de prédictibilité de ces modèles doit cependant être pondéré par le fait que l’étiologie de la maladie de Ménière est certainement multiple, et que l’hydrops reste, sans doute, un corrélat histologique, qui n’est pas essentiel à l’expression du syndrome. Notons que, chez le rat, la modulation des neurones des noyaux vestibulaires par la vasopressine, via les récepteurs V1b, contribue potentiellement au développement du mal des transports [27].
Modèles de blast et traumatisme sonore
Stewart et al., dans leur revue [28], ont montré l’intérêt des modèles animaux dans la recherche des conséquences sur les systèmes vestibulaires périphérique et central, d’une exposition aux bruits continus et intenses. Chez le rat, une augmentation d’acide glutamique, dans les noyaux vestibulaires et le cervelet, a été observée, six mois après que l’animal ait subi un traumatisme sonore. Récemment, un modèle de traumatisme physique de l’oreille interne a été développé afin de reproduire les dommages de l’oreille interne résultant de traumatismes sonores ou d’explosion [29]. Ce modèle a révélé que ces conditions induisaient un hydrops endolymphatique. Néanmoins, parce qu’il est difficile de produire ce phénomène de blast, ce modèle n’est pas utilisé pour la recherche de composés pharmacologiques potentiellement protecteurs contre la génération de l’hydrops, ou pour la protection de l’oreille.
Modèles des processus neurophysiologiques à la base du syndrome vertigineux
Des modèles d’atteintes chirurgicales, excitotoxiques ou chimiques ont été développés [1], afin de mimer les processus physiopathologiques rencontrés chez l’homme. Ces modèles peuvent être classés selon l’impact qu’ils ont sur la fonction du vestibule.
Modèles de section chirurgicale unilatérale du nerf vestibulaire
La section chirurgicale unilatérale du nerf vestibulaire (ou neurectomie vestibulaire unilatérale [NVU]) mime une déafférentation soudaine, totale et irréversible des capteurs sensoriels, comme c’est le cas de certaines névrites vestibulaires ou de labyrinthites. Cette approche chirurgicale reproduit la procédure de neurotomie utilisée chez les patients présentant une maladie de Ménière qui sont réfractaires aux traitements pharmacologiques, ainsi que ses conséquences cliniques [30]. Elle provoque des déficits statiques et dynamiques, comme chez les patients souffrant de vestibulopathie périphérique aiguë. Par des études comportementales réalisées avec des dispositifs expérimentaux spécifiquement adaptés, le modèle de NVU chez le rongeur (Figure 2B) a récemment permis de caractériser les déficits statiques [31] et dynamiques [32] associés à ce type d’atteinte. Il a également permis d’étudier un ensemble de mécanismes réactionnels qui se produisent au niveau des noyaux vestibulaires du tronc cérébral et qui contribuent au phénomène de compensation centrale, tels que la neurogenèse, la gliogenèse et la neuroinflammation [33]. Le syndrome vestibulaire généré par la NVU atteint, chez l’animal, un niveau de sévérité maximum et est très reproductible, ce qui facilite l’étude des propriétés antivertigineuses de composés d’intérêt. Ces modèles ont confirmé les bénéfices de composés antivertigineux de références qui sont prescrits en clinique et ont permis d’identifier leur mécanismes d’action [34, 35].
Le modèle de labyrinthectomie chirurgicale diffère de la NVU. La destruction est circonscrite aux seuls récepteurs vestibulaires, sans section du nerf VIII (Figure 2C). Cette approche a pour objectif de préserver le ganglion de Scarpa, qui contient les corps cellulaires des fibres vestibulaires afférentes, afin de se rapprocher de conditions pathogéniques de certaines névrites vestibulaires, de labyrinthites, ou de la maladie de Ménière [1]. Il en résulte généralement une préservation partielle des fibres du nerf vestibulaire, qui sont toutefois déconnectées de leurs cibles périphériques. Dans ces conditions de préservation de tout ou partie des neurones primaires, le syndrome vestibulaire, évoqué chez l’animal, est proche de celui de la NVU, bien que la cinétique de récupération fonctionnelle soit plus rapide [36]. La labyrinthectomie est plus proche d’un processus progressif de vieillissement des récepteurs vestibulaires périphériques, de leur lésion par traumatisme crânien, ou de leur intoxication par des composés ototoxiques.
Modèles d’atteinte des synapses vestibulaires périphériques conduisant à une aréflexie vestibulaire unilatérale soudaine, partielle et réversible
La zone de contact entre les cellules ciliées vestibulaires de l’oreille interne et les fibres formant le huitième nerf crânien est considérée comme la zone la plus vulnérable de l’oreille interne [37]. Dans la cochlée, des dommages sélectifs des synapses primaires sont impliqués dans la perte auditive neurosensorielle acquise. Une récente analyse quantitative histopathologique de l’oreille interne réalisée chez des sujets âgés, a confirmé des observations antérieures obtenues chez les animaux [38]. Elle indique que la synaptopathie cochléaire et la dégénérescence des axones périphériques du nerf cochléaire, malgré des populations de cellules ciliées presque normales, pourraient être des composantes essentielles de la perte auditive liée à l’âge. Quelques études histopathologiques d’os temporaux humain ont montré, chez des patients présentant des névrites vestibulaires, l’existence de pertes segmentaires de branches isolées du nerf vestibulaire périphérique au ganglion de Scarpa, avec ou sans dégénérescence de l’épithélium sensoriel associé [39, 40]. De ces observations, il a été proposé que la déafférentation sélective des cellules sensorielles vestibulaires pourrait être impliquée dans certaines vestibulopathies périphériques, telles que la névrite vestibulaire, la labyrinthite, les vertiges d’origine ischémique et la maladie de Ménière. Plus récemment, des études histologiques réalisées sur des souris âgées ont mis en évidence une perte sélective des synapses vestibulaires péristriolaires en calice [41]. Ces pertes synaptiques ciblées pourraient être directement en cause dans les déficits vestibulaires liées à l’âge.
Les modèles animaux de lésion excitotoxique de l’oreille interne ont pour but de reproduire les conséquences d’une agression et d’une souffrance des cellules sensorielles ciliées (Figure 3). La libération massive de glutamate est la première conséquence de la dépolarisation des cellules ciliées en situation d’ischémie [42]. Différents modèles ont été développés pour administrer des agonistes des récepteurs du glutamate au niveau du vestibule afin de mimer ces conditions [43, 44]. Des approches histologiques et fonctionnelles ont montré que les pertes auditives ou les déficits vestibulaires provoqués résultaient de la déafférentation des cellules sensorielles après gonflement et détachement des terminaisons nerveuses des fibres auditives et vestibulaires. L’administration transtympanique d’acide kainique (TTK), un agoniste des récepteurs du glutamate, provoque une déafférentation transitoire des cellules ciliées, accompagnée de déficits posturo-locomoteurs et vestibulo-oculaires caractéristiques [21, 45, 46]. Le syndrome vestibulaire, généré par l’administration de TTK, reproduit les déficits statiques et dynamiques rencontrés chez les patients présentant une vestibulopathie périphérique unilatérale aiguë (VPUA) [21]. Le modèle TTK permet une réafférentation spontanée des capteurs vestibulaires par les fibres désafférentées du nerf vestibulaire et permet un criblage de candidats médicaments potentiellement stimulateurs de la repousse neuronale et de la réparation des synapses périphériques.
 |
Figure 3. Injection de TTK et lésion excitotoxique de l’oreille interne. L’injection d’acide kainique (TTK) entraîne une souffrance des afférences primaires au contact des cellules ciliées vestibulaires situées dans les organes otolithiques (saccule, utricule) et les ampoules selon une temporalité précise. Les terminaisons nerveuses afférentes gonflent (1 heure après injection), entraînant leur résorption (7-12 heures après injection) suivie d’une réparation (à compter d’une semaine après la lésion). L’altération de la zone de contact entre cellules ciliées vestibulaires de l’oreille interne et afférences (bleu) formant le nerf vestibulaire engendre un syndrome vestibulaire transitoire (figure créée avec Biorender.com). |
Modèles de neuroinflammation du système vestibulaire périphérique
L’hypothèse neuroinflammatoire de la vestibulopathie périphérique unilatérale aiguë (VPUA, anciennement appelée névrite) a été proposée sur la base de la suspicion de l’existence de foyers inflammatoires le long des différentes branches du nerf vestibulaire [47]. Néanmoins, avec l’évolution des méthodes d’évaluation fonctionnelle vestibulaire, les questions concernant les zones anatomiques précises des lésions qui causent les symptômes des VPUA se posent de plus en plus. L’hypothèse d’une origine intralabyrinthique est désormais privilégiée [48]. Quelques modèles d’inflammation de l’oreille interne ont été développés avec, comme inducteur, le cytomégalovirus, ou d’administration intra-intratympanique de lipopolysaccharide, un composant de la paroi bactérienne [49, 50] (Figure 2A). Cependant, ces modèles n’ont pas été utilisés pour le criblage de molécules thérapeutiques en raison de leur manque de reproductibilité mais aussi parce qu’ils ne génèrent pas systématiquement de syndrome vertigineux.
Modèles de neuroinflammation du système vestibulaire central
Le modèle de NVU génère une inflammation vestibulaire centrale qui touche essentiellement les noyaux vestibulaires déconnectés du nerf VIII [51–55] (Figure 4). Ce modèle reproduit le phénotype comportemental typique d’une vestibulopathie périphérique unilatérale aiguë (VPUA). Il s’agit d’un modèle intéressant pour étudier le rôle de l’inflammation centrale dans la physiopathologie vestibulaire, mais également pour analyser l’effet d’une modulation pharmacologique de l’inflammation sur l’expression de la maladie. D’autre modèle de vestibulopathies sont connus pour induire une inflammation vestibulaire centrale. C’est le cas du modèle arsanilate [55], et du modèle de destruction labyrinthique chirurgical [56, 57]. L’inflammation centrale induite reste cependant la plus intense avec le modèle NVU.
 |
Figure 4. Neurectomie vestibulaire unilatérale et inflammation des noyaux vestibulaires. La neurectomie vestibulaire unilatérale (NVU) est un modèle inflammatoire car il engendre une augmentation et une hypertrophie des cellules astrocytaires et microgliales, principalement dans les noyaux vestibulaires. A. Absence de réponse inflammatoire sans lésion. B. Présence de réponse inflammatoire avec lésion (figure créée avec Biorender.com). |
Modèles de blocage transitoire de l’excitabilité neuronale périphérique : anesthésie vestibulaire
Le principe de la vestibulo-suppression ou vestibulo-modulation consiste à moduler les effecteurs moléculaires (les canaux ioniques) exprimés tout au long du réseau sensoriel vestibulaire afin de contrôler l’information sensorielle générée au niveau du vestibule, et qui est transmise vers les noyaux du tronc cérébral via le nerf vestibulaire. Cette démarche, dont l’origine remonte aux travaux de Robert Bárány7 (1876-1936) effectués au cours de la première partie du XXe siècle [58], partait du principe que les épisodes de crise de vertige observés chez le patient présentant une maladie de Ménière, résultaient d’une hyperexcitabilité transitoire unilatérale des neurones primaires vestibulaire, elle-même résultant d’un dysfonctionnement inconnu affectant un vestibule. La réponse proposée alors par Bárány consistait à contrecarrer cette hyperexcitabilité nerveuse au moyen de bloqueurs de l’influx neuronal. Il administra, par voie intraveineuse, à des patients souffrant de la maladie de Ménière en cours de crise aiguë, des antagonistes des canaux sodiques sensibles au voltage, tels que la lidocaïne. Cette opération, par définition vestibulo-suppressante ou vestibulo-plégique, évolua par la suite, pour des raisons de risques cardiaques et neurologiques, vers une application locale par voie transtympanique. Elle pris alors le nom « d’anesthésie vestibulaire » ou « d’anesthésie de l’oreille interne » [59]. Depuis ces travaux, de nombreuses études cliniques ont démontré un bénéfice significatif de ce type d’approche locale, sans pour autant que ce protocole ne devienne le traitement standard des épisodes aigus de la maladie de Ménière ou d’autres désordres vestibulaires, tels que ceux regroupés par GM Halmagyi (Institute of Clinical Neurosciences, Camperdown, Australie) sous le terme de syndromes de déafférentation vestibulaire unilatérale [60, 61]. Cela peut sans doute s’expliquer par les risques d’actions vestibulo-suppressantes inappropriées : des effets produits en dehors de la fenêtre temporelle d’hyperexcitabilité unilatérale, ou, surtout, d’inhibitions unilatérales trop prononcées, conduisant à une amplification du déséquilibre de l’activité vestibulaire et à une exacerbation du syndrome vertigineux, plutôt qu’à son atténuation.
L’administration transtympanique de tétrodotoxine (TTX) procède du même mécanisme de blocage de l’excitabilité des cellules du vestibule. Seuls à posséder des canaux sodiques activés par le voltage au stade adulte, les neurones vestibulaires primaires sont les principales cibles de l’action inhibitrice de la TTX [62]. Cette opération provoque la génération d’un syndrome vestibulaire aigu transitoire (Figure 5A). C’est aussi une forme de déafférentation fonctionnelle réversible.
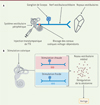 |
Figure 5. A. Injection de TTX et syndrome vestibulaire transitoire. L’injection transtympanique de tétrodotoxine (TTX) réduit l’excitabilité des neurones vestibulaires primaires en bloquant les canaux sodiques dépendants du voltage, et conduit à un déséquilibre électrophysiologique qui sous-tend le syndrome vestibulaire transitoire. B. Rôle de la sérotonine dans l’induction du vertige par stimulation calorique. La stimulation calorique conduit à des modifications de l’activité des afférences vestibulaires primaires : augmentation d’activité sous eau chaude et diminution d’activité sous eau froide. La stimulation calorique perturberait l’homéostasie électrophysiologique par le biais d’une dérégulation immédiate et significative de la sérotonine. Ce mécanisme participerait à la potentialisation des vertiges (figure créée avec Biorender.com). |
Modèles d’irrigation calorique de l’oreille interne
Bárány fut le premier à comprendre que l’irrigation du canal auditif par de l’eau chaude ou froide créait des mouvements de convection du liquide endolymphatique dans les canaux semi-circulaires et activait ainsi les cellules mécanoréceptrices de l’oreille interne, avec l’eau froide comme inhibiteur du vestibule, et l’eau chaude comme excitant. La méthode de stimulation calorique, qui lui valut le prix Nobel en 1914 [63] est aujourd’hui un outil communément utilisé pour tester les fonctions canalaires chez l’homme comme chez l’animal. Un de ses principaux avantages est de pouvoir induire un syndrome vertigineux de manière simple et non invasive. Cette méthode a permis de mettre en évidence le rôle de la sérotonine dans l’induction de la crise de vertige [64] (Figure 5B). Elle a été récemment utilisée chez l’homme pour valider le potentiel antivertigineux de candidats médicaments [65].
De nouvelles approches pour l’évaluation comportementale du syndrome vestibulaire chez l’animal
Analyse quantitative subjective
Dans les modèles de rongeurs, l’évaluation des conséquences comportementales d’une atteinte vestibulaire unilatérale est essentiellement fondée sur une mesure quantitative subjective d’un ensemble de symptômes vestibulaires (rotation sur l’axe vertical, inclinaison de la tête, chutes, rétropulsion, etc.) établissant des échelles de score variées [21, 31, 32, 45]. Ces différentes échelles décrivent la cinétique globale du syndrome : les symptômes sont exprimés à leur apogée les trois premiers jours post-lésionnels (période critique), puis s’atténuent progressivement pour revenir à des valeurs pré-lésionnelles (compensation vestibulaire).
Chez l’homme, comme dans les modèles animaux, l’analyse quantitative subjective consiste à évaluer un certain nombre de marqueurs physiologiques ou posturo-locomoteurs (par exemple, la fréquence cardiaque, le rythme de sommeil, la longueur de pas, le temps de phase d’appuis, etc.). Ces paramètres sont sélectionnés après une phase clinique d’observation, dans un environnement connu, afin de déterminer si leurs variations, à un instant prédéterminé ou sur une période de temps définie, sont statistiquement significatives, l’idéal étant de pouvoir faire un recueil de ces informations avec un minimum d’interaction, ou avec une maîtrise parfaite de l’environnement de l’individu. L’utilisation du modèle animal est ainsi toute indiquée afin de récolter des données avec un minimum de biais.
Analyse automatisée : paramètres vestibulaires dynamiques
Le test de suivi vidéo de l’animal en champ ouvert (utilisant le logiciel de suivi Ethovision XT 14, Noldus) a été récemment adapté afin d’identifier et de quantifier, de manière automatisée et non biaisée, différents marqueurs posturo-locomoteurs spécifiques de la vestibulopathie périphérique unilatérale aiguë (VPUA). Cette analyse comportementale est réalisée en conditions dynamiques et spontanées, sans aucune contrainte pour l’animal. Elle fournit des données, telles que la vélocité de locomotion, la distance parcourue, la qualité de la locomotion, le temps d’immobilité, l’accélération du patron locomoteur, la position du corps dans l’espace ainsi que le comportement rotatoire typique d’une atteinte vestibulaire [32].
Analyse automatisée : paramètres vestibulaires statiques
Une méthode d’analyse automatisée du syndrome vestibulaire a été développée. Elle repose sur l’utilisation du dispositif de distribution pondérale (DWB®, Bioseb), un système permettant l’analyse de la posture des animaux par la répartition du poids sur chacune des quatre pattes. Ce dispositif permet de quantifier des marqueurs de l’instabilité posturale dans le modèle rongeur de la VPUA, tels que la surface du polygone de sustentation, la distribution pondérale de l’animal sur l’axe latéral, le temps d’utilisation de l’abdomen comme support, le nombre de rotations effectuées par unité de temps, ainsi que des paramètres similaires à ceux utilisés en posturologie clinique, tels que le barycentre [31, 66].
Analyse cognitive : quantification des déficits cognitifs
La cognition spatiale repose sur l’intégration de deux types d’informations sensorielles : celles appelées allothétiques (fondées principalement sur les informations visuelles), et celles appelées idiothétiques (dont le système vestibulaire est une source majeure chez les mammifères) [62]. Au cours des deux dernières décennies, il est devenu évident que le système vestibulaire était impliqué dans beaucoup de fonctions autres que la simple fonction réflexive. En effet, de nombreuses études, réalisées chez l’animal et chez l’homme, ont démontré que la dysfonction vestibulaire était associée à diverses formes de troubles cognitifs, notamment liés à la mémoire spatiale [67, 68]. De nombreux travaux ont exploré les liens entre système vestibulaire et cognition spatiale chez le rongeur. Beaucoup se sont focalisés sur l’impact de lésions vestibulaires sur le comportement de navigation chez le rat. Dans le cas de lésions vestibulaires bilatérales (destruction périphérique des récepteurs vestibulaires), des déficits comportementaux ont été observés et cela, à très long terme, suggérant leur potentielle irréversibilité [69]. Concernant les lésions vestibulaires unilatérales, bien que des déficits soient observés pendant très longtemps, ils ne sont pas permanents [70].
Comment améliorer la prédictibilité des modèles d’étude de vestibulopathies périphériques ?
L’amélioration de la prédictibilité d’un modèle d’étude nécessite de se rapprocher au plus près des conditions de la maladie humaine. Lorsque ces conditions ne sont pas connues, ou peu comprises, comme c’est le cas de la plupart des désordres vestibulaires, il s’agira de reproduire les symptômes de la maladie par des approches mimant les processus neurophysiologiques responsables du syndrome vertigineux. Certaines maladies vestibulaires constituent en ce sens un vrai défi. C’est le cas, par exemple, des vertiges posturaux perceptifs persistants (VPPP) qui se manifestent le plus souvent par des instabilités, exacerbées par la posture droite, les mouvements actifs ou passifs et les stimulus visuels complexes. Ils sont souvent accompagnés d’un état d’anxiété important [71]. Ces conditions sont particulièrement difficiles à apprécier chez l’animal en raison de l’absence de retour verbal. Dans ce cas précis, il s’agira d’imaginer des tests qui traduisent l’état émotionnel et perceptif de l’animal. Bien qu’il soit possible de transposer aux modèles animaux de désordres vestibulaires des tests quantifiant le niveau d’anxiété (labyrinthe en croix surélevé, thigmotaxie8 en champ ouvert, etc.), très peu de tests concernent les aspects purement perceptifs. De tels tests devraient être développés afin de mieux comprendre les mécanismes de conditionnement de l’anxiété en cas d’atteintes vestibulaires.
Les biomarqueurs biologiques sont sous-utilisés en clinique du vertige. Pourtant, des profils hormonaux spécifiques favorisent l’apparition de troubles vestibulaires, et l’expression du syndrome vertigineux s’accompagne de variations hormonales. Le lien entre dérégulations endocriniennes et altérations vestibulaires n’est plus à prouver. Cependant, il existe encore peu de données sur la corrélation précise entre variations hormonales et syndrome vertigineux et très peu d’études sont consacrées à la recherche de biomarqueurs permettant de distinguer les différents types et stades des maladies vestibulaires [72]. Développer de nouveaux outils de diagnostic fiables reste donc une nécessité.
Conclusion
Face au manque de données sur l’étiologie des vestibulopathies périphériques, et considérant leur hétérogénéité interindividuelle, les modèles animaux de maladies vestibulaires offrent l’opportunité de développer de nouveaux candidats médicaments plus ciblés et plus efficaces pour contrer les symptômes de ces affections. Ces modèles sont aussi des outils particulièrement adaptés pour analyser les changements structuraux qui se produisent sur le réseau vestibulaire au cours des approches rééducatives. L’application de nouvelles méthodes comportementales d’analyses posturo-locomotrices aux modèles utilisant des rongeurs, compatibles avec les contraintes de la clinique humaine, devrait permettre d’améliorer encore le diagnostic des atteintes vestibulaires périphériques et aider à définir de nouveau marqueurs biologiques, physiologiques et comportementaux pour le suivi sur le long terme des patients.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Lacour M, Dutheil S, Tighilet B, et al. Tell me your vestibular deficit, and i’ll tell you how you’ll compensate. Ann NY Acad Sci 2009 ; 1164 : 268–278. [CrossRef] [Google Scholar]
- ICVD Consensus Documents. The Barany Society. https://www.thebaranysociety.org/icvd-consensus-documents/. [Google Scholar]
- Angelaki DE, Cullen KE. Vestibular system: the many facets of a multimodal sense. Annu Rev Neurosci 2008 ; 31 : 125–150. [CrossRef] [PubMed] [Google Scholar]
- Lacour M, Helmchen C, Vidal P-P. Vestibular compensation: the neuro-otologist’s best friend. J Neurol 2016 ; 263 : 54–64. [CrossRef] [Google Scholar]
- Precht W, Shimazu H, Markham CH. A mechanism of central compensation of vestibular function following hemilabyrinthectomy. J Neurophysiol 1966 ; 29 : 996–1010. [CrossRef] [PubMed] [Google Scholar]
- Wiener-Vacher SR, Obeid R, Abou-Elew M. Vestibular impairment after bacterial meningitis delays infant posturomotor development. J Pediatr 2012 ; 161 : 246–51.e1. [CrossRef] [PubMed] [Google Scholar]
- Arbusow V, Schulz P, Strupp M, et al. Distribution of herpes simplex virus type 1 in human geniculate and vestibular ganglia: implications for vestibular neuritis. Ann Neurol 1999 ; 46 : 416–419. [CrossRef] [PubMed] [Google Scholar]
- Perny M, Roccio M, Grandgirard D, et al. The Severity of Infection Determines the Localization of Damage and Extent of Sensorineural Hearing Loss in Experimental Pneumococcal Meningitis. J Neurosci 2016 ; 36 : 7740–7749. [CrossRef] [PubMed] [Google Scholar]
- Sung CYW, Seleme MC, Payne S, et al. Virus-induced cochlear inflammation in newborn mice alters auditory function. JCI Insight 2019; 4. [Google Scholar]
- Rutka J.. Aminoglycoside Vestibulotoxicity. Adv Otorhinolaryngol 2019 ; 82 : 101–110. [PubMed] [Google Scholar]
- Llorens J, Callejo A, Greguske EA, et al. Physiological assesment of vestibular function and toxicity in humans and animals. Neurotoxicology 2018 ; 66 : 204–212. [CrossRef] [PubMed] [Google Scholar]
- Callejo A, Durochat A, Bressieux S, et al. Dose-dependent cochlear and vestibular toxicity of trans-tympanic cisplatin in the rat. NeuroToxicology 2017 ; 60. [PubMed] [Google Scholar]
- Vignaux G, Chabbert C, Gaboyard-Niay S, et al. Evaluation of the chemical model of vestibular lesions induced by arsanilate in rats. Toxicol Appl Pharmacol 2012 ; 258 : 61–71. [CrossRef] [PubMed] [Google Scholar]
- Besnard S, Machado M l., Vignaux G, et al. Influence of vestibular input on spatial and nonspatial memory and on hippocampal NMDA receptors. Hippocampus 2012; 22 : 814–26. [CrossRef] [PubMed] [Google Scholar]
- Hatat B, Boularand R, Bringuier C, et al. Vertigoheel improves central vestibular compensation after unilateral peripheral vestibulopathy in rats. Front Neurol 2022; 13 : 969047. [CrossRef] [PubMed] [Google Scholar]
- Strupp M, Feil K, Dieterich M, et al. Bilateral vestibulopathy. Handb Clin Neurol 2016 ; 137 : 235–240. [CrossRef] [PubMed] [Google Scholar]
- Foster CA, Breeze RE. The Meniere attack: an ischemia/reperfusion disorder of inner ear sensory tissues. Med Hypotheses 2013 ; 81 : 1108–1115. [CrossRef] [PubMed] [Google Scholar]
- Kim J-S, Newman-Toker DE, Kerber KA, et al. Vascular vertigo and dizziness: Diagnostic criteria. J Vestib Res 2022; 32 : 205–22. [CrossRef] [PubMed] [Google Scholar]
- Mom T, Avan P, Bonfils P, et al. A model of cochlear function assessment during reversible ischemia in the Mongolian gerbil. Brain Res Brain Res Protoc 1999 ; 4 : 249–257. [CrossRef] [PubMed] [Google Scholar]
- Lee JO, Park S-H, Kim HJ, et al. Vulnerability of the vestibular organs to transient ischemia: implications for isolated vascular vertigo. Neurosci Lett 2014 ; 558 : 180–185. [CrossRef] [PubMed] [Google Scholar]
- Cassel R, Bordiga P, Carcaud J, et al. Morphological and functional correlates of vestibular synaptic deafferentation and repair in a mouse model of acute-onset vertigo. Dis Model Mech 2019; 12 : dmm039115. [CrossRef] [PubMed] [Google Scholar]
- Hallpike CS, Cairns H. Observations on the Pathology of Ménière’s Syndrome. Proc R Soc Med 1938 ; 31 : 1317–1336. [PubMed] [Google Scholar]
- Attyé A, Eliezer M, Medici M, et al. In vivo imaging of saccular hydrops in humans reflects sensorineural hearing loss rather than Meniere’s disease symptoms. Eur Radiol 2018 ; 28 : 2916–2922. [CrossRef] [PubMed] [Google Scholar]
- Chabbert C, Charpiot A. Proceedings of the GDR Vertige 2019 annual meeting devoted to endolymphatic hydrops. J Vestib Res 2021; 31 : 243–5. [CrossRef] [PubMed] [Google Scholar]
- Salt AN, Plontke SK. Endolymphatic hydrops: pathophysiology and experimental models. Otolaryngol Clin North Am 2010 ; 43 : 971–983. [CrossRef] [PubMed] [Google Scholar]
- Seo YJ, Brown D. Experimental Animal Models for Meniere’s Disease: A Mini-Review. J Audiol Otol 2020; 24 : 53–60. [CrossRef] [PubMed] [Google Scholar]
- Xu L-H, Tang G-R, Yang J-J, et al. AVP modulation of the vestibular nucleus via V1b receptors potentially contributes to the development of motion sickness in rat. Mol Brain 2015 ; 8 : 86. [CrossRef] [PubMed] [Google Scholar]
- Stewart CE, Holt AG, Altschuler RA, et al. Effects of Noise Exposure on the Vestibular System: A Systematic Review. Front Neurol 2020; 11. [PubMed] [Google Scholar]
- Kim J, Xia A, Grillet N, et al. Osmotic stabilization prevents cochlear synaptopathy after blast trauma. Proc Natl Acad Sci U S A 2018 ; 115 : E4853–E4860. [PubMed] [Google Scholar]
- Deveze A, Bernard-Demanze L, Xavier F, et al. Vestibular compensation and vestibular rehabilitation. Current concepts and new trends. Neurophysiol Clin 2014 ; 44 : 49–57. [CrossRef] [PubMed] [Google Scholar]
- Marouane E, Rastoldo G, El Mahmoudi N, et al. Identification of New Biomarkers of Posturo-Locomotor Instability in a Rodent Model of Vestibular Pathology. Front Neurol 2020; 11. [PubMed] [Google Scholar]
- Rastoldo G, Marouane E, El Mahmoudi N, et al. Quantitative Evaluation of a New Posturo-Locomotor Phenotype in a Rodent Model of Acute Unilateral Vestibulopathy. Front Neurol 2020; 11. [PubMed] [Google Scholar]
- Tighilet B, Chabbert C. Adult neurogenesis promotes balance recovery after vestibular loss. Prog Neurobiol 2019 ; 174 : 28–35. [CrossRef] [PubMed] [Google Scholar]
- Tighilet B, Trottier S, Lacour M. Dose- and duration-dependent effects of betahistine dihydrochloride treatment on histamine turnover in the cat. Eur J Pharmacol 2005 ; 523 : 54–63. [CrossRef] [PubMed] [Google Scholar]
- Tighilet B, Leonard J, Bernard-Demanze L, et al. Comparative analysis of pharmacological treatments with N-acetyl-dl-leucine (Tanganil) and its two isomers (N-acetyl-L-leucine and N-acetyl-D-leucine) on vestibular compensation: Behavioral investigation in the cat. Eur J Pharmacol 2015 ; 769 : 342–349. [CrossRef] [PubMed] [Google Scholar]
- Dutheil S, Lacour M, Tighilet B. Neurogenic Potential of the Vestibular Nuclei and Behavioural Recovery Time Course in the Adult Cat Are Governed by the Nature of the Vestibular Damage. PLoS One 2011 ; 6 : e22262. [CrossRef] [PubMed] [Google Scholar]
- Liberman MC, Kujawa SG. Cochlear synaptopathy in acquired sensorineural hearing loss: Manifestations and mechanisms. Hear Res 2017 ; 349 : 138–147. [CrossRef] [PubMed] [Google Scholar]
- Viana LM, O’Malley JT, Burgess BJ, et al. Cochlear neuropathy in human presbycusis: Confocal analysis of hidden hearing loss in post-mortem tissue. Hear Res 2015 ; 327 : 78–88. [CrossRef] [PubMed] [Google Scholar]
- Niparko JK. Pathology of the ear, Second Edition. By Harold F. Schuknecht, Lea & Febiger, Malvern, Pennsylvania, 1993, 672 pp, 9.50. Head & Neck 1994 ; 16 : 298. [CrossRef] [Google Scholar]
- Rauch SD. Vestibular histopathology of the human temporal bone. What can we learn?. Ann N Y Acad Sci 2001 ; 942 : 25–33. [Google Scholar]
- Wan G, Ji L, Schrepfer T, et al. Synaptopathy as a Mechanism for Age-Related Vestibular Dysfunction in Mice. Front Aging Neurosci 2019; 11. [PubMed] [Google Scholar]
- Puel JL, Pujol R, Tribillac F, et al. Excitatory amino acid antagonists protect cochlear auditory neurons from excitotoxicity. J Comp Neurol 1994 ; 341 : 241–256. [CrossRef] [PubMed] [Google Scholar]
- Brugeaud A, Travo C, Demêmes D, et al. Control of Hair Cell Excitability by Vestibular Primary Sensory Neurons. J Neurosci 2007 ; 27 : 3503–3511. [CrossRef] [PubMed] [Google Scholar]
- Dyhrfjeld-Johnsen J, Gaboyard-Niay S, Broussy A, et al. Ondansetron reduces lasting vestibular deficits in a model of severe peripheral excitotoxic injury. J Vestib Res 2013 ; 23 : 177–186. [CrossRef] [PubMed] [Google Scholar]
- Gaboyard-Niay S, Travo C, Saleur A, et al. Correlation between afferent rearrangements and behavioral deficits after local excitotoxic insult in the mammalian vestibule: a rat model of vertigo symptoms. Dis Model Mech 2016 ; 9 : 1181–1192. [PubMed] [Google Scholar]
- Cassel R, Wiener-Vacher S, El Ahmadi A, et al. Reduced Balance Restoration Capacities Following Unilateral Vestibular Insult in Elderly Mice. Front Neurol 2018; 9. [PubMed] [Google Scholar]
- Ruttin B.. Zur differentialdiagnose der labyrinth. Horenrverkrankugen Z Ohrenheilk 1909 ; 57 : 327–331. [Google Scholar]
- Hegemann SCA, Wenzel A. Diagnosis and Treatment of Vestibular Neuritis/Neuronitis or Peripheral Vestibulopathy (PVP)? Open Questions and Possible answers. Otol Neurotol 2017 ; 38 : 626–631. [CrossRef] [PubMed] [Google Scholar]
- Bradford RD, Yoo Y-G, Golemac M, et al. Murine CMV-Induced Hearing Loss Is Associated with Inner Ear Inflammation and Loss of Spiral Ganglia Neurons. PLoS Pathog 2015 ; 11 : e1004774. [CrossRef] [PubMed] [Google Scholar]
- Zhang J, Chen S, Hou Z, et al. Lipopolysaccharide-Induced Middle Ear Inflammation Disrupts the cochlear Intra-Strial Fluid-Blood Barrier through Down-Regulation of Tight Junction Proteins. PLoS One 2015 ; 10 : e0122572. [CrossRef] [PubMed] [Google Scholar]
- Dutheil S, Escoffier G, Gharbi A, et al. GABA A Receptor Agonist and Antagonist Alter Vestibular Compensation and Different Steps of Reactive Neurogenesis in Deafferented Vestibular Nuclei of Adult Cats. J Neurosc. 2013 ; 33 : 15555–15566. [CrossRef] [PubMed] [Google Scholar]
- El Mahmoudi N, Rastoldo G, Marouane E, et al. Breaking a dogma: acute anti-inflammatory treatment alters both post-lesional functional recovery and endogenous adaptive plasticity mechanisms in a rodent model of acute peripheral vestibulopathy. J Neuroinflammation 2021; 18 : 183. [CrossRef] [PubMed] [Google Scholar]
- El Mahmoudi N, Marouane E, Rastoldo G, et al. Microglial Dynamics Modulate Vestibular Compensation in a Rodent Model of Vestibulopathy and Condition the Expression of Plasticity Mechanisms in the Deafferented Vestibular Nuclei. Cells 2022; 11 : 2693. [CrossRef] [PubMed] [Google Scholar]
- Marouane E, El Mahmoudi N, Rastoldo G, et al. Sensorimotor Rehabilitation Promotes Vestibular Compensation in a Rodent Model of Acute Peripheral Vestibulopathy by Promoting Microgliogenesis in the Deafferented Vestibular Nuclei. Cells 2021; 10 : 3377. [CrossRef] [PubMed] [Google Scholar]
- Liberge M, Manrique C, Bernard-Demanze L, et al. Changes in TNFα, NFκB and MnSOD protein in the vestibular nuclei after unilateral vestibular deafferentation. J Neuroinflammation 2010 ; 7 : 91. [CrossRef] [PubMed] [Google Scholar]
- de Waele C, Campos Torres A, Josset P, et al. Evidence for reactive astrocytes in rat vestibular and cochlear nuclei following unilateral inner ear lesion. Eur J Neurosci 1996 ; 8 : 2006–2018. [CrossRef] [PubMed] [Google Scholar]
- Campos Torres A, Vidal PP, Waele C de. Evidence for a microglial reaction within the vestibular and cochlear nuclei following inner ear lesion in the rat. Neuroscience 1999; 92 : 1475–90. [CrossRef] [PubMed] [Google Scholar]
- Barany B.. Beeinflussing des Ohrensausen durch intravenös injizierte Lokalanästhetica. Acta Otolaryngol 1935 ; 23 : 201–207. [Google Scholar]
- Adunka O, Moustaklis E, Weber A, et al. Labyrinth anesthesia–a forgotten but practical treatment option in Ménière’s disease. ORL J Otorhinolaryngol Relat Spec 2003 ; 65 : 84–90. [CrossRef] [PubMed] [Google Scholar]
- Fradis M, Podoshin L, Ben-David J, et al. Treatment of Meniere’s disease by intratympanic injection with lidocaine. Arch Otolaryngol 1985 ; 111 : 491–493. [CrossRef] [Google Scholar]
- Rahm WE, Strother WF, Crump JF, et al. The effects of anesthetics upon the ear. IV. Lidocaine hydrochloride. Ann Otol Rhinol Laryngol 1962 ; 71 : 116–123. [CrossRef] [PubMed] [Google Scholar]
- Jacob P-Y, Poucet B, Liberge M, et al. Vestibular control of entorhinal cortex activity in spatial navigation. Front Integr Neurosci 2014 ; 8 : 38. [PubMed] [Google Scholar]
- Lopez C, Blanke O. Nobel Prize centenary: Robert Bárány and the vestibular system. Curr Biol 2014 ; 24 : R1026–R1028. [CrossRef] [PubMed] [Google Scholar]
- Ma F, Liu J, Li X, et al. Effects of caloric vestibular stimulation on serotoninergic system in the media vestibular nuclei of guinea pigs. Chin Med J 2007 ; 120 : 120–124. [CrossRef] [PubMed] [Google Scholar]
- Venail F, Attali P, Wersinger E, et al. Safety, tolerability, pharmacokinetics and pharmacokinetic-pharmacodynamic modelling of the novel H4 receptor inhibitor SENS-111 using a modified caloric test in healthy subjects. Br J Clin Pharmacol 2018 ; 84 : 2836–2848. [CrossRef] [PubMed] [Google Scholar]
- Tighilet B, Péricat D, Frelat A, et al. Adjustment of the dynamic weight distribution as a sensitive parameter for diagnosis of postural alteration in a rodent model of vestibular deficit. PLoS One 2017 ; 12 : e0187472. [CrossRef] [PubMed] [Google Scholar]
- Smith PF. Hearing loss versus vestibular loss as contributors to cognitive dysfunction. J Neurol 2022; 269 : 87–99. [CrossRef] [PubMed] [Google Scholar]
- Bigelow RT, Agrawal Y. Vestibular involvement in cognition: Visuospatial ability, attention, executive function, and memory. J Vestib Res 2015 ; 25 : 73–89. [CrossRef] [PubMed] [Google Scholar]
- Baek JH, Zheng Y, Darlington CL, et al. Evidence that spatial memory deficits following bilateral vestibular deafferentation in rats are probably permanent. Neurobiol Learn Mem 2010 ; 94 : 402–413. [CrossRef] [PubMed] [Google Scholar]
- Zheng Y, Darlington CL, Smith PF. Impairment and recovery on a food foraging task following unilateral vestibular deafferentation in rats. Hippocampus 2006 ; 16 : 368–378. [CrossRef] [PubMed] [Google Scholar]
- Staab JP, Eckhardt-Henn A, Horii A, et al. Diagnostic criteria for persistent postural-perceptual dizziness (PPPD): Consensus document of the committee for the Classification of Vestibular Disorders of the Bárány Society. J Vestib Res 2017 ; 27 : 191–208. [CrossRef] [PubMed] [Google Scholar]
- El Khiati R, Tighilet B, Besnard S, et al. Hormones and Vestibular Disorders: The Quest for Biomarkers. Brain Sciences 2022; 12 : 592. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Déséquilibre électrophysiologique sous-tendant le syndrome vestibulaire. Après lésion vestibulaire, les noyaux vestibulaires ipsilatéraux à la lésion présentent un déficit d’excitabilité, à l’inverse des noyaux vestibulaires controlatéraux à la lésion. Cet effet s’explique par les neurones secondaires vestibulaires qui relient les noyaux vestibulaires bilatéraux : les neurones excitateurs de types I et les neurones inhibiteurs de type II qui reçoivent une excitation différentielle du nerf vestibulaire (selon le côté lésé ou non lésé). Il en découle un déséquilibre électrophysiologique qui sous-tend le syndrome vestibulaire composé de plusieurs symptômes : perceptivo-cognitifs, végétatifs, oculomoteurs et posturo-locomoteurs (figure créée avec Biorender.com). |
| Dans le texte | |
 |
Figure 2. Les modèles vestibulaires utilisés en recherche. Différents modèles animaux induisant une asymétrie électrophysiologique entre les noyaux vestibulaires bilatéraux ont été mis au point afin d’étudier le syndrome vestibulaire. A. Injections de composés ototoxiques (antibiotiques, chimiques et agents chimio-thérapeutiques), injection transtympanique d’arsanilate, infection par le cytomégalovirus, injection de lipopolysaccharide (LPS) et injection de tétrodotoxine (TTX). B. Neurectomie vestibulaire unilatérale (NVU) définie par une section chirurgicale du nerf vestibulaire détruisant le ganglion de Scarpa. C. Labyrinthectomie unilatérale chirurgicale (LU) définie par une destruction des récepteurs vestibulaires avec préservation du ganglion de Scarpa (figure créée avec Biorender.com). |
| Dans le texte | |
 |
Figure 3. Injection de TTK et lésion excitotoxique de l’oreille interne. L’injection d’acide kainique (TTK) entraîne une souffrance des afférences primaires au contact des cellules ciliées vestibulaires situées dans les organes otolithiques (saccule, utricule) et les ampoules selon une temporalité précise. Les terminaisons nerveuses afférentes gonflent (1 heure après injection), entraînant leur résorption (7-12 heures après injection) suivie d’une réparation (à compter d’une semaine après la lésion). L’altération de la zone de contact entre cellules ciliées vestibulaires de l’oreille interne et afférences (bleu) formant le nerf vestibulaire engendre un syndrome vestibulaire transitoire (figure créée avec Biorender.com). |
| Dans le texte | |
 |
Figure 4. Neurectomie vestibulaire unilatérale et inflammation des noyaux vestibulaires. La neurectomie vestibulaire unilatérale (NVU) est un modèle inflammatoire car il engendre une augmentation et une hypertrophie des cellules astrocytaires et microgliales, principalement dans les noyaux vestibulaires. A. Absence de réponse inflammatoire sans lésion. B. Présence de réponse inflammatoire avec lésion (figure créée avec Biorender.com). |
| Dans le texte | |
 |
Figure 5. A. Injection de TTX et syndrome vestibulaire transitoire. L’injection transtympanique de tétrodotoxine (TTX) réduit l’excitabilité des neurones vestibulaires primaires en bloquant les canaux sodiques dépendants du voltage, et conduit à un déséquilibre électrophysiologique qui sous-tend le syndrome vestibulaire transitoire. B. Rôle de la sérotonine dans l’induction du vertige par stimulation calorique. La stimulation calorique conduit à des modifications de l’activité des afférences vestibulaires primaires : augmentation d’activité sous eau chaude et diminution d’activité sous eau froide. La stimulation calorique perturberait l’homéostasie électrophysiologique par le biais d’une dérégulation immédiate et significative de la sérotonine. Ce mécanisme participerait à la potentialisation des vertiges (figure créée avec Biorender.com). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




