| Issue |
Med Sci (Paris)
Volume 39, Number 6-7, Juin-Juillet 2023
|
|
|---|---|---|
| Page(s) | 537 - 543 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023082 | |
| Published online | 30 June 2023 | |
Les neurones contactant le liquide cérébrospinal
Une intégration sensorielle polymodale
Polymodal sensory integration at the interface with the cerebrospinal fluid
Sorbonne université, Inserm U1127, UMR CNRS 7225, institut du cerveau (ICM), 47 boulevard de l’Hôpital, 75013 Paris, France
*
claire.wyart@icm-institute.org
Le liquide cérébrospinal est le siège d’une interface sensorielle qui permet des interactions entre le système nerveux et le reste du corps. Au centre de la moelle épinière, des neurones sensoriels en contact avec le liquide cérébrospinal détectent des changements de son contenu et s’activent lorsque sa composition change, en particulier lors d’une infection bactérienne du système nerveux central. Ces neurones de contact forment aussi un système mécanosensoriel axial détectant la courbure spinale grâce à un couplage avec la fibre de Reissner, un long polymère protéique situé dans le canal central. Sous l’effet d’une compression, les neurones de contact s’activent et modulent l’activité des circuits moteurs antérieurs au niveau du tronc cérébral et de la moelle épinière, contribuant à augmenter la vitesse du mouvement et à stabiliser la posture. Ce système sensoriel permet l’alignement de la colonne vertébrale en agissant sur sa structure via la libération de peptides de la famille de l’urotensine-II dont les récepteurs sont situés dans les muscles squelettiques.
Abstract
The cerebrospinal fluid is the site of a sensory interface that allows interactions between the nervous system and cellular targets throughout the body. Sensory neurons in contact with the cerebrospinal fluid in the spinal cord respond to changes of its composition, in particular in the context of bacterial infections of the central nervous system. These cerebrospinal fluid-contacting neurons also form an axial mechanosensory system that detects spinal curvature through the coupling with a long a proteinaceous polymer under tension in the central canal called the Reissner fiber. Activated by compression of the body axis, neurons contacting the cerebrospinal fluid modulate motor circuits to increase the speed of movement and to stabilize posture. During development and aging, this sensory system aligns the body axis and spine via the release of peptides of the urotensin family that act at long range on their receptors expressed in skeletal muscles.
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.

Vignette (© Headquarter)
Le liquide cérébrospinal circule dans les ventricules cérébraux, au niveau du canal central au centre de la moelle épinière, et dans les espaces sous-arachnoïdiens entourant le système nerveux central. Ce liquide assure le transport de biomolécules essentielles à la neurogenèse dans le cerveau, ainsi que l’élimination des déchets toxiques et des métabolites pendant le sommeil. Le liquide cérébrospinal est produit à partir du plasma par l’épithélium des plexus choroïdes qui régit sa composition [1, 2] en coordination avec d’autres structures dispersées dans le cerveau et la moelle épinière, telles que la glande pinéale, l’organe sous-commissural [3] ou les neurones de contact [4] ( Figure 1 ). L’organe sous-commissural (SCO, pour subcommissural organ) sécrète en particulier la SCO-spondine, une glycoprotéine qui, en se polymérisant, forme la fibre de Reissner, une fibre protéique qui s’étend du troisième ventricule, au centre du cerveau, à l’extrémité caudale du canal central, dans la moelle épinière [5]. Bien que cette fibre ait été découverte en 1860, son rôle est resté inconnu avant que des modèles génétiques de perte de fonction ne permettent d’élucider ses fonctions [6-8]. Une question centrale se pose : du fait que le liquide cérébrospinal contient des substances neuroactives qui peuvent agir à longue distance, peut-il servir de voie de communication avec des neurones distants, voire même, via la circulation lymphatique et sanguine, agir sur d’autres cellules distribuées dans l’organisme ?
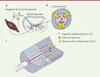 |
Figure 1. Les neurones de contact avec le liquide cérébrospinal tapissent les parois du canal central où ils sont très proches de la fibre de Reissner. A. Le canal central (CC) permet la circulation du liquide cérébrospinal (LCS) au sein de la moelle épinière, confinée dans la colonne vertébrale. Alors que l’emphase du contrôle sensoriel rétroactif a focalisé sur les circuits périphériques impliquant les neurones de la racine dorsale, les neurones de contact (en jaune) sont des cellules sensorielles localisées dans la moelle épinière elle-même, qui appartiennent au système nerveux central. B. Les neurones de contact dans la moelle épinière (en jaune) se logent entre les cellules épendymaires et se caractérisent par une extension apicale qui baigne dans le liquide cérébrospinal et est, chez les poissons, la lamproie, les rongeurs et les macaques, proche de la fibre de Reissner (en vert). C. Les neurones de contact détectent des changements du contenu ou du flux du liquide cérébrospinal via leur interaction avec la fibre de Reissner et modulent, en réponse, la locomotion et la posture (llustrations © Headquarter, Paris, France). |
Récemment, le rôle majeur de neurones ciliés, en contact avec le liquide cérébrospinal (CSF-cN, pour cerebrospinal fluid-contacting neurons) dans le canal central, a été révélé. Ces neurones atypiques agissent comme des mécanorécepteurs ainsi que comme des chémorécepteurs. D’une part, ils détectent en effet la courbure de la colonne vertébrale [9, 10], grâce à leur couplage avec la fibre de Reissner [11]. D’autre part, ils détectent les changements du contenu chimique du liquide cérébrospinal [12-14] et en régulent sa composition via une neurosécrétion active [15-17]. En réponse à ces modifications chimiques, ils libèrent des neurotransmetteurs qui agissent sur les circuits neuronaux locaux [18-20], mais aussi des neuropeptides et des protéines qui peuvent agir sur des cibles situées à longue distance, telles que les muscles squelettiques [21-23].
Les neurones en contact avec le liquide cérébrospinal
Les neurones de contact avec le liquide cérébrospinal s’immiscent entre les cellules épendymaires qui entourent le canal central, à proximité immédiate de la fibre de Reissner [4] ( Figure 1 ). Leur pôle apical a une particularité : il présente une extension formée de nombreuses microvillosités, constituées d’actine et d’un cil composé de microtubules, qui baignent dans le liquide cérébrospinal, au sein du canal central [10]. La structure tridimensionnelle de ces microvillosités diffère selon les espèces. Néanmoins, cette extension apicale se caractérise par une architecture particulière, formée d’un col allongé de nature dendritique, reliant le corps cellulaire au pôle apical du neurone. Ce col est riche en récepteur canal PKD2L1 (polycystic kidney disease 2-like 1) [12, 24], un canal cationique non sélectif, initialement étudié dans les cellules du goût chez la souris [12]. Dans les neurones de contact spinaux, ce récepteur canal est associé à la protéine transmembranaire PKD1L2, qui modulerait son activité [25]. Les neurones de contact expriment également d’autres récepteurs, des récepteurs de neurotransmetteurs, mais aussi de neuromodulateurs ou de peptides qui circulent dans le liquide cérébrospinal [17].
Modulation GABAergique et peptidergique des cibles neuronales et neurosécrétion à longue distance
Chez le macaque, la souris et le poisson zèbre, les neurones de contact spinaux sont de nature inhibitrice [24, 35, 36]. Chez le poisson zèbre comme chez la souris, ils ont une double origine développementale et sont associés à un positionnement, relatif au canal central, soit ventral, soit dorsolatéral [35, 36]. L’examen attentif de l’ultrastructure de ces neurones a révélé la présence de vésicules claires, contenant de l’acide gamma-aminobutyrique (GABA), et de nombreuses autres granules de sécrétion à cœur dense [15, 35, 36]. Les neurones de contact ventraux et dorsolatéraux expriment différents peptides et neuromodulateurs, tels que la somatostatine [17, 33] (pour une revue, voir [36]) ou les peptides de la famille de l’urotensine-II [16, 21, 36]. Chez les mammifères, ils expriment l’enzyme décarboxylase des acides aminés aromatiques (AADC), sans toutefois produire de sérotonine ni de dopamine [37, 38], indiquant la possible production d’amines traces1, du peptide opioïde Met-Enk-Arg-Gly-Leu (méthionine-enképhaline-arginine-glycine-leucine) [39], et du peptide vasointestinal (VIP) [40]. Par ailleurs, la localisation de granules de sécrétion à cœur dense, sous l’extension apicale des neurones de contact, suggère une probable libération par ces neurones, dans le liquide cérébrospinal, de composés qui leur permettent d’agir à grande distance. Chez les larves de poisson zèbre, et plus récemment chez la souris, le marquage de neurones de contact isolés a révélé que leur axone s’étendait rostralement (en direction du rostre, du crâne) et ipsilatéralement (du même côté) dans la moelle épinière ventrale [18, 27, 34], et, pour les cellules les plus rostrales, vers le tronc cérébral [20].
Outre leur rôle dans la régulation des réponses neuronales, les neurones de contact ont également un rôle modulateur de la locomotion. Celui-là repose sur la libération par ces neurones de médiateurs comme le GABA [18] ou la somatostatine [33]. Une cartographie de la connectivité des neurones de contact a pu être établie grâce à l’optogénétique couplée à l’enregistrement des courants postsynaptiques in vivo [18-20, 27, 34]. Il a été ainsi montré que, dans la moelle épinière, ces neurones ciblaient des interneurones excitateurs prémoteurs, des motoneurones, des interneurones sensoriels, les neurones de contact eux-mêmes, ainsi que les axones des neurones réticulospinaux, qui se projettent de la formation réticulée (Formatio reticularis)2 jusqu’à la moelle épinière [18-20, 27, 34]. Les neurones de contact les plus rostraux forment aussi des synapses qui interagissent avec le soma et les dendrites des motoneurones occipitaux, dans la medulla3, au niveau du tronc cérébral [20].
Les neurones de contact détectent les modifications chimiques du liquide cérébrospinal
Réponses à l’acidification et à l’alcalinisation
La capacité des neurones de contact à détecter les variations de pH dans la moelle épinière a été initialement proposée par Huang et al. lorsque ces auteurs ont observé un changement de décharge des potentiels d’action spontanés selon l’acidification du milieu extracellulaire [12]. Depuis, il a été montré que les neurones de contact répondaient à l’acidification et à l’alcalinisation du milieu, par l’ouverture de canaux cationiques distincts : les ASIC (acid-sensitive ion channels) pour l’acidification, et les canaux PKD2L1 pour l’alcalinisation [14]. La localisation des canaux PKD2L1 au niveau de l’extension apicale des neurones de contact, chez le macaque, la souris et les poissons [24], a suggéré que ces neurones pouvaient détecter les variations de pH du liquide cérébrospinal.
Détection des métabolites bactériens lors d’une infection du système nerveux central
En plus des variations de pH, les neurones de contact sont capables de détecter différentes molécules circulant dans le liquide cérébrospinal, comme des métabolites bactériens [17] (Figure 2). Certaines bactéries pathogènes, qui pénètrent dans le système nerveux central, peuvent en effet envahir le liquide cérébrospinal, comme c’est le cas des bactéries responsables d’encéphalite ou de méningite. Dans des expériences mimant ces infections, par l’injection de la bactérie Streptococcus pneumoniae dans les ventricules cérébraux de poisson zèbre, un recrutement massif de neurones de contact a été observé [17]. Ces neurones de contact expriment des récepteurs au goût amer orphelins qui sont capables de détecter les métabolites sécrétés par la bactérie, dont certains sont reconnus par des récepteurs du goût comme des composés amers [17]. In vitro, les neurones de contact s’activent au contact de surnageants de culture de S. pneumoniae. C’est également le cas en réponse à une exposition à des métabolites sécrétés par la bactérie qui déclenchent des variations de calcium importantes dans ces neurones, ce qui rappelle ce qui est observé in vivo [17].
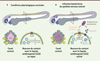 |
Figure 2. Les fonctions chémosensorielles des neurones de contact leur permettent de détecter les métabolites de bactéries pathogéniques lors d’infections du système nerveux central et de déclencher la libération de cytokines et de molécules du complément qui contribuent à augmenter la survie de l’hôte. A. Sans infection du système nerveux, les neurones de contact ne montrent pas d’activité massive et ne libèrent aucun ou peu de peptides. B. Si une bactérie pathogénique pénètre et se reproduit dans le liquide cérébrospinal (LCS), les neurones de contact montrent une activité calcique massive en réponse aux métabolites bactériens, surexpriment et libèrent des peptides et des protéines telles que les molécules du complément et des cytokines qui permettent d’augmenter la survie de l’hôte. |
S. pneumoniae n’est pas le seul agent pathogène à activer les neurones de contact : la bactérie Listeria monocytogenes, mais aussi le virus neurotrope Sindbis, via le surnageant de cellules infectées, peuvent également induire d’importantes variations de concentration de calcium intracellulaire dans les neurones de contact [17]. Le rôle de testeurs des neurones de contact, pour détecter les pathogènes présents dans le liquide cérébrospinal, pourrait donc concerner, outre des bactéries et leurs métabolites, des virus ou d’autres agents pathogènes.
Un rôle des neurones en contact avec le liquide cérébrospinal dans la défense de l’hôte
Pour comprendre les différentes fonctions des neurones de contact, il est nécessaire de connaître le lien qui existe entre leur capacité de sécrétion et leur possible activité. Alors que des variations de calcium intracellulaire rapides sont associées à des potentiels d’action isolés et à la libération de vésicules claires contenant du GABA, la réponse des neurones de contact est différente lors de l’infection du système nerveux central par une bactérie telle que S. pneumoniae. En effet, les neurones de contact présentent, dans ces conditions, des variations du calcium intracellulaire massives et durables [17] qui permettent la libération de granules de sécrétion à cœur dense, typiquement plus éloignées de la membrane cellulaire que les vésicules claires ordinaires, et qui nécessitent, en conséquence, une plus grande élévation de la concentration de calcium intracellulaire pour fusionner avec la membrane. Chez le poisson zèbre, l’élimination des neurones de contact, ou le blocage de leur sécrétion, réduit la survie des larves infectées [17]. Il semble donc que ces neurones participent à l’immunité innée des poissons, en sécrétant des composés dans le liquide cérébrospinal. Les neurones de contact expriment également des cytokines, des composants du complément, et des peptides antimicrobiens, mais aussi des peptides capables de modifier le tonus musculaire ou la posture [17]. Il semble donc possible que cette surexpression de médiateurs de l’inflammation par les neurones de contact participe à l’augmentation de la concentration de ces molécules de l’immunité innée dans le liquide cérébrospinal. Les mécanismes par lesquels les neurones de contact peuvent améliorer la réponse de l’hôte infecté restent néanmoins peu compris, et leur possible participation dans la captation des signaux inflammatoires, présents dans le liquide cérébrospinal, n’a pas encore été étudiée.
Les neurones de contact, couplés à la fibre de Reissner, détectent la courbure spinale pour aligner l’axe du corps
Il y a déjà un siècle, deux anatomistes, Kolmer et Agduhr, avaient proposé que les neurones de contact soient des neurones mécanosensoriels. Chez la lamproie, in vitro, les neurones de contact répondent à des changements de flux du liquide cérébrospinal et les récepteurs canaux ASIC contribuent à la mécanotransduction [9]. Chez la larve de poisson zèbre, in vivo, la déformation mécanique de leur membrane active les neurones de contact en augmentant la probabilité d’ouverture du canal PKD2L1 [26]. Les neurones de contact détectent également une compression lors d’une courbure spinale, et y répondent uniquement du côté concave [10] (Figure 3). Il semble ainsi que ces neurones puissent évaluer la courbure spinale, de manière asymétrique, non en détectant le flux de liquide cérébrospinal, mais par un couplage avec la fibre de Reissner [11]. Chez des poissons mutants pour le gène codant la SCO-spondine, qui constitue la fibre de Reissner [8], la détection de la courbure par les neurones de contact est abolie [11]. Au repos, la fibre de Reissner est sous tension dans le canal central [7]. Lors de la flexion de la moelle épinière d’un côté, la fibre de Reissner, sous tension, peut donc provoquer une asymétrie en se rapprochant du côté de la courbure concave pendant la flexion. Chez les mammifères, l’activité mécanosensorielle des neurones de contact n’a pas encore été identifiée, même si ces neurones ont été décrits pour répondre aux chocs hypo-osmotiques qui gonflent la cellule, et ainsi étirent leur membrane plasmique [13]. Chez la souris, l’ablation des cils, uniquement dans les neurones de contact, suffit à reproduire les perturbations locomotrices que l’on observe après élimination de ces cellules, ce qui suggère que les cils des neurones de contact sont nécessaires à leurs fonctions sensorielles [27].
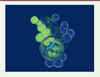 |
Figure 3. Les neurones de contact détectent la courbure spinale du côté de la compression uniquement via un couplage fonctionnel avec la fibre de Reissner. La fibre de Reissner est sous tension dans le canal central. Lorsque la moelle épinière fléchit via une compression à gauche, la fibre de Reissner se rapproche des neurones de contact du côté concave et permet l’activation sélective des neurones de contact du côté gauche (illustrations © Headquarter, Paris, France). |
La fibre de Reissner, les neurones en contact, et l’alignement de l’axe du corps
Lors du développement, un système sensoriel de détection de la courbure de l’axe du corps pourrait contribuer à l’aligner. Les poissons zèbre dont le gène scospondin est muté, et qui sont privés de la fibre de Reissner, se développent avec un axe du corps non plus droit mais courbé [7]. La fibre de Reissner joue donc un rôle critique dans le redressement de l’axe du corps lors de l’embryogenèse. Les peptides de la famille de l’urotensine II, Urp (urotensin-II-related peptide)1 et Urp2, exprimés dans la moelle épinière par les neurones de contact ventraux [16], jouent également un rôle capital dans ce processus [21]. Pendant l’embryogenèse, l’expression de ces peptides est sous le contrôle de la fibre de Reissner. Lorsque la fibre de Reissner ne se forme pas, chez les mutants dépourvus du gène scospondin [7], ces peptides sont en effet moins exprimés et l’axe du corps se courbe alors vers le bas [21, 28]. L’induction de l’expression de ces peptides, dans les neurones de contact, permet de récupérer un axe droit [29]. L’action de ces peptides sur le redressement de l’axe du corps repose sur l’expression dans la musculature dorsale du récepteur UTS2R3 (urotensin 2 receptor 3), et sur un mécanisme actif de contraction de la musculature dorsale [21]. Les larves de poisson zèbre mutantes pour les gènes urp1 et urp2 présentent des défauts de l’axe du corps similaires à ceux observés chez les larves dont le gène uts2r3 est muté [21-23].
Dans les neurones de contact, l’expression des peptides Urp1 et Urp2 est augmentée par la signalisation adrénergique [28, 29]. Leur action sur le tonus musculaire, qui permet de redresser l’axe du corps et d’empêcher que l’embryon ne s’enroule vers le bas, nécessite qu’ils agissent à longue distance, grâce à la circulation du liquide cérébrospinal, en ciblant leur récepteur exprimé dans la musculature squelettique dorsale.
Chez le poisson zèbre, au stade juvénile/adulte, le système sensoriel formé par les neurones de contact, la fibre de Reissner et les peptides de la famille de l’Urotensine-II contribuent à la maintenance de la colonne vertébrale. Les mutants pkd2l1, dans lesquels la fonction mécanosensorielle des neurones de contact est abolie au stade larvaire [10, 26], développent au stade adulte une cyphose avec une courbure ventrale de la colonne vertébrale excessive au niveau rostral [26]. Les mutations qui affectent la fibre de Reissner au stade juvénile, conduisent, quant à elles, à une torsion en trois dimensions de la colonne vertébrale [7, 8, 22, 23], une caractéristique retrouvée dans la scoliose idiopathique chez l’être humain. Les peptides de la famille de l’urotensine-II semblent être à nouveau au centre de la morphogenèse de la colonne vertébrale chez les poissons juvéniles/adultes comme le montrent les déformations observées chez les mutants urp1, urp2 et uts2r3, en aval de la fibre de Reissner qui reste intacte [22, 23]. Le système sensoriel axial, détectant la courbure spinale, informe donc le processus de morphogenèse, en permettant l’alignement de l’axe puis de la colonne vertébrale tout au long de la vie.
Chez l’être humain, la génétique de la scoliose idiopathique reste mal comprise. Il semble que la signalisation reposant sur l’urotensine-II et sur son récepteur UTS2R3 soit altérée chez certains patients [30, 31], suggérant que les peptides de cette famille pourraient contribuer à l’alignement de l’axe du corps chez l’homme. Néanmoins, le gène codant la SCO-spondine, capital pour former la fibre de Reissner, semble avoir disparu chez l’homme et les grands singes4. Déterminer si les neurones de contact, les peptides de la famille de l’urotensine-II et des composants de la protéine SCO-spondine contribuent à la morphogenèse de la colonne vertébrale reste important.
Rôles des neurones de contact dans la locomotion et la posture : un contrôle moteur
Dans la moelle épinière, les neurones de contact sont situés autour du canal central, à proximité des circuits générateurs du rythme locomoteur. L’activation optogénétique des neurones de contact GABAergiques chez la larve de poisson zèbre a un impact sur la locomotion selon l’état (actif ou passif) de l’animal [32, 18]. Les neurones de contact augmentent la vitesse et l’amplitude du mouvement des réponses de fuite acousto-vestibulaires, engageant la locomotion rapide [10, 20].
Les neurones de contact dorsolatéraux, qui sont activés par les flexions latérales et expriment la somatostatine, se projettent sur des interneurones excitateurs dans la moelle épinière [18]. Les larves de poisson zèbre dont le gène codant la somatostatine, SST1.1, a été muté, nagent spontanément plus longtemps [33], ce qui indique que la somatostatine inhibe la locomotion spontanée, possiblement en inhibant des interneurones prémoteurs excitateurs [18].
En revanche, les neurones de contact ventraux, qui sont activés par des flexions longitudinales et qui expriment les peptides de la famille de l’urotensine-II, se projettent sur les motoneurones de la moelle épinière et du tronc cérébral impliqués dans la nage rapide et le contrôle postural [19, 20]. Les neurones de contact contribuent en effet, pendant la locomotion rapide, au contrôle postural actif.
Des travaux récents ont étudié la contribution sensorimotrice des neurones de contact chez la souris [27, 34]. Chez ces animaux, l’ablation des neurones de contact entraîne une réduction des performances des mouvements fins, lorsque l’animal est mis au défi de traverser une échelle horizontale avec des pas importants ou une poutre de petit diamètre [27], ainsi qu’une réduction de la vitesse de la locomotion lors de l’exploration [34], comme cela est observé chez le poisson zèbre [19, 20]. Ces résultats suggèrent une conservation de la fonction des neurones de contact entre le poisson zèbre et la souris, et indiquent qu’à travers les espèces vertébrées, les neurones de contacts forment un système sensoriel spinal qui peut moduler la sortie motrice pour affiner le contrôle moteur et optimiser stabilité et vitesse. Chez le macaque, la présence, en grand nombre, de neurones de contact soulève la question de leur rôle chez les primates non humains [24].
Conclusions
Un grand nombre de travaux récents ont révélé que les neurones en contact avec le liquide cérébrospinal forment, avec la fibre de Reissner, un nouveau système sensoriel de nature intéroceptive. Ce système sensoriel dans la moelle épinière est multimodal, car il répond à des changements mécaniques de la moelle épinière lors de la flexion corporelle et à des changements chimiques du contenu du liquide cérébrospinal. Ce système sensoriel axial est ainsi impliqué dans la mécanosensation et agit à différentes échelles temporelles : à l’échelle de la milliseconde via le GABA, pour optimiser la vitesse de la locomotion ou maintenir l’équilibre, et à l’échelle de jours, de semaines et de mois, pour aligner l’axe du corps et maintenir une courbure de la colonne vertébrale adéquate. Ce système sensoriel axial détecte également les changements du contenu du liquide cérébrospinal, tels que le pH, l’osmolarité ou la concentration de métabolites bactériens qui peuvent s’accumuler dans le contexte d’une infection. Activés, les neurones de contact libèrent du GABA ainsi que des neuropeptides et des protéines. Leurs actions permettent de moduler l’activité des centres générateurs des rythmes locomoteurs dans la moelle épinière mais aussi d’ajuster le contenu du liquide cérébrospinal via la neurosécrétion, au niveau de leur extension apicale. Cette fonction qui vient juste d’être mise en évidence [17], apparaît importante pour les experts de la méningite afin de comprendre les phases tardives d’une infection bactérienne du système nerveux central qui conduisent à l’opisthotonos5, et, grâce aux effets mis en évidence chez le poisson zèbre, pouvoir ainsi espérer augmenter la survie de l’hôte infecté [17, 41].
Une activation maintenue peut induire l’expression par les neurones de contact de peptides de la famille de l’urotensine-II. Ces peptides, qui sont reconnus par un récepteur exprimé par les muscles squelettiques, contrôlent ainsi l’alignement de l’axe du corps et de la colonne vertébrale en particulier. Des études futures permettront de déterminer si les fonctions mécanosensorielles et chémosensorielles des neurones de contact sont conservées chez les mammifères, en particulier chez l’être humain, et si des liens existent, chez les patients, entre l’alignement de l’axe du corps au niveau de la colonne vertébrale et des antécédents d’infections, comme des encéphalites ou méningites. Ce nouveau domaine de recherche a été permis in vivo grâce à la transparence du poisson zèbre et à l’accessibilité de la moelle épinière de lamproie pour sonder les circuits spinaux. Il n’en est aujourd’hui qu’à ses débuts. Une des questions majeures de ce nouveau domaine d’étude est de savoir si les neurones de contact sont présents dans la moelle épinière humaine, et si leurs propriétés de neurones immatures, qui montrent des caractéristiques de cellules souches mises en évidence chez la souris, seraient conservées suite à des lésions traumatiques.
Liens d’intérêt
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Les travaux ont été possibles grâce à toute l'équipe SPINAL SENSORY SIGNALING (https://wyartlab.org) et ont reçu le soutien de l’Institut du Cerveau (ICM) (Fondation ICM et Inserm), de la compagnie Headquarter pour les illustrations, du Conseil européen de la recherche (European Research Council, ERC), de la New York Stem Cell Foundation (NYSCF) Robertson Award, du Human Frontier Science Program (HFSP), des National Institutes of Health (NIH), de la Fondation pour la Recherche Médicale (FRM), de la Fondation Bettencourt-Schueller (FBS), et de la Fondation Schlumberger pour l’éducation et la recherche (FSER).
Références
- Lun MP, Johnson MB, Broadbelt KG, et al. Spatially heterogeneous choroid plexus transcriptomes encode positional identity and contribute to regional CSF production. J Neurosci 2015 ; 35 : 4903–4916. [CrossRef] [PubMed] [Google Scholar]
- Dani N, Herbst RH, McCabe C, et al. A Cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell 2021; 184 : 3056–74.e21. [CrossRef] [PubMed] [Google Scholar]
- Orts-Del’Immagine A, Wyart C. Cerebrospinal-fluid-contacting neurons. Curr Biol 2017; 27 : R1198–200. [CrossRef] [PubMed] [Google Scholar]
- Reissner E.. Beiträge zur Kenntnis vom Bau des Rückenmarkes von Petromyzon fluviatilis L. Arch Anat Physiol Wiss Med 1860 ; 545–588. [Google Scholar]
- Muñoz RI, Kähne T, Herrera H, et al. The subcommissural organ and the Reissner fiber : old friends revisited. Cell Tissue Res 2019 ; 375 : 507–529. [CrossRef] [PubMed] [Google Scholar]
- Cantaut-Belarif Y, Sternberg JR, Thouvenin O, et al. The Reissner fiber in the cerebrospinal fluid controls morphogenesis of the body axis. Curr Biol 2018 ; 28 : 2479–86.e2474. [CrossRef] [PubMed] [Google Scholar]
- Troutwine BR, Gontarz P, Konjikusic MJ, et al. The Reissner fiber is highly dynamic in vivo and controls morphogenesis of the spine. Curr Biol 2020; 30 : 2353–62.e2353. [CrossRef] [PubMed] [Google Scholar]
- Rose CD, Pompili D, Henke K, et al. SCO-Spondin defects and neuroinflammation are conserved mechanisms driving spinal deformity across genetic models of idiopathic scoliosis. Curr Biol 2020; 30 : 2363–73.e2366. [CrossRef] [PubMed] [Google Scholar]
- Jalalvand E, Robertson B, Wallén P, Grillner S. Ciliated neurons lining the central canal sense both fluid movement and pH through ASIC3. Nat Commun 2016 ; 7 : 10002. [CrossRef] [PubMed] [Google Scholar]
- Böhm UL, Prendergast AE, Djenoune L, et al. CSF-contacting neurons regulate locomotion by relaying mechanical stimuli to spinal circuits. Nature Comm 2016 ; 7 : 10866. [CrossRef] [Google Scholar]
- Orts-Del’Immagine A, Cantaut-Belarif Y, Thouvenin O, et al. Sensory neurons contacting the cerebrospinal fluid require the Reissner fiber to detect spinal curvature in vivo. Curr Biology 2020; 30 : 827–39.e4. [CrossRef] [Google Scholar]
- Huang AL, Chen X, Hoon MA, et al. The cells and logic for mammalian sour taste detection. Nature 2006 ; 442 : 934–938. [CrossRef] [PubMed] [Google Scholar]
- Orts-Del’Immagine A, Wanaverbecq N, Tardivel C, et al. Properties of subependymal cerebrospinal fluid contacting neurones in the dorsal vagal complex of the mouse brainstem. J Physiol 2012; 590 : 3719–41. [CrossRef] [PubMed] [Google Scholar]
- Jalalvand E, Robertson B, Tostivint H, et al. The spinal cord has an intrinsic system for the control of pH. Curr Biology 2016 ; 26 : 1346–1351. [CrossRef] [Google Scholar]
- Vigh-Teichmann O, Vigh B. The system of cerebrospinal fluid-contacting neurons. Archivum Histologicum Japonicum 1983 ; 46 : 427–468. [CrossRef] [PubMed] [Google Scholar]
- Quan FB, Dubessy C, Galant S, et al. Comparative distribution and in vitro activities of the Urotensin II-related peptides URP1 and URP2 in Zebrafish: Evidence for their colocalization in spinal cerebrospinal fluid-contacting neurons. Plos One 2015 ; 10 : e0119290. [CrossRef] [PubMed] [Google Scholar]
- Prendergast AE, Jim KK, Marnas H, et al. CSF-contacting neurons respond to Streptococcus Pneumoniae and promote host survival during central nervous system infection. Curr Biology 2023; 33 : 940–56.e10. [CrossRef] [Google Scholar]
- Fidelin K, Djenoune L, Stokes C, et al. State-dependent modulation of locomotion by GABAergic spinal sensory neurons. Curr Biology 2015 ; 25 : 3035–3047. [CrossRef] [Google Scholar]
- Hubbard JM, Böhm UL, Prendergast AE, et al. Intraspinal sensory neurons provide powerful inhibition to motor circuits ensuring postural control during locomotion. Curr Biology 2016 ; 26 : 2841–2853. [CrossRef] [Google Scholar]
- Wu MY, Carbo-Tano M, Mirat O, et al. Spinal sensory neurons project onto the hindbrain to stabilize posture and enhance locomotor speed. Curr Biology 2021; 31 : 3315–29.e5. [CrossRef] [Google Scholar]
- Zhang X, Jia S, Chen Z, et al. Cilia-driven cerebrospinal fluid flow directs expression of urotensin neuropeptides to straighten the vertebrate body axis. Nat Genet 2018 ; 50 : 1666–1673. [CrossRef] [PubMed] [Google Scholar]
- Gaillard AL, Mohamad T, Quan FB, et al. Urp1 and Urp2 act redundantly to maintain spine shape in zebrafish larvae. Dev Biology 2023; S0012–1606(23)00018–0. [Google Scholar]
- Bearce EA, Irons ZH, O’Hara-Smith JR, et al. Urotensin II-related peptides, Urp1 and Urp2, control Zebrafish spine morphology. eLife 2022; 11 : e83883. [CrossRef] [PubMed] [Google Scholar]
- Djenoune L, Khabou H, Joubert F, et al. Investigation of spinal cerebrospinal fluid-contacting neurons expressing PKD2L1: Evidence for a conserved system from fish to primates. Front Neuroanatomy 2014 ; 8 : 26. [CrossRef] [Google Scholar]
- Bushman JD, Ye W, Liman ER. A proton current associated with sour taste : distribution and functional properties. FASEB 2015 ; 29 : 3014–3026. [CrossRef] [PubMed] [Google Scholar]
- Sternberg JR, Prendergast AE, Brosse L, et al. Pkd2l1 is required for mechanoception in cerebrospinal fluid-contacting neurons and maintenance of spine curvature. Nat Commun 2018 ; 9 : 3804. [CrossRef] [PubMed] [Google Scholar]
- Gerstmann K, Jurcˇic΄ N, Blasco E, et al. The role of intraspinal sensory neurons in the control of quadrupedal locomotion. Curr Biology 2022; 32 : 2442–53.e4. [CrossRef] [Google Scholar]
- Cantaut-Belarif Y, Orts Del’Immagine A, Penru M, et al. Adrenergic activation modulates the signal from the Reissner fiber to cerebrospinal fluid-contacting neurons during development. eLife 2020; 9 : e59469. [CrossRef] [PubMed] [Google Scholar]
- Lu H, Shagirova A, Goggi JL, et al. Reissner fibre-induced urotensin signalling from cerebrospinal fluid-contacting neurons prevents scoliosis of the vertebrate spine. Biol Open 2020; 9 : bio052027. [CrossRef] [PubMed] [Google Scholar]
- Dai Z, Wang Y, Wu Z, et al. Novel Mutations in UTS2R are associated with adolescent idiopathic scoliosis in the chinese population. Spine 2021; 46 : E288–93. [CrossRef] [PubMed] [Google Scholar]
- Xie H, Kang Y, Liu J, et al. Ependymal polarity defects coupled with disorganized ciliary beating drive abnormal cerebrospinal fluid flow and spine curvature in zebrafish. Plos Biol 2023; 21 : e3002008. [CrossRef] [PubMed] [Google Scholar]
- Wyart C, Del Bene F, Warp E, et al. Optogenetic dissection of a behavioural module in the vertebrate spinal cord. Nature 2009 ; 461 : 407–410. [CrossRef] [PubMed] [Google Scholar]
- Quan FB, Desban L, Mirat O, et al. Somatostatin 1.1 contributes to the innate exploration of Zebrafish larva. Sci Rep 2020; 10 : 15235. [CrossRef] [PubMed] [Google Scholar]
- Nakamura Y, Kurabe M, Matsumoto M, et al. Cerebrospinal fluid-contacting neuron tracing reveals structural and functional connectivity for locomotion in the mouse spinal cord. eLife 2023 : 12 : e83108. [CrossRef] [PubMed] [Google Scholar]
- Djenoune L, Desban L, Gomez J, et al. The dual developmental origin of spinal cerebrospinal fluid-contacting neurons gives rise to distinct functional subtypes. Sci Rep 2017 ; 7 : 719. [CrossRef] [PubMed] [Google Scholar]
- Djenoune L, Wyart C. Light on a sensory interface linking the cerebrospinal fluid to motor circuits in vertebrates. J Neurogenet 2017 ; 31 : 113–127. [CrossRef] [PubMed] [Google Scholar]
- Jaeger CB, Teitelman G, Joh TH, et al. Some neurons of the rat central nervous system contain aromatic-L-amino-acid decarboxylase but not monoamines. Science 1983 ; 219 : 1233–1235. [CrossRef] [PubMed] [Google Scholar]
- Nagatsu I, Sakai M, Yoshida M, Nagatsu T. Aromatic L-amino acid decarboxylase-immunoreactive neurons in and around the cerebrospinal fluid-contacting neurons of the central canal do not contain dopamine or serotonin in the mouse and rat spinal cord. Brain Research 1988 ; 475 : 91–102. [CrossRef] [PubMed] [Google Scholar]
- Shimosegawa T, Koizumi M, Toyota T, et al. An immunohistochemical study of Methionine-Enkephalin-Arg6-Gly7-Leu8-like immunoreactivity-containing liquor-contacting neurons (LCNs) in the rat spinal cord. Brain Research 1986 ; 379 : 1–9. [CrossRef] [PubMed] [Google Scholar]
- Lamotte CC. Vasoactive intestinal polypeptide cerebrospinal fluid-contacting neurons of the monkey and cat spinal central canal. J Comp Neurol 1987; 258 : 527–41. [Google Scholar]
- MacCain W, Tuomanen E. Taste versus pain: A sensory feast in bacterial meningitis. Cell Host Microbe 2023; 31 : 681–2. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Les neurones de contact avec le liquide cérébrospinal tapissent les parois du canal central où ils sont très proches de la fibre de Reissner. A. Le canal central (CC) permet la circulation du liquide cérébrospinal (LCS) au sein de la moelle épinière, confinée dans la colonne vertébrale. Alors que l’emphase du contrôle sensoriel rétroactif a focalisé sur les circuits périphériques impliquant les neurones de la racine dorsale, les neurones de contact (en jaune) sont des cellules sensorielles localisées dans la moelle épinière elle-même, qui appartiennent au système nerveux central. B. Les neurones de contact dans la moelle épinière (en jaune) se logent entre les cellules épendymaires et se caractérisent par une extension apicale qui baigne dans le liquide cérébrospinal et est, chez les poissons, la lamproie, les rongeurs et les macaques, proche de la fibre de Reissner (en vert). C. Les neurones de contact détectent des changements du contenu ou du flux du liquide cérébrospinal via leur interaction avec la fibre de Reissner et modulent, en réponse, la locomotion et la posture (llustrations © Headquarter, Paris, France). |
| Dans le texte | |
 |
Figure 2. Les fonctions chémosensorielles des neurones de contact leur permettent de détecter les métabolites de bactéries pathogéniques lors d’infections du système nerveux central et de déclencher la libération de cytokines et de molécules du complément qui contribuent à augmenter la survie de l’hôte. A. Sans infection du système nerveux, les neurones de contact ne montrent pas d’activité massive et ne libèrent aucun ou peu de peptides. B. Si une bactérie pathogénique pénètre et se reproduit dans le liquide cérébrospinal (LCS), les neurones de contact montrent une activité calcique massive en réponse aux métabolites bactériens, surexpriment et libèrent des peptides et des protéines telles que les molécules du complément et des cytokines qui permettent d’augmenter la survie de l’hôte. |
| Dans le texte | |
 |
Figure 3. Les neurones de contact détectent la courbure spinale du côté de la compression uniquement via un couplage fonctionnel avec la fibre de Reissner. La fibre de Reissner est sous tension dans le canal central. Lorsque la moelle épinière fléchit via une compression à gauche, la fibre de Reissner se rapproche des neurones de contact du côté concave et permet l’activation sélective des neurones de contact du côté gauche (illustrations © Headquarter, Paris, France). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




