| Issue |
Med Sci (Paris)
Volume 39, Number 6-7, Juin-Juillet 2023
|
|
|---|---|---|
| Page(s) | 490 - 492 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2023068 | |
| Published online | 30 June 2023 | |
Retracer l’origine des réponses immunitaires indépendantes des lymphocytes T chez l’homme
Tracing the origin of T lymphocyte-independent responses
Université Paris Cité, Inserm U1151, CNRS UMR8253, Institut Necker Enfants-Malades, Paris, France
* sandra.weller@inserm.fr
** Jean-claude.weill@inserm.fr
*** claude-agnes.reynaud@inserm.fr
Les lymphocytes B jouent un rôle clé dans l’immunité adaptative par leur capacité à se différencier en plasmocytes, qui vont sécréter des anticorps de classe IgM, IgA et IgG en réponse à des antigènes exprimés par des microorganismes pathogènes tels que les bactéries et les virus. Selon la nature de l’antigène, les lymphocytes B peuvent bénéficier de l’aide des lymphocytes T, et l’on distingue ainsi les réponses T-dépendantes (TD), qui sont dirigées contre des antigènes protéiques, et les réponses T-indépendantes (TI) ciblant des structures répétées telles que les polysaccharides (ou glycanes) constituant la capsule de certaines bactéries, comme Streptococcus pneumoniae (pneumocoque) [1]. Les réponses TD sont caractérisées par la formation de centres germinatifs dans les organes et tissus lymphoïdes, en particulier ceux associés à l’intestin (GALT, gut-associated lymphoid tissues), et par la production de lymphocytes B mémoires. C’est au sein de ces centres germinatifs que le mécanisme d’hypermutation somatique ciblant les gènes des anticorps est activé. Il permet aux lymphocytes B de produire des anticorps mutés qui, grâce à un processus de sélection, ont une plus forte affinité pour l’antigène qu’ils reconnaissent [2]. Les réponses TI, en revanche, n’induisent pas la formation de centres germinatifs et de lymphocytes B mémoires. Paradoxalement, et contrairement à ce que l’on observe chez la souris, les anticorps produits contre des antigènes polysaccharidiques (comme ceux contenus par exemple dans le vaccin Pneumovax®) sont mutés chez l’homme [3]. On distingue différentes sous-populations de lymphocytes B [4], en particulier ceux de la zone marginale splénique (MZ-B), pour lesquels un rôle dans les réponses TI a été proposé chez l’homme, mais pas encore prouvé [5–7].
Pour retracer l’origine des réponses TI, nous avons tiré parti de la vaccination de six individus sains par Pneumovax®, un vaccin composé de polysaccharides des capsules de 23 sérotypes de pneumocoque. À partir des prélèvements sanguins réalisés à différents temps avant et après vaccination (Figure 1), nous avons isolé plusieurs sous-populations de lymphocytes B, ainsi que les plasmocytes au septième jour, pic de la réponse vaccinale. Notre but était d’identifier la ou les sous-populations de lymphocytes B responsables de la production des anticorps de classe IgM, IgA et IgG anti-polysaccharides de capsule bactérienne, en réponse à la vaccination. Dans la mesure où chaque lymphocyte B (et plasmocyte) porte une signature moléculaire « VDJ » unique, il est possible de tracer sa filiation et d’identifier des clones1 de lymphocytes B. Notre étude s’est appuyée à la fois sur le séquençage à haut débit du répertoire des anticorps exprimés à la surface des lymphocytes B, et sur la production in vitro d’anticorps monoclonaux exprimés par les plasmocytes au septième jour, deux méthodes nous permettant non seulement d’identifier la signature VDJ de plasmocytes anti-polysaccharides du pneumocoque et d’établir leur filiation avec les différentes sous-populations de lymphocytes B présentes avant la vaccination, mais aussi de suivre l’évolution, au cours du temps, de clones de lymphocytes B impliqués dans la réponse vaccinale.
 |
Figure 1. Stratégie expérimentale. |
Dans le sang des individus vaccinés, nous avons constaté que le pool des plasmocytes présents au septième jour de la réponse vaccinale contient des clones ayant subi de très grandes expansions. En focalisant notre analyse sur les 100 plus grands clones de plasmocytes (le « top 100 »), nous avons constaté que la plupart incluent des cellules produisant des IgM (IgM+), des cellules produisant des IgG (IgG+) et des cellules produisant des IgA (IgA+), avec une composante de cellules IgM+ qui est généralement dominante, les anticorps de ces trois isotypes étant fortement mutés. Dans ces clones de plasmocytes, nous avons pu mettre en évidence des traces de commutation isotypique récente (majoritairement d’un isotype IgM vers un isotype IgA), survenant probablement de façon concomitante avec la différenciation plasmocytaire des lymphocytes B récemment activés et spécifiques des polysaccharides du Pneumovax®. Nous avons également montré, comme attendu, que des anticorps monoclonaux, représentatifs de clones plasmocytaires du top 100, reconnaissent de façon spécifique des polysaccharides du Pneumovax®, et que ces réactivités sont dépendantes de leurs mutations somatiques. En utilisant leur signature VDJ, nous avons pu montrer que les clones plasmocytaires du top 100 sont majoritairement en filiation avec des clones de lymphocytes B préexistant dans le sang avant la vaccination et composés de cellules MZ-B IgM+, mais aussi de cellules IgA+ et plus rarement IgG+, qui toutes expriment des anticorps mutés (environ 21 mutations dans la région variable des chaînes lourdes d’anticorps). À l’inverse de ce qui est observé dans les réponses TD, les taux de mutations somatiques des anticorps exprimés par ces clones de cellules B n’augmentent pas de façon significative entre le jour 0 et le jour 56 après la vaccination. Lorsqu’on les suit au cours du temps, les clones de lymphocytes B parents des plasmocytes du top 100 au jour 7 restent globalement stables deux mois après la vaccination par Pneumovax®, ce qui suggère que la très forte expansion des plasmocytes observée au jour 7 de la réponse vaccinale ne produit pas une déplétion notable des clones lymphocytaires B dont ils sont issus.
Il a été récemment rapporté que les précurseurs des lymphocytes MZ-B se différencient et mutent leurs anticorps dans les centres germinatifs des GALT chez l’homme [8, 9]. Nous avons cherché à savoir si les anticorps monoclonaux anti-polysaccharides de pneumocoque que nous avons obtenus pouvaient également réagir de manière croisée avec des antigènes bactériens de la flore intestinale. De fait, nous avons mis en évidence l’existence de réactions croisées contre des souches bactériennes intestinales appartenant à des genres différents, avec des rôles contrastés des mutations somatiques : lorsque ces anticorps monoclonaux sont exprimés sous leur forme native dite « germinale » (c’est-à-dire celle présente avant l’acquisition de mutations somatiques), leur réactivité contre les polysaccharides est perdue, tandis que l’impact sur leur reconnaissance de bactéries de la flore intestinale est beaucoup plus hétérogène, la liaison étant renforcée, diminuée ou maintenue lors de la réversion germinale. Enfin, la majorité des anticorps monoclonaux testés contre un groupe de quatre antigènes (de structures biochimiques diverses) ne présentent pas de polyréactivité, ce qui suggère fortement que la liaison des anticorps monoclonaux anti-polysaccharides aux échantillons bactériens de la flore intestinale cible spécifiquement des glycanes. Étonnamment, non seulement la vaccination par Pneumovax® induit une réponse IgG2 majoritairement TI, mais cette signature TI est déjà présente avant l’immunisation, ce qui suggère que le processus d’hypermutation pré-diversifiant les lymphocytes MZ-B se fait de façon « non canonique », c’est-à-dire sans impliquer la collaboration classique entre lymphocytes T et B [10]. En nous fondant sur ces résultats et sur des données de la littérature, nous proposons le scénario suivant : les lymphocytes MZ-B pré-diversifient leurs anticorps dans les GALT, au cours d’un processus orchestré par les bactéries de la flore intestinale commensale et ciblant des glycanes qu’elles expriment à leur surface (Figure 2). Cela permet d’élaborer un compartiment de cellules B dans le sang, incluant à la fois des cellules MZ-B IgM+ et des cellules IgA+ et IgG2+ clonalement reliées, et ayant la capacité de pouvoir produire en un temps très court des anticorps mutés contre des bactéries encapsulées fortement pathogènes (méningocoque, Haemophilus influenzae, pneumocoque, etc.).
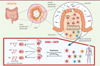 |
Figure 2. Résumé graphique. Les tissus lymphoïdes associés à l’intestin (gut-associated lymphoid tissues, GALT) comportent des follicules B, riches en lymphocytes B. Les cellules « M » sont des cellules épithéliales spécialisées, associées à ces follicules, capables d’échantillonner les antigènes bactériens présents dans l’intestin. Les résultats de l’étude suggèrent qu’une cellule MZ-B qui reconnaît des antigènes bactériens polysaccharidiques (grâce à ses anticorps de surface) peut être activée, et peut déclencher le mécanisme d’hypermutation somatique ciblant les gènes codant ses anticorps et se mettre à proliférer, en donnant ainsi naissance à un clone de lymphocytes B. Au cours de cette activation, certaines des cellules filles vont subir la commutation isotypique leur permettant de passer de l’expression d’un anticorps de surface de type IgM à un anticorps de type IgG ou IgA. Les lymphocytes B des GALT peuvent recirculer dans le sang et la rate. Lors de la vaccination par Pneumovax® (et par extension, lors de la rencontre avec une bactérie encapsulée comme le pneumocoque), les lymphocytes B pré-activés et pré-mutés dans les GALT, et dont les anticorps réagissent de manière croisée avec les polysaccharides du Pneumovax® sont activés et vont se différencier en plasmocytes produisant des anticorps mutés (figure réalisée avec le logiciel BioRender). |
De nombreux agents infectieux pathogènes tels que le virus de l’immunodéficience humaine (VIH) sont recouverts de glycanes, qui sont souvent les principaux déterminants antigéniques reconnus par les anticorps neutralisants spécifiques. Il est tentant de spéculer qu’un vaccin contenant uniquement ces glycanes pourrait déclencher une réponse rapide et efficace des lymphocytes MZ-B chez l’homme. Enfin, dans une perspective évolutive, ces résultats impliquent que l’espèce humaine a conservé, pour un sous-ensemble de lymphocytes B, la stratégie utilisée par d’autres espèces (e.g. poulet, mouton, lapin) pour diversifier leur répertoire pré-immun dans les GALT.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Vos Q, Lees A, Wu ZQ et al. B-cell activation by T-cell-independent type 2 antigens as an integral part of the humoral immune response to pathogenic microorganisms. Immunol Rev 2000 ; 176 : 154–170. [CrossRef] [PubMed] [Google Scholar]
- Young C, Brink R. The unique biology of germinal center B cells. Immunity 2021; 54 : 1652–64. [CrossRef] [PubMed] [Google Scholar]
- Lucas AH, Moulton KD, Tang VR, et al. Combinatorial library cloning of human antibodies to Streptococcus pneumoniae capsular polysaccharides : variable region primary structures and evidence for somatic mutation of Fab fragments specific for capsular serotypes 6B, 14, and 23F. Infect Immun 2001 ; 69 : 853–864. [CrossRef] [PubMed] [Google Scholar]
- Sanz I, Wei C, Jenks SA, et al. Challenges and opportunities for consistent classification of human B cell and plasma cell populations. Front Immunol 2019 ; 10 : 2458. [CrossRef] [PubMed] [Google Scholar]
- Kruetzmann S, Rosado MM, Weber H, et al. Human immunoglobulin M. memory B cells controlling Streptococcus pneumoniae infections are generated in the spleen. J Exp Med 2003 ; 197 : 939–945. [Google Scholar]
- Khaskhely N, Mosakowski J, Thompson RS, et al. Phenotypic analysis of pneumococcal polysaccharide-specific B cells. J Immunol 2012 ; 188 : 2455–2463. [CrossRef] [PubMed] [Google Scholar]
- Moens L, Wuyts M, Meyts I, et al. Human memory B lymphocyte subsets fulfill distinct roles in the anti-polysaccharide and anti-protein immune response. J Immunol 2008 ; 181 : 5306. [CrossRef] [PubMed] [Google Scholar]
- Zhao Y, Uduman M, Siu JHY, et al. Spatiotemporal segregation of human marginal zone and memory B cell populations in lymphoid tissue. Nat Commun 2018 ; 9 : 3857. [CrossRef] [PubMed] [Google Scholar]
- Tull TJ, Pitcher MJ, Guesdon W, et al. Human marginal zone B cell development from early T2 progenitors. J Exp Med 2021; 218 : e20202001. [Google Scholar]
- Biram A, Shulman Z. T cell help to B cells : Cognate and atypical interactions in peripheral and intestinal lymphoid tissues. Immunol Rev 2020; 296 : 36–47. [CrossRef] [PubMed] [Google Scholar]
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Stratégie expérimentale. |
| Dans le texte | |
 |
Figure 2. Résumé graphique. Les tissus lymphoïdes associés à l’intestin (gut-associated lymphoid tissues, GALT) comportent des follicules B, riches en lymphocytes B. Les cellules « M » sont des cellules épithéliales spécialisées, associées à ces follicules, capables d’échantillonner les antigènes bactériens présents dans l’intestin. Les résultats de l’étude suggèrent qu’une cellule MZ-B qui reconnaît des antigènes bactériens polysaccharidiques (grâce à ses anticorps de surface) peut être activée, et peut déclencher le mécanisme d’hypermutation somatique ciblant les gènes codant ses anticorps et se mettre à proliférer, en donnant ainsi naissance à un clone de lymphocytes B. Au cours de cette activation, certaines des cellules filles vont subir la commutation isotypique leur permettant de passer de l’expression d’un anticorps de surface de type IgM à un anticorps de type IgG ou IgA. Les lymphocytes B des GALT peuvent recirculer dans le sang et la rate. Lors de la vaccination par Pneumovax® (et par extension, lors de la rencontre avec une bactérie encapsulée comme le pneumocoque), les lymphocytes B pré-activés et pré-mutés dans les GALT, et dont les anticorps réagissent de manière croisée avec les polysaccharides du Pneumovax® sont activés et vont se différencier en plasmocytes produisant des anticorps mutés (figure réalisée avec le logiciel BioRender). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




