| Issue |
Med Sci (Paris)
Volume 39, Number 5, Mai 2023
|
|
|---|---|---|
| Page(s) | 423 - 428 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023057 | |
| Published online | 23 May 2023 | |
La prévention du cancer du col utérin
The prevention of cervical cancer
1
Cerba Path, Paris, France
2
Institut Pasteur, Paris, France
Le dépistage du cancer du col de l’utérus concerne les femmes âgées de 25 à 65 ans. Il consiste à recueillir des cellules en frottant le col utérin avec une spatule. Le matériel biologique prélevé est ensuite déposé directement sur lame ou après l’avoir dilué dans un conservateur et cytocentrifugé (cytologie en milieu liquide). Il est ensuite analysé au microscope. En juillet 2019, la Haute autorité de santé a recommandé de rechercher l’ADN des types de papillomavirus humains (human papillomavirus, HPV) à haut risque ou potentiellement oncogènes, par PCR (test HPV HR), comme première étape du dépistage après l’âge de 30 ans. Ce test est plus sensible que la cytologie pour diagnostiquer une lésion histologique malpighienne intraépithéliale de haut grade, et plus efficace pour prévenir les cancers invasifs. Lorsque ce test est positif, une analyse cytologique sur le même prélèvement est réalisée afin de sélectionner les patientes nécessitant une colposcopie. Le deuxième volet de la prévention du cancer du col utérin repose sur la vaccination. Nous discutons, dans cette revue, l’importance de la détection des lésions du col utérin et le rôle des HPV.
Abstract
Cervical cancer screening concerns women between the ages of 25 and 65. It consists of the collection of cervical cells with a spatula by rubbing the cervix. The material was initially spread out and fixed on a glass slide. It was subsequently fixed in a liquid preservative with an automated spread on a thin-layer slide after centrifugation or filtration, a process called liquid cytology. Microscopic reading was facilitated by field selection using an automated pre-reading system. In July 2019, the French High Authority for Health (HAS) recommended to position DNA research of high-risk human papillomavirus types by PCR (HPV HR test) in first position after the age of 30. This approach is more sensitive than cytology in diagnosing a histological high-grade squamous intraepithelial lesion, and more effective in preventing invasive cancers. The HPV HR test, if positive, is followed by a cytological examination on the same sample to select patients requiring examination of the cervix by colposcopy. Vaccination against the nine most common types of HPV in girls and boys aged 11 to 14 years is the other part of the prevention of invasive cancer.
© 2023 médecine/sciences – Inserm
Vignette (© Christine Bergeron).
Papillomavirus humains et cancer du col utérin
Le cancer du col utérin correspond à un carcinome épidermoïde (malpighien)1 dans 90 % des cas, et à un adénocarcinome dans 10 % des cas. Ces cancers, d’évolution lente, sont précédés par des lésions précancéreuses appelées respectivement lésions malpighiennes intraépithéliales de haut grade et adénocarcinome in situ. La lente évolution de ces lésions précancéreuses permet de les dépister avant que le cancer ne devienne invasif. Leur traitement entraîne une guérison sans risque de métastases.
Le rôle causal des papillomavirus humains (human papillomavirus, HPV), des petits virus à ADN appartenant à la famille des Papillomaviridae, dans la survenue et la progression des lésions précancéreuses et des cancers invasifs du col utérin est bien établi [1]. Plus de 200 génotypes de ces virus présents dans la sphère anogénitale, la peau et les voies respiratoires ont été identifiés. Une quinzaine d’entre eux (les HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) sont mis en évidence dans les lésions intraépithéliales de haut grade du col utérin, et sont considérés comme potentiellement oncogènes ou à haut risque (HR). HPV16 est le plus fréquent : il est mis en évidence dans 50 à 60 % des cancers invasifs du col utérin. Une patiente infectée par HPV16 a un risque relatif de développer une lésion de haut grade de 30 à 50 fois plus grand qu’une femme chez laquelle on n’a pas détecté d’infection par un HPV. Le risque est aussi associé à la persistance d’une infection par un HPV HR, quel qu’en soit le type.
Les HPV sont très répandus dans la population humaine et on estime que 10 à 15 % des femmes sont infectées de manière latente. C’est une infection sexuellement transmissible. Si on recherche ces virus de manière cumulative par la technique de PCR (polymerase chain reaction), on peut détecter une infection chez environ 50 % des femmes, en particulier pendant la grossesse. Seule une très petite proportion des femmes infectées par ces virus développent une lésion de haut grade. On connaît mal les mécanismes qui contrôlent l’expression du potentiel oncogène des HPV, c’est-à-dire le passage d’une infection latente vers une lésion de haut grade. Ces mécanismes concernent probablement la régulation intracellulaire de l’expression du génome viral par des protéines cellulaires, et la réaction immunitaire dirigée contre les protéines virales. Des cofacteurs interviennent également pour favoriser le développement d’une lésion après une infection par un HPV HR : des facteurs génétiques, une immunosuppression iatrogène ou acquise (infection par le virus de l’immunodéficience humaine, VIH), la consommation de tabac.
L’infection de l’épithélium malpighien du col utérin par un HPV HR est le plus souvent latente, et ne produit pas de modifications morphologiques identifiables. En revanche, l’infection de cet épithélium par un HPV s’accompagne de l’expression spécifique de différents gènes viraux, qui est contrôlée par la différenciation de l’épithélium. L’infection latente met en jeu l’expression des gènes précoces codant les protéines virales E1 et E2. L’infection productive correspond à la réplication de l’ADN viral, qui nécessite l’expression des gènes précoces codant E1, E2, E5 dans les cellules intermédiaires et superficielles de l’épithélium, puis celle des gènes tardifs codant les protéines L1 et L2 de la particule virale, dans les couches superficielles de l’épithélium, permettant la construction des virions. Cette infection productive est fréquente chez les femmes jeunes, et régresse le plus souvent spontanément en douze mois. L’infection « transformante » est caractérisée par l’expression des gènes codant E6 et E7 dans les couches basales de l’épithélium. Ces deux protéines virales interagissent avec différentes protéines cellulaires (TP53 [tumor protein 53], pRB [retinoblastoma-protein], etc.) dont l’inactivation induit une instabilité de l’ADN. L’infection « transformante » peut se produire après ou de manière concomitante à une infection productive.
La protéine cytoplasmique et nucléaire p16 (ou protéine inhibitrice de kinase cycline-dépendante 2A) est un biomarqueur cellulaire qui témoigne de l’expression du gène viral E7 au cours d’une infection par un HPV HR. La détection de cette protéine par immunocytochimie sur des frottis prélevés en milieu liquide permet de rechercher sa présence dans des cellules malpighiennes basales anormales, mais aussi dans quelques cellules atrophiques ou dans des cellules cylindriques normales. La détection de p16, associée à celle de la protéine nucléaire Ki67, par double marquage immunocytochimique permet d’augmenter la spécificité de cette approche diagnostique ( Figure 1 ).
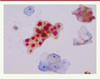 |
Figure 1. Double immunomarquage des protéines p16 (en marron) et Ki67 (en rouge) dans des cellules malpighiennes basales du col utérin. Les noyaux cellulaires sont colorés par hématoxyline. |
Le cancer du col utérin en 2023
Le cancer du col utérin est responsable de 3 000 nouveaux cas et de 1 000 décès par an [2]. Ces chiffres sont relativement stables depuis de nombreuses années. L’âge moyen du diagnostic de cancer invasif est de 51 ans, et celui du décès est de 64 ans. Cependant, le taux de survie à 5 ans a régressé entre 1990 et 2010, de 66 % à 62 % ; c’est cette donnée qui a entraîné un nouvel élan des agences gouvernementales pour organiser le dépistage du cancer du col utérin à l’échelle nationale.
En effet, ce cancer est évitable si la couverture du dépistage dans la population cible et la couverture de la vaccination prophylactique sont supérieures à 80 %. En France, 70 % des cancers du col utérin surviennent chez des femmes qui n’ont pas eu de test de dépistage ou qui ont eu des tests trop espacés, 20 % surviennent chez des femmes dont la prise en charge d’un test anormal est inadéquate, et 10 % chez des femmes dont le test est négatif, le prélèvement ne contenant pas de cellules anormales ou des cellules anormales qui n’ont pas été diagnostiquées comme telles.
Organisation du dépistage et rôle des centres régionaux de dépistage des cancers
L’amélioration de la couverture ne peut se faire que par l’organisation du dépistage, publiée au Journal officiel en 2018 [3]. La couverture du dépistage est de 60 % en moyenne, et ne s’améliore pas, malgré l’engagement des gynécologues qui, depuis trente ans, font la très grande majorité (90 %) des prélèvements cervico-utérins. Il existe une grande disparité de cette couverture entre les régions, avec des variations de 50 à 80 % dues à des inégalités de répartition des professionnels ou à l’existence d’un dépistage organisé pilote mis en place localement depuis vingt ans. La couverture est meilleure chez les femmes âgées de 25 à 45 ans, une période au cours de laquelle elles consultent un gynécologue non seulement pour un dépistage du cancer du col utérin, mais aussi pour le suivi d’une contraception, d’une grossesse, ou pour des symptômes d’une endométriose ou d’un léiomyome2. Les femmes âgées de plus de 50 ans, en situation sociale défavorable ou avec des problèmes de santé, se font moins dépister, et seule une incitation par un centre régional de dépistage peut ramener une partie de ces femmes vers un dépistage régulier du cancer du col.
Le test est toujours réalisé par les professionnels en contact direct avec les femmes. Les Centres régionaux de coordination de dépistage sont responsables de l’identification des femmes qui ne participent pas ou peu au dépistage, ou qui n’ont pas eu de suivi d’un résultat de test anormal. Ces centres collectent également les résultats des tests effectués. L’Institut national du cancer (Inca) est à l’origine du cahier des charges du programme de dépistage, et Santé publique France (SPF) analyse les indicateurs de succès du programme à l’échelle nationale : taux de couverture de la population cible, taux de détection des lésions de haut grade, nombre de conisations3 effectuées pour traiter ces lésions.
Le dépistage concerne les femmes âgées de 25 à 65 ans [3]. Un prélèvement cervico-utérin en phase liquide pour l’ensemble de la population permet d’adapter le suivi d’un résultat anormal cytologique ou virologique quel que soit l’âge de la femme. Le programme de dépistage prévoit une diversification des professionnels (sages-femmes, médecins biologistes) habilités à réaliser les prélèvements là où il n’y a pas ou plus de gynécologues, les médecins généralistes n’étant souvent pas disponibles, à part quelques femmes médecins qui s’intéressent particulièrement à la gynécologie. Les professionnels préleveurs doivent informer les femmes de la transmission de leurs résultats cytologiques, virologiques et histologiques aux Centres régionaux. Si la patiente s’y oppose, elle peut le signaler à son Centre régional en charge de ses prélèvements. Les professionnels préleveurs doivent également prendre en compte les invitations envoyées par les Centres régionaux de dépistage aux femmes non participantes. Les tests sont alors pris en charge en totalité par l’Assurance maladie, si le prescripteur transmet les informations sur la feuille de prescription. L’objectif ambitieux de ce programme est d’obtenir une couverture de 80 % en dix ans, et une diminution de la mortalité de 30 %.
Technique du frottis et classification des anomalies cytologiques
Le terme « frottis » se réfère au test de Papanicolaou (en anglais, Pap smear), d’après le nom du médecin grec George Papanicolaou qui l’a mis au point. Il est utilisé pour désigner un prélèvement des cellules du col utérin, quelle que soit la méthode utilisée. Initialement, ce test se référait à l’étalement conventionnel d’un prélèvement réalisé sur le col utérin avec une spatule d’Ayre, souvent associé à un prélèvement endocervical avec un coton-tige ou une brosse. Le matériel collecté était alors étalé sur une lame de verre, fixé et coloré. La sensibilité de cette technique dépendait de l’expérience du préleveur, de l’anatomie du col, de l’homogénéité de l’étalement et d’une bonne fixation et coloration du prélèvement. Compte tenu de cette variabilité, la technique de l’étalement en milieu liquide a remplacé l’étalement conventionnel [4]. Après son recueil, le prélèvement est transféré dans un milieu liquide de conservation des cellules. Les prélèvements en milieu liquide permettent de réaliser, après filtration ou centrifugation automatisée, un étalement homogène en couche mince, avec un fond propre dépourvu d’hématies ou de débris cellulaires, et une coloration uniforme. Le matériel recueilli peut être utilisé pour une recherche de l’ADN des HPV HR par PCR (test HPV HR) soit en première intention, soit après une cytologie anormale. La numérisation des lames après un étalement en milieu liquide permettra en outre la transmission d’images pour une lecture à distance, avec la sélection d’une galerie d’images diagnostiques dans un but d’éducation, de formation et de diagnostic de routine. Les anomalies observées lors de l’examen cytologique sont classées selon la terminologie de Bethesda 20144 (Tableau I), peu différente de la version précédente datant de 2001.
Terminologie cytologique de Bethesda 2014.
Les lésions malpighiennes intraépithéliales du col utérin
La lésion malpighienne intraépithéliale de bas grade est décrite dans la Figure 2A . Le suivi de ces lésions est guidé par le fait que seules 10 % d’entre elles sont associées à, ou progressent vers une lésion malpighienne intraépithéliale de haut grade. Le traitement chirurgical, souvent réalisé en ambulatoire, peut être proposé pour les lésions qui persistent après 24 mois.
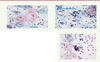 |
Figure 2. Lésions induites par un papillomavirus d’après la terminologie de Bethesda 2014. A. Lésion malpighienne intraépithéliale de bas grade. Les cellules superficielles ont un noyau de volume augmenté et un halo périnucléaire (koïlocytose). Ces koïlocytes témoignent de l’effet cytopathogène d’une infection productive par un papillomavirus humain (HPV). B. Lésion malpighienne intraépithéliale de haut grade. Les cellules basales ont d’importantes atypies nucléaires et un petit cytoplasme (inversion du rapport nucléo-cytoplasmique). Ces anomalies reflètent une infection transformante par un papillomavirus humain à haut risque (HPV HR). C. Adénocarcinome in situ. Les cellules cylindriques (flèche) ont une disposition en palissade. Leur noyau a un volume augmenté et une chromatine anormale (coloration des noyaux et cytoplasmes par hématoxyline et éosine). |
La lésion malpighienne intraépithéliale de haut grade est décrite dans la Figure 2B . Ces lésions peuvent survenir après une infection persistante par un HPV HR, en particulier l’HPV16. Leur prise en charge est immédiate car le risque d’évolution vers un cancer invasif dans les 10 ans est évalué à 30 %.
L’adénocarcinome in situ ( Figure 2C ). Il correspond à la lésion précancéreuse de l’épithélium cylindrique endocervical. La colposcopie5, associée à un curetage de l’endocol, permet d’en faire le diagnostic histologique.
Les insuffisances de la cytologie pour le dépistage primaire, passage au test HPV HR
L’infection par un HPV HR est responsable de 97 % des cancers du col utérin. Les cancers non associés à une infection par un HPV sont des adénocarcinomes du col utérin, le plus souvent de type gastrique, dont le diagnostic est difficile par cytologie. En effet, les cellules cancéreuses des adénocarcinomes sont très bien différenciées et desquament mal car elles sont situées profondément dans l’endocol.
La recherche de l’ADN des papillomavirus à haut risque par PCR (test HPV HR) est plus sensible que la cytologie pour diagnostiquer les lésions précancéreuses [5, 6]. La Haute autorité de santé recommande son utilisation en première intention à partir de l’âge de 30 ans [2]. La meilleure sensibilité du test HPV HR par rapport à la cytologie permet d’espacer de 5 ans l’intervalle entre deux tests négatifs, avec un risque relatif de développer un cancer inférieur à celui d’un examen cytologique tous les 3 ans [5]. En revanche, le test HPV HR a une moins bonne spécificité que la cytologie et impose un triage des tests positifs avant de recommander une colposcopie. Actuellement, l’examen cytologique est la méthode de triage qui a été choisie. Le prélèvement cervico-utérin en phase liquide permet de réaliser le test HPV HR et la cytologie sur le même matériel, et de rédiger un compte rendu intégrant les deux résultats. Une colposcopie sera réalisée pour les femmes présentant un test HPV HR positif et une cytologie anormale et la biopsie permettra de confirmer la présence d’une lésion. Les femmes dont le test HPV HR est positif mais qui présentent une cytologie normale seront revues un an après, pour la réalisation d’un nouveau test HPV HR. Environ la moitié de ces femmes ont une infection persistante. Elles devront alors subir une colposcopie. Les femmes qui ne présentent plus d’infection seront suivies tous les 5 ans avec un test HPV HR ( Figure 3 ).
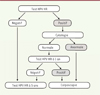 |
Figure 3. Algorithme de dépistage du cancer du col utérin après l’âge de 30 ans. Pour les femmes âgées de plus 30 ans, un test HPV HR est proposé en dépistage. Si le test est positif, un examen cytologique est réalisé. Si des anomalies sont visualisées, la femme doit être rappelée pour réaliser une colposcopie ; si le résultat de la cytologie est négatif, un test HPV HR sera réalisé un an plus tard. Si ce test est positif, une colposcopie sera réalisée ; si le test est négatif, un nouveau test HPV HR sera proposé cinq ans plus tard (d’après HAS). |
L’infection par un HPV est sexuellement transmissible. Elle est donc fréquente chez les femmes jeunes mais, dans la plupart des cas, régresse spontanément. C’est pourquoi le test HPV HR n’est pas proposé en dépistage primaire chez les femmes âgées de moins de 30 ans : un test HPV HR positif à cet âge pourrait en effet induire un geste thérapeutique chirurgical inapproprié, potentiellement préjudiciable à une future grossesse (car pouvant conduire à une fausse couche ou à un accouchement prématuré). Les femmes âgées de 25 à 30 ans continuent donc d’avoir un dépistage par un examen cytologique tous les trois ans. Les recommandations après une cytologie anormale dans cette tranche d’âge restent identiques à celles publiées par l’Inca en 2016 [7]. Ces recommandations induisent une diminution importante du nombre des examens cytologiques à l’échelle nationale. Les biopsies du col utérin sont plus fréquentes après l’âge de 30 ans, principalement liées au constat d’une persistance de l’infection un an après la positivité d’un premier test HPV HR, ce qui doit entraîner un examen colposcopique selon les recommandations de la Haute autorité de santé.
Aux États-Unis, le double immunomarquage des protéines p16 et ki67 sur les frottis sera proposé comme méthode de triage des tests positifs pour des HPV autres que les HPV16 ou 18, les femmes infectées par les HPV16 ou 18 sont en revanche soumises à une colposcopie. Cette stratégie n’est pas validée en France. D’autres méthodes comme l’analyse de la méthylation de l’ADN viral ou de l’ADN de la cellule hôte sont à l’étude. La méthylation de l’ADN viral ou de la cellule hôte permettrait de trier les infections transformantes prévalentes (dans lesquelles la méthylation est forte) et de suivre les infections transformantes récentes (dans lesquelles la méthylation est faible).
L’auto-prélèvement permet d’atteindre une population qui n’est pas suivie par un professionnel de santé et ne répond pas aux invitations de dépistage. Ces femmes reçoivent un matériel à domicile pour faire elles-mêmes, avec un matériel validé, leur prélèvement qui sera ensuite pris en charge pour la réalisation du test HPV HR (par PCR) [8]. L’auto-prélèvement est déjà proposé comme un choix à toute la population cible en Australie ou aux Pays-Bas. Cependant, il oblige à reconvoquer les patientes dont le résultat est positif. L’auto-prélèvement est également proposé dans les pays en développement. Les patientes dont le test HPV HR est positif sont alors examinées à l’aide d’un colposcope portable, quand cela est possible, et/ou traitées directement par cryothérapie ou thermocoagulation.
La vaccination
Les cancers du col utérin ne représentent que 3 000 des 8 000 cas de cancers dus à un HPV HR diagnostiqués chaque année en France, qu’ils soient génitaux, anaux ou oro-pharyngés. Ces autres cas de cancers, qui touchent les deux sexes, ne font pas l'objet de programme de dépistage. Il est donc nécessaire de vacciner les adolescents des deux sexes contre l’infection par HPV afin d’en réduire le nombre.
Le premier vaccin commercialisé, le Gardasil®, utilisait la protéine L1, sous forme recombinante, des HPV de types 6, 11, 16, et 18. Les HPV de types 6 et 11, dits à bas risque, sont responsables des condylomes ano-génitaux et de la papillomatose laryngée.
Le Gardasil® 9 (MSD), est un vaccin nonavalent qui cible 9 types d’HPV (2 + 7). Il inclut les HPV6 et 11, et les HPV HR16, 18, 31, 33, 45, 52 et 58. Ces HPV HR sont impliqués dans 90 % des cancers du col utérin et dans 80 % des lésions précancéreuses. Ce vaccin est recommandé chez les filles et les garçons âgés de 11 à 14 ans [9]. Dans le cadre d’un rattrapage vaccinal, la vaccination est également recommandée pour les filles et les garçons âgés de 15 à 19 ans [9]. Le taux de couverture pour la vaccination contre les HPV en France reste le plus faible de tous les pays Européens : 46 % pour les filles et seulement 6 % pour les garçons [10].
Afin de remédier à ce faible taux de couverture, le président de la République a annoncé, le 28 février 2023, le lancement, dès la rentrée scolaire 2023, d’une campagne de vaccination gratuite généralisée dans les collèges, pour tous les élèves en classe de 5e, avec l’accord de leurs parents, pour agir efficacement contre les papillomavirus.
Les points à retenir
L’infection par les HPV est sexuellement transmissible. C’est une infection fréquente dans la sphère ano-génitale pour les deux sexes, mais également dans la sphère oto-rhino-laryngée.
Le vaccin nonavalent protège contre l’infection par les HPV à haut risque et à bas risque ciblés par le vaccin.
Le dépistage organisé du cancer du col utérin permet une meilleure couverture de la population. Le test HPV HR est plus efficace en dépistage primaire que l’examen cytologique pour diagnostiquer les lésions précancéreuses.
L’association de la vaccination et du dépistage organisé devrait nous rapprocher des objectifs de l’Organisation mondiale de la santé qui vise la disparition du cancer du col utérin à la fin du xxi e siècle.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Le système Bethesda (TBS), officiellement appelé le système Bethesda pour la terminologie de la cytologie cervicale, est un système de terminologie des diagnostics cytologiques cervicaux. Il a été introduit en 1988 et révisé en 1991, 2001, et 2014. Le nom vient du lieu (Bethesda, Maryland) de la conférence, parrainée par le National Institute of Health, qui a établi le système.
Références
- Doorbar J, Quint W, Banks L, et al. The biology and life cycle of human papillomaviruses. Vaccine 2012 ; 30 : F55–F70. [CrossRef] [PubMed] [Google Scholar]
- Haute autorité de santé. Évaluation de la recherche des papillomavirus humains (HPV) en dépistage primaire des lésions précancéreuses et cancéreuses du col de l’utérus et place du double marquage immunohistochimique (p16/Ki67). Saint-Denis La Plaine: HAS, 2019. [Google Scholar]
- Arrêté du 4 mai 2018 relatif à l’organisation du dépistage organisé du cancer du col de l’utérus. Journal officiel du 6 mai 2018. [Google Scholar]
- Sieber AG, Klinkhamer P, Grefte JMM, et al. Comparison of liquid-based cytology with conventional cytology for detection of cervical cancer precursors : a randomized controlled trial. JAMA 2009 ; 302 : 1757–1764. [CrossRef] [PubMed] [Google Scholar]
- Ronco G, Dillner J, Elfström KM, et al. Efficacy of HPV-based screening for prevention of invasive cervical cancer : follow-up of four European randomized controlled trials. Lancet 2014 ; 383 : 524–532. [CrossRef] [PubMed] [Google Scholar]
- Anttila A, Arbyn M, de Vuyst H, et al. European guidelines for quality assurance in cervical cancer screening. Supplements. Second edition. Luxembourg : European Union; European Commission, International Agency for Research on Cancer, World Health Organization, 2015. [Google Scholar]
- Institut national du cancer. Conduite à tenir devant une femme ayant une cytologie cervico-utérine anormale. Thésaurus. Recommandations et référentiels. Boulogne Billancourt : Inca, 2016. http://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Conduite-a-tenir-devant-une-femme-ayant-une-cytologie-cervico-uterine-anormale-Thesaurus. [Google Scholar]
- Institut national du cancer. Référentiel national, cadre et modalités de recours aux autoprélèvements vaginaux. Inca, mai 2022. [Google Scholar]
- Haute autorité de santé. Gardasil® 9 (vaccin nonavalent contre le papillomavirus). MSD vaccins. Avis d’efficience. Saint-Denis La Plaine: HAS, 2017. [Google Scholar]
- Vaccination contre le papillomavirus humain (HPV) : la France est très en retard. Communiqué de l’Académie nationale de médecine, 23 juin 2022. [Google Scholar]
Liste des tableaux
Liste des figures
 |
Figure 1. Double immunomarquage des protéines p16 (en marron) et Ki67 (en rouge) dans des cellules malpighiennes basales du col utérin. Les noyaux cellulaires sont colorés par hématoxyline. |
| Dans le texte | |
 |
Figure 2. Lésions induites par un papillomavirus d’après la terminologie de Bethesda 2014. A. Lésion malpighienne intraépithéliale de bas grade. Les cellules superficielles ont un noyau de volume augmenté et un halo périnucléaire (koïlocytose). Ces koïlocytes témoignent de l’effet cytopathogène d’une infection productive par un papillomavirus humain (HPV). B. Lésion malpighienne intraépithéliale de haut grade. Les cellules basales ont d’importantes atypies nucléaires et un petit cytoplasme (inversion du rapport nucléo-cytoplasmique). Ces anomalies reflètent une infection transformante par un papillomavirus humain à haut risque (HPV HR). C. Adénocarcinome in situ. Les cellules cylindriques (flèche) ont une disposition en palissade. Leur noyau a un volume augmenté et une chromatine anormale (coloration des noyaux et cytoplasmes par hématoxyline et éosine). |
| Dans le texte | |
 |
Figure 3. Algorithme de dépistage du cancer du col utérin après l’âge de 30 ans. Pour les femmes âgées de plus 30 ans, un test HPV HR est proposé en dépistage. Si le test est positif, un examen cytologique est réalisé. Si des anomalies sont visualisées, la femme doit être rappelée pour réaliser une colposcopie ; si le résultat de la cytologie est négatif, un test HPV HR sera réalisé un an plus tard. Si ce test est positif, une colposcopie sera réalisée ; si le test est négatif, un nouveau test HPV HR sera proposé cinq ans plus tard (d’après HAS). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




