| Issue |
Med Sci (Paris)
Volume 39, Number 4, Avril 2023
|
|
|---|---|---|
| Page(s) | 328 - 330 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2023041 | |
| Published online | 24 April 2023 | |
Tunnel ou dommage ? Les pathogènes fongiques entrent dans la lumière
Tunnel or damage? Fungal pathogens coming into the light
ATIP-Avenir équipe Dynamics, structure and molecular biology of fungal invasion, Sorbonne université, Inserm U1135, CNRS, Centre d’immunologie et des maladies infectieuses, Cimi, 75013 Paris, France
On estime que les agents fongiques pathogènes affectent plus d’un milliard de personnes chaque année, dont 150 millions de cas graves ou mettant la vie des patients en danger. Environ 1,7 millions de personnes meurent d’infections fongiques (à comparer aux 1,5 millions de décès dus à la tuberculose et aux 400 000 décès dûs au paludisme) [1]. L’émergence des agents fongiques en tant que menace médicale majeure est liée au nombre toujours croissant de patients particulièrement sensibles à ces infections, notamment les patients immunodéprimés, qui sont traités pour des cancers, le Sida (syndrome de l’immunodéficience acquise) ou après transplantations d’organes, ou les personnes gravement malades et les personnes âgées [1]. L’émergence des infections fongiques a également été favorisée par l’apparition de pandémies virales, telles que la COVID-19 (coronavirus disease 2019), par les modifications environnementales, ou l’utilisation intensive d’antibiotiques qui, détruisant la flore bactérienne, créent de nouvelles niches pour les champignons leur permettant de s’expandre [2].
L’Organisation mondiale de la santé (OMS) a récemment publié une liste de pathogènes fongiques prioritaires. Cette liste inclut quatre champignons dans le « groupe de priorité critique » : Cryptococcus neoformans, Candida auris, Aspergillus fumigatus et Candida albicans. Le plus pathogène de ces pathogène est C. albicans, une levure qui fait partie de la flore commensale normale, colonisant la peau, les muqueuses génitales et intestinales de la plupart des individus sains. Mais opportuniste, cette levure peut envahir la muqueuse gastro-intestinale et ainsi pénétrer dans la circulation sanguine, entraînant, chez les hôtes sensibles, une infection systémique grave pouvant toucher plusieurs organes dont le cœur, l’œil, ou le cerveau, et être à l’origine du décès.
C. albicans possède une variété de facteurs (ou traits) de virulence qui lui permettent, lorsqu’il est commensal, de coloniser le microbiote, mais aussi, lorsqu’il devient infectieux, d’envahir les tissus de l’hôte. La capacité de C. albicans à subir un changement morphologique en réponse à divers signaux environnementaux produits par l’hôte (présence de sérum, pH, etc.), passant alors de l’état de cellules de levure rondes à celui d’hyphes filamenteux, est son trait de virulence le plus important. Cette modification morphologique a été fortement liée à sa capacité à envahir et à endommager les tissus de l’hôte [3].
L’infection des cellules épithéliales, premières cellules barrières à être confrontées à la pénétration de la levure repose sur une série d’étapes séquentielles : l’adhérence du champignon à la cellule, l’initiation de la croissance hyphale, l’invasion et les dommages induits. Si de nombreux progrès ont été réalisés en ce qui concerne la compréhension des mécanismes d’interaction entre C. albicans et les cellules immunitaires de son hôte [4, 5], l’interaction de C. albicans avec les épithéliums n’est encore que partiellement comprise.
D’une façon générale, deux stratégies peuvent être employées par les agents pathogènes invasifs pour pénétrer dans les cellules hôtes : la rupture des membranes de l’hôte et l’accès au cytosol, ou l’utilisation d’un compartiment cellulaire relié à la membrane. Cette distinction entre les « niches » cellulaires s’est avérée particulièrement utile pour décrire l’étape intracellulaire des bactéries invasives. On distingue en effet les agents pathogènes qui brisent les membranes, comme Shigella flexneri, Rickettsia spp. et Listeria monocytogenes, les agents pathogènes qui résident dans des compartiments liés aux membranes, comme Brucella spp., Legionella pneumophila et Chlamydia spp., et les pathogènes qui peuvent s’adapter aux deux modes de vie, comme Salmonella enterica et Mycobacterium tuberculosis [6]. Contrairement aux modes de vie intracellulaires de nombreuses bactéries, virus et parasites qui ont été étudiés en détail, les modes de vie des pathogènes fongiques humains, y compris C. albicans, restent partiellement décrits, avec des questions ouvertes concernant les niches d’hôtes exploitées par les champignons à différents stades de l’infection, et les mécanismes fongiques et de l’hôte qui sont actifs dans chaque niche.
L’étude des infections fongiques, chez l’homme ou avec des modèles animaux, reste un défi en raison du nombre limité d’approches expérimentales à hautes résolutions spatiale et temporelle permettant d’accéder aux processus cellulaires et moléculaires qui se produisent à l’interface entre le champignon et son hôte. Les processus de l’infection fongique peuvent néanmoins être étudiés dans des modèles in vitro simplifiés dans lesquels les champignons sont mis en présence de cellules de lignée épithéliales, comme les cellules HeLa. Bien que moins pertinents sur le plan physiopathologique, ces modèles permettent des études détaillées grâce à des approches d’imagerie à haute résolution qui fournissent de nouvelles informations sur les mécanismes qui sont impliqués dans les relations entre les cellules et les champignons qui les infectent.
Pour étudier le mode de vie invasif de C. albicans lors d’une infection épithéliale in vitro, nous avons utilisé deux approches de microscopie : l’imagerie de cellules vivantes et la microscopie électronique tridimensionnelle en volume.
L’imagerie de cellules vivantes repose sur l’utilisation d’un microscope à fluorescence entièrement automatisé, qui permet de suivre la progression de l’infection pendant plusieurs heures dans des conditions environnementales stables. Plusieurs sites d’intérêt peuvent être acquis en trois dimensions à l’aide de plusieurs canaux fluorescents, ce qui permet de comprendre, de manière dynamique, où et quand les facteurs de l’hôte et ceux du pathogène se rencontrent. Pour qu’un agent pathogène établisse une niche invasive cytosolique, il doit provoquer une brèche dans la membrane plasmique ou dans un compartiment endocytique de l’hôte, à un moment donné de l’infection. Pour identifier cette étape clé, l’imagerie des cellules vivantes peut être utilisée en combinaison avec des rapporteurs sensibles aux dommages en temps réel, qui indiqueront le moment et le lieu précis de la rupture de la membrane de l’hôte pendant l’infection [7].
La microscopie électronique classique offre un pouvoir de résolution supérieur à celui de la microscopie optique. Cette technique d’imagerie a été particulièrement appliquée pour l’étude des pathogènes invasifs. Jusqu’à récemment, la plupart des techniques de microscopie électronique étaient limitées dans leur capacité à décrire pleinement les interfaces cellulaires tridimensionnelles expansives entre l’agent pathogène et l’hôte, en raison des limites du volume d’acquisition, confinant normalement l’épaisseur de l’échantillon à moins de 500 nm. En pratique, cela signifie que l’étude de l’organisation ultrastructurale des cellules, ou des interfaces pathogène-hôte, d’une épaisseur supérieure à la largeur d’une bactérie environ était difficile [8]. Au cours de la dernière décennie, de nouvelles techniques de microscopie électronique dites « en volume » qui ne sont pas limitées par ces dimensions ont été développées et ont été utilisées avec succès pour l’étude des pathogènes invasifs [9]. Il s’agit notamment de la microscopie électronique à balayage à face de bloc en série (ou SBF-SEM) et de la microscopie électronique à balayage à faisceau ionique focalisé (ou FIB-SEM). Ces techniques permettent toutes deux d’étudier de vastes environnements cellulaires contenant des interfaces pathogène-hôte étendues, avec une relative facilité, une caractéristique particulièrement avantageuse pour l’étude des champignons et autres pathogènes eucaryotes.
Pour étudier l’infection in vitro par C. albicans, nous avons utilisé une approche de microscopie appliquée à deux lignées de cellules épithéliales : les cellules HeLa (isolées d’une tumeur cancéreuse du col de l’utérus) et les cellules Caco-2 (d’origine intestinale, isolées d’un adénocarcinome colique) [10]. En utilisant l’imagerie de cellules vivantes combinée au suivi de la galectine-3, une protéine sensible aux dommages cellulaires et impliquée dans l’interaction de la levure avec les cellules hôtes [11], couplée à la GFP (green fluorescent protein), nous avons montré que pendant les premières heures de l’infection, C. albicans occupait différentes niches intracellulaires, en accédant, à différents stades de l’invasion, au cytosol de la cellule après rupture de sa membrane plasmique, et aussi en résidant dans un compartiment lié à la membrane, sous la forme d’un tunnel transcellulaire, qui s’étend sur toute la longueur de la cellule hôte, sans rupture de la membrane plasmique, et cela jusqu’à 9 heures après l’infection (Figure 1). La microscopie électronique en volume a révélé, quant à elle, que lors de ce processus de tunnelage transcellulaire, les hyphes pouvaient traverser les cellules voisines, conduisant à la formation de tunnels multicouches pouvant mesurer plus de 100 µm de long.
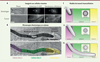 |
Figure 1. Mode de vie invasif de Candida albicans pendant l’infection de cellules épithéliales in vitro. A. Imagerie de cellules vivantes lors de l’infection de cellules HeLa. Un seul point temporel est présenté. Dans l’ensemble, 2/3 des événements d’invasion entraînent des lésions de la membrane de la cellule hôte, détectées par la galectine-3 (en haut), tandis que dans 1/3 des événements d’invasion, aucune lésion membranaire n’est détectée : les membranes de l’hôte sont observées le long de la trajectoire de l’hyphe, indiquant une invasion par tunnel transcellulaire (en bas). B..Microscopie électronique en volume d’un hyphe envahissant trois cellules Caco-2 séquentiellement, révélant la structure de tunnel transcellulaire à une résolution nanométrique. Le diamètre de l’hyphe est d’environ 1 µm. Un « gonflement » du tunnel en contact avec les réserves de glycogène de l’hôte est observé dans la cellule hôte (cellule 3). C. Modèle de tunnel transcellulaire multi-cellulaire. Comme aucune brèche dans la membrane de l’hôte ne se produit pendant l’invasion, chaque membrane de la cellule hôte est invaginée et étirée par l’hyphe qui s’étend dans les cellules voisines pendant la séquence d’invasion, formant une structure membranaire multicouche. Une couche d’exclusion (EL) contenant de l’actine hôte entoure les hyphes dans la première cellule envahie (barre d’échelle : 10 µm) (figure adaptée de [9]). |
Le mode de vie invasif de C. albicans dépend de la cellule hôte, avec, à la fois, des dommages membranaires et des tunnels lors de l’infection des cellules HeLa, mais uniquement avec des tunnels lors de l’infection des cellules Caco-2. La microscopie électronique en volume a également mis en évidence des régions de tunnels transcellulaires « gonflés », en contact direct avec les réserves de glycogène de la cellule hôte. Ces sites de contact « gonflés » avec le glycogène suggère la possibilité que ce glycogène puisse être détourné comme source de nutriments par C. albicans au cours de l’invasion. Des recherches supplémentaires restent cependant nécessaires pour explorer cette perspective passionnante.
Nos travaux ont ainsi révélé une complexité du mode de vie invasif de C. albicans qui n’avait jamais été observée. De nombreuses questions concernant les mécanismes cellulaires et moléculaires précis qui régissent ce mode de vie invasif de C. albicans se posent. Une étude détaillée, à différentes échelles de temps (de quelques secondes à quelques heures) et à différentes échelles spatiales (de l’échelle nanométrique à l’échelle des centaines de microns), reste en effet à réaliser. En intégrant différentes modalités de microscopie qui couvrent ces échelles temporelles et spatiales, couplées à des rapporteurs de dommages et à des études fonctionnelles du champignon et de l’hôte, nous continuons à explorer in vitro l’invasion épithéliale de C. albicans. À plus long terme, nous souhaitons étendre notre approche à des modèles plus pertinents sur le plan physiologique, comme les modèles d’infection chez la souris.
Les concepts et les méthodes qui émergent de nos travaux peuvent également s’appliquer à l’étude d’autres pathogènes fongiques, comme Aspergillus fumigatus, qui traverse l’épithélium pulmonaire sans perturber l’intégrité de la membrane des cellules, en utilisant, là encore, un tunnel soutenu par l’actine [12, 13].
Nos travaux pourraient également servir de base à de futurs projets sur des aspects connexes de l’infection fongique, comme l’étude de l’équilibre entre commensalisme et pathogénicité, comme le déclenchement de la réponse immunitaire de l’hôte, et l’implication, récemment découverte, des champignons dans les tumeurs [14, 15]. Au-delà des interactions avec un hôte humain, ces travaux permettent également d’entrevoir la façon dont les champignons fonctionnent dans la nature. Concevoir des stratégies pour bloquer l’infection précoce par C. albicans, par exemple en interférant avec les niches invasives auxquelles le champignon accède normalement et en le dirigeant vers des états spécifiques souhaités, reste un défi pour les recherches à venir.
Liens d’intérêt
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Kainz K, Bauer MA, Madeo F, Carmona-Gutierrez D. Fungal infections in humans : The silent crisis. Microb Cell 2020; 7 : 143–5. [CrossRef] [PubMed] [Google Scholar]
- Hoenigl M. When disaster strikes fungi take control. Lancet Respir Med 2022; 10 : 1104–1106. [CrossRef] [PubMed] [Google Scholar]
- Yang W, Yan L, Wu C, et al. Fungal invasion of epithelial cells. Microbiol Res 2014 ; 169 : 803–810.10.1016/j.micres.2014.02.013 [CrossRef] [PubMed] [Google Scholar]
- Gow NAR, van de Veerdonk FL, Brown AJP, Netea MG. Candida albicans morphogenesis and host defence : discriminating invasion from colonization. Nat Rev Microbiol 2012 ; 10 : 112–122. [CrossRef] [Google Scholar]
- Jouault T, Sarazin A, Martinez-Esparza M, et al. Host responses to a versatile commensal : PAMPs and PRRs interplay leading to tolerance or infection by Candida albicans. Cell Microbiol 2009; 11 : 1007–15. [CrossRef] [PubMed] [Google Scholar]
- Gutierrez MG, Enninga J. Intracellular niche switching as host subversion strategy of bacterial pathogens. Curr Opin Cell Biol 2022; 76. [Google Scholar]
- Paz I, Sachse M, Dupont N, et al. Galectin-3, a marker for vacuole lysis by invasive pathogens. Cell Microbiol. 2010; 12 : 530–44. [CrossRef] [PubMed] [Google Scholar]
- Knott G, Genoud C. Is EM dead? J Cell Sci 2013; 126 : 4545–52. [CrossRef] [PubMed] [Google Scholar]
- Weiner A, Enninga J. The Pathogen-Host Interface in Three Dimensions : Correlative FIB/SEM Applications. Trends Microbiol 2019; 27 : 426–39. [CrossRef] [PubMed] [Google Scholar]
- Lachat J, Pascault A, Thibaut D, et al. Trans-cellular tunnels induced by the fungal pathogen Candida albicans facilitate invasion through successive epithelial cells without host damage. Nat Commun 2022; 13 : 3781. [CrossRef] [PubMed] [Google Scholar]
- Jouault T, El Abed-El Behi M, Martínez-Esparza M, et al. Specific recognition of Candida albicans by macrophages requires galectin-3 to discriminate Saccharomyces cerevisiae and needs association with TLR2 for signaling. J Immunol 2006; 177 : 4679–87. [CrossRef] [PubMed] [Google Scholar]
- Fernandes J, Hamidi F, Leborgne R, et al. Penetration of the Human Pulmonary Epithelium by Aspergillus fumigatus Hyphae. J Infect Dis 2018; 218 : 1306–13. [CrossRef] [PubMed] [Google Scholar]
- Seidel C, Moreno-Velásquez SD, Ben-Ghazzi N, et al. Phagolysosomal Survival Enables Non-lytic Hyphal Escape and Ramification Through Lung Epithelium During Aspergillus fumigatus Infection. Front Microbiol 2020; 11. [CrossRef] [Google Scholar]
- Narunsky-Haziza L, Sepich-Poore GD, Livyatan I, et al. Pan-cancer analyses reveal cancer-type-specific fungal ecologies and bacteriome interactions. Cell 2022; 185 : 3789–806.e17. [CrossRef] [PubMed] [Google Scholar]
- Dohlman AB, Klug J, Mesko M, et al. A pan-cancer mycobiome analysis reveals fungal involvement in gastrointestinal and lung tumors. Cell 2022; 185 : 3807–22.e12. [CrossRef] [PubMed] [Google Scholar]
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Mode de vie invasif de Candida albicans pendant l’infection de cellules épithéliales in vitro. A. Imagerie de cellules vivantes lors de l’infection de cellules HeLa. Un seul point temporel est présenté. Dans l’ensemble, 2/3 des événements d’invasion entraînent des lésions de la membrane de la cellule hôte, détectées par la galectine-3 (en haut), tandis que dans 1/3 des événements d’invasion, aucune lésion membranaire n’est détectée : les membranes de l’hôte sont observées le long de la trajectoire de l’hyphe, indiquant une invasion par tunnel transcellulaire (en bas). B..Microscopie électronique en volume d’un hyphe envahissant trois cellules Caco-2 séquentiellement, révélant la structure de tunnel transcellulaire à une résolution nanométrique. Le diamètre de l’hyphe est d’environ 1 µm. Un « gonflement » du tunnel en contact avec les réserves de glycogène de l’hôte est observé dans la cellule hôte (cellule 3). C. Modèle de tunnel transcellulaire multi-cellulaire. Comme aucune brèche dans la membrane de l’hôte ne se produit pendant l’invasion, chaque membrane de la cellule hôte est invaginée et étirée par l’hyphe qui s’étend dans les cellules voisines pendant la séquence d’invasion, formant une structure membranaire multicouche. Une couche d’exclusion (EL) contenant de l’actine hôte entoure les hyphes dans la première cellule envahie (barre d’échelle : 10 µm) (figure adaptée de [9]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




