| Issue |
Med Sci (Paris)
Volume 39, Number 1, Janvier 2023
|
|
|---|---|---|
| Page(s) | 9 - 12 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2022185 | |
| Published online | 24 January 2023 | |
Should I stay or should I go? L’ancrage des cellules souches neurales au cours du développement du cortex cérébral dépend de la GTPase RAB6 et de la dynéine
Should I stay or should I go? Neural stem cell anchorage during cerebral cortex development requires the GTPase RAB6 and dynein
1
Unité Biologie des ARN et virus Influenza, Institut Pasteur, CNRS UMR3569, Paris, France
2
Unité Mécanismes moléculaires du transport intracellulaire, Institut Curie, CNRS UMR144, Paris, France
3
Unité Biologie cellulaire de la neurogenèse des mammifères, Institut Curie, CNRS UMR144, Paris, France
a jean-baptiste.brault@pasteur.fr
b bruno.goud@curie.fr
c alexandre.baffet@curie.fr
Le cortex cérébral des mammifères est le siège des fonctions cognitives dites supérieures, telles que le langage ou la prise de décision. La quasi-totalité des neurones et des cellules gliales du néocortex en développement dérive d’un réservoir de cellules souches neurales appelées cellules de la glie radiaire. Deux types ont été identifiés, qui diffèrent en termes de localisation, de forme et d’abondance au sein du tissu cérébral. Les cellules de la glie radiaire apicales, présentes dans le cerveau de tous les mammifères, sont des cellules épithéliales connectées par des jonctions serrées, formant ainsi un neuro-épithélium le long des ventricules latéraux. Elles ont une forme allongée caractéristique et sont fortement polarisées : elles possèdent un long prolongement basal qui s’étend jusqu’à la surface du cortex et sert de guide pour la migration des neurones néo-formés, ainsi qu’un prolongement apical relié à la paroi des ventricules, en contact avec le liquide cérébro-spinal (Figure 1A). Les cellules de la glie radiaire basales ont été identifiées plus récemment [1]. Elles sont rares dans les espèces lissencéphaliques (i.e., dont le cerveau est lisse, sans circonvolutions) comme la souris, mais sont abondantes dans les espèces gyrencéphaliques (i.e., dont le cerveau est circonvolué) comme les primates (Figure 1A) chez lesquels elles ont joué un rôle prépondérant dans l’expansion du cortex au cours de l’évolution. Ces cellules, qui dérivent directement des cellules de la glie radiaire apicales, ont perdu leurs jonctions intercellulaires apicales et ne sont donc pas épithéliales. Le mécanisme de leur formation n’est pas connu. On sait cependant que la polarité cellulaire apico-basale est essentielle au maintien des cellules de la glie radiaire apicales au sein de l’épithélium, et que son altération induit leur délamination et l’apparition de cellules de la glie radiaire basales [2]. Chez le furet, une espèce gyrencéphalique, l’expression de la cadhérine 1, une protéine majeure des jonctions d’adhérence intercellulaire, diminue lors de la période de formation des cellules de la glie radiaire basales. De plus, la perte de la cadhérine 1 dans le cortex cérébral, induite par la technique d’interférence ARN, suffit à produire ce type de cellules [3].
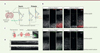 |
Figure 1. Impact de la suppression de RAB6 sur le développement du cortex cérébral. A. Représentation schématique du développement du néocortex des mammifères. Les cellules de la glie radiaire (CGR) apicales se différencient en neurones via un progéniteur intermédiaire (PI). Les neurones migrent le long du prolongement basal des CGR. Les CGR basales, abondantes dans les espèces gyrencéphaliques, dérivent des CGR apicales par un mécanisme encore mal compris. B. Coupes coronales de cerveau embryonnaire de souris témoins (Rab6+/+) et de souris mutantes dépourvues de la protéine RAB6 (Rab6-/-), avec immunomarquage de la protéine PAX6 (en rouge) et de la vimentine phosphorylée (p-VIM, en vert). Les noyaux cellulaires sont révélés par une coloration avec le DAPI (en blanc). La suppression de RAB6 provoque l’apparition de CGR basales, qui maintiennent leur capacité de prolifération. Barre d’échelle : 25 µm. C. Injection intra-ventriculaire in utero d’une solution d’ADN dans le cerveau d’un embryon, et expression de cet ADN dans les CGR apicales après électroporation. Le cerveau est sectionné en coupes coronales 24 heures après l’électroporation. Ces coupes sont ensuites cultivées sur des filtres et observées avec un microscope confocal à disque rotatif, permettant de réaliser des films. D. Le devenir des cellules électroporées peut être suivi au cours du temps grâce à l’expression de la protéine fluorescente GFP (green fluorescent protein). Le temps après électroporation est indiqué en heures : minutes sous chaque image. Les cellules exprimant la recombinase Cre sont privées de RAB6 et perdent alors leur prolongement apical, qui se rétracte (voir le déplacement de l’astérisque jaune indiquant l’extrêmité de ce prolongement) (figure réalisée à l’aide de BioRender). |
L’établissement et le maintien de la polarité apico-basale des cellules épithéliales dépendent de différents complexes protéiques qui interagissent pour organiser les domaines membranaires baso-latéraux et apicaux. La protéine Crumbs est un déterminant majeur de la polarité apicale des cellules épithéliales, et sa suppression par invalidation génique désorganise les jonctions épithéliales des cellules de la glie radiaire apicales [4]. Cette protéine est acheminée à la membrane apicale de la cellule par la voie de sécrétion « classique » constituée par le réticulum endoplasmique, l’appareil de Golgi et les vésicules de sécrétion. La GTPase RAB6 contrôle le trafic entre l’appareil de Golgi et la membrane plasmique (transport post-golgien) [5], mais les mécanismes moléculaires qui régulent cette voie de transport dans les cellules épithéliales demeurent mal connus. Cela tient en partie au fait que l’épaisseur des tissus épithéliaux rend techniquement difficile leur imagerie dynamique à haute résolution.
La suppression de la GTPase RAB6 provoque la délamination des cellules de la glie radiaire apicales en interphase
Pour comprendre l’importance de la voie de transport post-golgienne dans le développement du cortex cérébral, nous avons produit des souris mutantes chez lesquelles le gène codant RAB6 a été invalidé [6]. Afin d’évaluer l’impact de l’absence de RAB6 sur les cellules de la glie radiaire apicales, nous avons préparé des coupes coronales de cerveau embryonnaire issu de ces souris ainsi que de souris témoins de génotype sauvage, et marqué deux protéines spécifiques de ces cellules : le facteur de transcription PAX6 et la vimentine dans son état phosphorylé, un marqueur des cellules de la glie radiaire en mitose. Dans le cortex des embryons mutants dépourvus de RAB6, nous avons observé l’apparition d’une sous-population de cellules basales capables de se diviser, pouvant correspondre à des cellules de la glie radiaire basales (Figure 1B). Une observation semblable a été faite chez d’autres souris mutantes dépouvues de la protéine LIS1 (lissencephaly-1), un partenaire essentiel du moteur moléculaire dynéine. Nous avons donc formulé l’hypothèse que la voie de transport entre l’appareil de Golgi et la membrane plasmique apicale est cruciale pour la stabilisation des jonctions entre les cellules de la glie radiaire apicales et pour le maintien de ces cellules dans le neuro-épithélium. Pour vérifier cette hypothèse, nous avons produit un modèle murin inductible dans lequel l’invalidation du gène codant RAB6 est conditionnée par la présence de la recombinase Cre. Nous avons alors pratiqué une électroporation in utero des embryons (Figure 1C) avec un plasmide permettant l’expression simultanée de cette recombinase et de la protéine fluorescente verte (green fluorescent protein, GFP), afin de pouvoir suivre le devenir des cellules privées de RAB6. L’observation des coupes tissulaires obtenues à partir du cerveau de ces embryons au microscope confocal à disque rotatif1 a permis de constater la délamination d’une proportion importante de cellules dépourvues de RAB6, qui se détachaient de l’épithélium et voyaient leur prolongement apical se rétracter en direction du corps cellulaire (Figure 1D). Le transport apical post-golgien est donc essentiel à la stabilisation des jonctions entre les cellules de la glie radiaire apicales et au maintien de ces cellules dans le neuro-épithélium.
Le transport apical de la protéine Crumbs contrôlant la polarité cellulaire dépend de la dynéine
Nous avons ensuite cherché à comprendre l’organisation de cette voie de transport au sein du prolongement apical des cellules de la glie radiaire, dans lequel les microtubules sont orientés de manière unidirectionnelle, avec leurs extrémités négatives situées vers la surface apicale [7]. Afin de tester l’hypothèse que le mouvement des vésicules post-golgiennes vers la membrane apicale est assuré par le moteur moléculaire dynéine, nous avons exprimé la protéine RAB6 fusionnée à la GFP par électroporation in utero et réalisé des films avec une grande résolution spatiale (100 x) et temporelle (une image par seconde) des vésicules exprimant RAB6, dans des conditions où l’activité de la dynéine est inhibée, soit par un traitement avec l’inhibiteur pharmacologique dynarrestine, soit en surexprimant un mutant dominant-négatif du complexe dynéine/dynactine (domaine coiled-coil 1 de la protéine p150Glued, CC1). Nous avons alors pu montrer qu’en inactivant la dynéine, le nombre de vésicules post-golgiennes ainsi que le temps qu’elles passent en direction de la surface apicale diminuent.
La délamination en interphase des cellules épithéliales est la conséquence d’une déstabilisation des jonctions d’adhérence intercellulaire, qui elles-mêmes dépendent de l’établissement et du maintien de la polarité apicale. La protéine Crumbs est transportée dans la cellule par la voie de sécrétion à la membrane plasmique. Ainsi, l’isoforme Crumbs 3 (la plus exprimée dans les cellules épithéliales des mammifères) et sa partenaire de liaison PALS1 (ou MMP5, membrane palmitoylated protein 5) sont localisées à la membrane apicale des cellules de la glie radiaire apicales (Figure 2A). Pour montrer que le complexe RAB6/dynéine contrôle le transport apical de Crumbs 3 dans ces cellules, nous avons exprimé cette protéine fusionnée à la GFP (protéine rapporteuse) dans le système RUSH (retention using selective hooks) [8]. Cet outil permet, grâce à la co-expression d’une protéine résidente du réticulum endoplasmique, d’y retenir la protéine d’intérêt et d’induire sa sortie synchronisée en ajoutant de la biotine dans le milieu de culture (Figure 2B). L’expression in utero de la construction Crumbs 3-GFP-RUSH chez des embryons de souris par électroporation, en présence ou non du domaine CC1 de p150Glued (inhibiteur de l’activité de la dynéine), puis l’ajout de la biotine dans le milieu de culture des coupes tissulaires produites ensuite, afin de suivre le transport intracellulaire de Crumbs 3, a permis de montrer que dans les cellules de la glie radiaire des embryons témoins, Crumbs 3 atteint l’appareil de Golgi 20 minutes après son relargage du réticulum endoplasmique, puis la membrane apicale des cellules dès 60 minutes, tandis que dans les cellules de la glie radiaire dont l’activité de la dynéine est inhibée, Crumbs 3 parvient à rejoindre l’appareil de Golgi, mais n’atteint que rarement la membrane apicale, même après 120 minutes (Figure 2C).
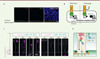 |
Figure 2. RAB6 et la dynéine sont essentielles au transport apical polarisé du complexe Crumbs. A. Coupes coronales de cerveau d’embryons de souris témoins (i.e. de génotype sauvage) où les protéines Crumbs 3 (CRB3) et PALS1 sont immunomarquées, montrant la localisation apicale du complexe moléculaire Crumbs. Les noyaux sont colorés au DAPI (bleu). Barre d’échelle : 25 µm. B. Le système RUSH permet de retenir une protéine rapporteuse (ici CRB3-GFP) dans le réticulum endoplasmique (RE) grâce à l’interaction entre un peptide d’attachement à la streptavidine (streptavidin-binding peptide, SBP) et la streptavidine (St) fusionnée à une protéine résidente du RE (i.e., contenant le motif KDEL à l’extrémité C-terminale de sa séquence peptidique). L’ajout de biotine en excès dans le milieu de culture induit un relargage synchrone de la protéine rapporteuse retenue dans le RE et permet de suivre son transport intracellulaire par microscopie photonique à fluorescence. C..L’expression de la construction CRB3-GFP-RUSH dans des cellules de la glie radiaire apicales permet de montrer que l’inhibition de l’activité de la dynéine par le peptide CC1 p150Glued bloque l’acheminement de CRB3 vers la membrane plasmique apicale. Barre d’échelle : 5 µm. D. Le complexe RAB6/dynéine contrôle le transport polarisé post-golgien de la protéine Crumbs, impliquée dans la polarité apico-basale cellulaire, vers la membrane apicale des cellules de la glie radiaire. Cette voie de transport le long des microtubules est essentielle à l’établissement et au maintien des jonctions d’adhérence intercellulaire apicales. |
Le complexe RAB6/dynéine est impliqué dans la localisation de Crumbs et dans le maintien des jonctions d’adhérence entre les cellules de la glie radiaire
Alors que Crumbs 3 et PALS1 sont normalement localisées dans la région apicale des cellules de la glie radiaire, le long des ventricules du cerveau embryonnaire (Figure 2A), des régions entières de tissu cérébral sont dépourvues de ces protéines lorsque le gène codant RAB6 ou celui codant LIS1 a été invalidé. Nous avons également analysé les jonctions d’adhérence intercellulaire et avons constaté la présence de nombreuses régions dépourvues de N-cadhérine, une protéine majeure de ces jonctions, dans le cortex des embryons mutants (Figure 2D).
Ainsi, non seulement l’inactivation de la voie de transport intracellulaire impliquant l’activité du complexe RAB6/dynéine altère l’intégrité du neuro-épithélium du néocortex en déstabilisant les jonctions d’adhérence entre les cellules de la glie radiaire apicales, mais elle induit aussi la formation de cellules localisées de manière basale, qui conservent leurs capacités prolifératives, ce qui suggère que le contrôle des mécanimes moléculaires de cette voie de transport a pu être impliqué dans l’apparition des cellules de la glie radiaire basales au cours de l’évolution du cerveau des primates.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Un microscope confocal est un microscope optique qui a la propriété de réaliser des images de très faible profondeur de champ (environ 400 nm), appelées « sections optiques ». En positionnant le plan focal de l’objectif à différents niveaux de profondeur dans l’échantillon, il est possible de réaliser des séries d’images à partir desquelles on peut alors obtenir une représentation tridimensionnelle de l’objet. Le microscope confocal à disque rotatif permet d’analyser simultanément et de façon continue plusieurs endroits de l’échantillon à observer.
Références
- Hansen DV, Lui JH, Parker PRL, et al. Neurogenic radial glia in the outer subventricular zone of human neocortex. Nature 2010 ; 464 : 55–61. [Google Scholar]
- Chou FS, Li R, Wang PS. Molecular components and polarity of radial glial cells during cerebral cortex development. Cell Mol Life Sci 2018 ; 75 : 1027–1041. [CrossRef] [PubMed] [Google Scholar]
- Martínez-Martínez MÁ, De Juan Romero C, Fernández V, et al. A restricted period for formation of outer subventricular zone defined by Cdh1 and Trnp1 levels. Nat Commun 2016 ; 7 : 11812. [CrossRef] [PubMed] [Google Scholar]
- Dudok JJ, Murtaza M, Henrique Alves C, et al. Crumbs 2 prevents cortical abnormalities in mouse dorsal telencephalon. Neurosci Res 2016 ; 108 : 12–23. [CrossRef] [PubMed] [Google Scholar]
- Fourriere L, Kasri A, Gareil N, et al. RAB6 and microtubules restrict protein secretion to focal adhesions. J Cell Biol 2019 ; 218 : 2215–2231. [CrossRef] [PubMed] [Google Scholar]
- Brault JB, Bardin S, Lampic M, et al. RAB6 and dynein drive post-Golgi apical transport to prevent neuronal progenitor delamination. EMBO Rep 2022; 23 : e54605. [CrossRef] [PubMed] [Google Scholar]
- Coquand L, Victoria GS,Tata A, et al. CAMSAPs organize an acentrosomal microtubule network from basal varicosities in radial glial cells. J Cell Biol 2021; 220 : e202003151. [CrossRef] [PubMed] [Google Scholar]
- Boncompain G, Divoux S, Gareil N, et al. Synchronization of secretory protein traffic in populations of cells. Nat Methods 2012 ; 9 : 493–498. [CrossRef] [PubMed] [Google Scholar]
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Impact de la suppression de RAB6 sur le développement du cortex cérébral. A. Représentation schématique du développement du néocortex des mammifères. Les cellules de la glie radiaire (CGR) apicales se différencient en neurones via un progéniteur intermédiaire (PI). Les neurones migrent le long du prolongement basal des CGR. Les CGR basales, abondantes dans les espèces gyrencéphaliques, dérivent des CGR apicales par un mécanisme encore mal compris. B. Coupes coronales de cerveau embryonnaire de souris témoins (Rab6+/+) et de souris mutantes dépourvues de la protéine RAB6 (Rab6-/-), avec immunomarquage de la protéine PAX6 (en rouge) et de la vimentine phosphorylée (p-VIM, en vert). Les noyaux cellulaires sont révélés par une coloration avec le DAPI (en blanc). La suppression de RAB6 provoque l’apparition de CGR basales, qui maintiennent leur capacité de prolifération. Barre d’échelle : 25 µm. C. Injection intra-ventriculaire in utero d’une solution d’ADN dans le cerveau d’un embryon, et expression de cet ADN dans les CGR apicales après électroporation. Le cerveau est sectionné en coupes coronales 24 heures après l’électroporation. Ces coupes sont ensuites cultivées sur des filtres et observées avec un microscope confocal à disque rotatif, permettant de réaliser des films. D. Le devenir des cellules électroporées peut être suivi au cours du temps grâce à l’expression de la protéine fluorescente GFP (green fluorescent protein). Le temps après électroporation est indiqué en heures : minutes sous chaque image. Les cellules exprimant la recombinase Cre sont privées de RAB6 et perdent alors leur prolongement apical, qui se rétracte (voir le déplacement de l’astérisque jaune indiquant l’extrêmité de ce prolongement) (figure réalisée à l’aide de BioRender). |
| Dans le texte | |
 |
Figure 2. RAB6 et la dynéine sont essentielles au transport apical polarisé du complexe Crumbs. A. Coupes coronales de cerveau d’embryons de souris témoins (i.e. de génotype sauvage) où les protéines Crumbs 3 (CRB3) et PALS1 sont immunomarquées, montrant la localisation apicale du complexe moléculaire Crumbs. Les noyaux sont colorés au DAPI (bleu). Barre d’échelle : 25 µm. B. Le système RUSH permet de retenir une protéine rapporteuse (ici CRB3-GFP) dans le réticulum endoplasmique (RE) grâce à l’interaction entre un peptide d’attachement à la streptavidine (streptavidin-binding peptide, SBP) et la streptavidine (St) fusionnée à une protéine résidente du RE (i.e., contenant le motif KDEL à l’extrémité C-terminale de sa séquence peptidique). L’ajout de biotine en excès dans le milieu de culture induit un relargage synchrone de la protéine rapporteuse retenue dans le RE et permet de suivre son transport intracellulaire par microscopie photonique à fluorescence. C..L’expression de la construction CRB3-GFP-RUSH dans des cellules de la glie radiaire apicales permet de montrer que l’inhibition de l’activité de la dynéine par le peptide CC1 p150Glued bloque l’acheminement de CRB3 vers la membrane plasmique apicale. Barre d’échelle : 5 µm. D. Le complexe RAB6/dynéine contrôle le transport polarisé post-golgien de la protéine Crumbs, impliquée dans la polarité apico-basale cellulaire, vers la membrane apicale des cellules de la glie radiaire. Cette voie de transport le long des microtubules est essentielle à l’établissement et au maintien des jonctions d’adhérence intercellulaire apicales. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




