| Issue |
Med Sci (Paris)
Volume 38, Number 4, Avril 2022
|
|
|---|---|---|
| Page(s) | 359 - 365 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2022039 | |
| Published online | 29 April 2022 | |
Tax, marionnettiste de la transcription du HTLV-1
Tax, the puppet master of HTLV-1 transcription
Équipe Rétrovirus, infection et latence, Université Paris Cité, Inserm U1016, CNRS UMR8104, Institut Cochin, 22 rue Méchain, 75014 Paris, France
Les rétrovirus sont des virus dont le génome est constitué d’un ARN rétrotranscrit en ADN dans la cellule, qui s’intègre alors dans le génome cellulaire. La transcription du génome rétroviral intégré est ensuite réalisée par la machinerie de transcription de l’ARN polymérase II. Dans le cas du virus T-lymphotrope humain de type 1 (HTLV-1, pour human T-lymphotropic virus type 1), rétrovirus responsable de la leucémie aiguë de l’adulte et de maladies inflammatoires, la transcription est contrôlée par la protéine virale Tax. Celle-ci agit selon un mode d’action original car le mécanisme activateur ne repose pas sur une interaction directe avec le promoteur viral, mais sur le recrutement de différents facteurs et cofacteurs cellulaires de la transcription. Les facteurs cellulaires recrutés par Tax sont impliqués dans l’activation initiale du promoteur, mais également dans les étapes ultérieures du processus de transcription lui-même. Cette revue décrit ce mécanisme particulier de transcription virale, de la levée de la répression transcriptionnelle jusqu’à l’élongation des transcrits viraux néosynthétisés.
Abstract
Retroviruses exploit the RNA polymerase II transcription machinery for the transcription of their genes. This is the case of Human T-lymphotropic virus type 1 (HTLV-1), the retrovirus responsible for adult T-cell leukemia and for various inflammatory diseases. HTLV-1 transcription is under the control of the viral protein Tax, which exhibits an original mode of action since it does not rely on direct promoter interaction but rather on the recruitment of various cellular factors and cofactors of transcription. The factors that Tax recruits are involved in the initial step of promoter activation but also in the subsequent steps of the transcription process itself. This review describes this particular mechanism of viral transcription, from the epigenetic release of the viral promoter to the elongation of the neosynthesized viral silencing transcripts.
© 2022 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Claudine Pique).
Le virus T-lymphotrope humain de type 1
Le virus T-lymphotrope humain de type 1 (HTLV-1) est le seul rétrovirus oncogène connu chez l’homme. Il est en effet responsable de la leucémie aiguë de l’adulte, une prolifération maligne de lymphocytes T CD4+, qui sont la cible majeure de ce virus [1, 2] (→).
(→) Voir la Synthèse de M. Duc Dodon et al., m/s n° 4, avril 2010, page 391
Le HTLV-1 est également responsable de maladies inflammatoires, dont la plus étudiée est une myéloneuropathie, la paraparésie spastique tropicale. On considère qu’environ 10 millions de personnes sont infectées par le HTLV-1 dans le monde, avec de fortes zones endémiques, comme l’Afrique sub-saharienne, le Japon et l’Asie du Sud-Est, l’Amérique du Sud et les Caraïbes. En France, les principales zones d’endémie sont situées aux Antilles et en Guyane, avec une prévalence de l’ordre de 2 % à 3 % [3, 4]. Il faut souligner que la majorité (plus de 90 %) des sujets infectés par le HTLV-1 ne vont présenter aucun symptôme leur vie durant. Ces sujets asymptomatiques peuvent néanmoins transmettre le virus, la transmission pouvant se faire lors de l’allaitement ou par voies sexuelle et sanguine, ce qui justifie le dépistage du virus dans les dons de sang depuis 1991.
Les acteurs de la transcription virale : Tax et le LTR5’
Le génome intégré du HTLV-1 (ou provirus) est constitué de gènes qui sont communs aux rétrovirus, codant les protéines de structure et les enzymes virales. Il comporte également une région nommée pX, absente des rétrovirus simples, qui possède différents cadres de lecture conduisant à la synthèse de protéines dites auxiliaires et régulatrices. Le génome est encadré par deux régions non codantes, les séquences terminales répétées (LTR pour long terminal repeat), en positions 5’ et 3’ (Figure 1). La protéine régulatrice Tax (transactivator of pX) joue un rôle clé dans la régulation de la transcription virale contrôlée par le LTR en position 5’ (LTR5’), ou transcription sens. Il existe également chez le HTLV-1 une transcription antisens, qui ne sera pas abordée ici (voir pour revue [2]).
 |
Figure 1. Représentation du génome intégré du HTLV-1. Le génome viral intégré dans le génome de la cellule infectée (provirus), d’une taille de 9 034 paires de bases (pb) et encadré par les deux longues répétitions terminales (ou LTR, pour long terminal repeat) est représenté en respectant l’échelle de ses différents composants. Le génome est transcrit à partir du brin sens, sous le contrôle du LTR5’ et à partir du brin antisens, sous le contrôle du LTR3’. Il code les protéines classiquement exprimées par les rétrovirus : les protéines de structure et les enzymes (Gag, Pol, Env, en bleu), mais également les protéines dites auxiliaires, dont la caractéristique est d’être nécessaires lors de l’infection in vivo mais pas pour la réplication in vitro (p30/p13, p12, p8, HBZ, en mauve), ainsi que les protéines régulatrices, dont la caractéristique est d’être nécessaires à la fois in vivo et in vitro (Rex, Tax, en orange). Les transcrits sens ou antisens sont soit non épissés (Gag/Pol, usHBZ) soit mono- (Env, sHBZ) ou bi- (p30/p13, p12/p8, Tax, Rex) épissés. Les positions des cadres ouverts de lecture et du codon d’initiation de la traduction (ATG) sont indiquées en rouge et celles des sites donneurs (SD) et accepteurs d’épissage (SA) en bleu clair et vert, respectivement. An : site de polyadénylation des transcrits. |
Tax est une protéine de 353 acides aminés dont la séquence a permis de définir différents domaines qui modulent sa distribution intracellulaire et permettent le recrutement de nombreuses protéines cellulaires (Figure 2A). Tax se localise notamment au niveau de l’appareil de Golgi et dans la région du centrosome proche de ce dernier, et se concentre sous formes de corps denses dans le noyau [5]. Ces deux localisations sont liées à la présence sur la protéine de différentes modifications post-traductionnelles, telles que la phosphorylation (pour le noyau), l’ubiquitinylation (pour la localisation dans l’appareil de Golgi/centrosome), ainsi que la SUMOylation et l’acétylation (pour les corps nucléaires) (voir pour revue [6]). Bien que nécessaires pour les différentes localisations de Tax dans la cellule, aucune de ces modifications ne semble importante pour l’activation du promoteur viral, interrogeant le lien entre transactivation du LTR et la localisation de Tax dans le noyau et les corps nucléaires [7, 8]. La phosphorylation, l’ubiquitinylation [9, 10] mais également l’umrylation1 [11] et l’acétylation [7] de Tax sont en revanche requises pour l’activation de voies de signalisation intracellulaires, notamment la voie NF-kB (nuclear factor-kappa B) [6]. En effet, outre son rôle de transactivateur viral, Tax est une oncoprotéine qui dérégule différents processus cellulaires (prolifération, apoptose, réparation de l’ADN, entre autres) et qui cible de nombreuses enzymes et protéines de signalisation cellulaires, et possède le pouvoir d’immortaliser les lymphocytes T in vitro comme in vivo [12].
La cible de Tax sur le génome viral est le promoteur situé en 5’ au niveau de la séquence terminale répétée (LTR5’) qui est subdivisée en trois régions : U3, R et U5 (Figure 2B). Le site de démarrage de la transcription (TSS pour transcription start site) étant positionné à la jonction entre les régions U3 et R, la région U3 est considérée comme le promoteur viral. U3 contient en effet des éléments de réponse à Tax (Tax responsive element, TRE) situés en amont de la séquence consensus de la boîte TATA (Figure 2B). L’élément principal de réponse à Tax (TRE de type 1 ou TRE-1) est formé de trois répétitions de 21 paires de bases (pb) dénommées, selon leur position par rapport au TSS, proximale, centrale et distale. La transactivation du promoteur, via le TRE-1, dépend du recrutement du facteur de transcription CREB (cAMP response element-binding protein) [13]. Chaque répétition de 21 pb contient trois domaines (A, B et C), dont l’un, le domaine B, possède une séquence très proche de la séquence CRE (CREB responsive element), l’élément de réponse aux facteurs de transcription de la famille ATF/CREB (Figure 2B) [14]. Le domaine B a ainsi été dénommé vCRE pour « viral CRE ». Les domaines A et C correspondent, quant à eux, à des séquences riches en GC sur lesquelles Tax peut se fixer directement, augmentant ainsi l’affinité entre CREB et l’ADN. La région U3 contient d’autres éléments de réponse, en particulier des séquences de liaison aux facteurs de transcription Ets (E twenty-six) et Sp1 (specific protein 1), localisées dans une région dénommée TRE de type 2 (TRE-2). Des sites de liaison accessoires pour Sp1 sont également présents dans les régions R et U5 (Figure 2B).
 |
Figure 2. Les acteurs de la transcription, Tax et le LTR5’. A. Partie haute : représentation de la protéine Tax montrant ses différents domaines structuraux (dimérisation, leucine zipper), régulant son import nucléaire (NLS) ou son export nucléaire (NES), la formation de corps nucléaires (TSLS, Tax speckles localization signal), NLS et NES, le recrutement de partenaires cellulaires (PBM, PDZ-binding motif). Partie basse : les modifications post-traductionnelles de Tax et leurs positions dans la séquence : K (lysine), S (sérine), T (thréonine). B.Schéma du LTR5’ indiquant les régions U3, R et U5. Le début de transcription (+1, TSS) se situe à la jonction des régions U3 et R. La région U3 contient la boîte TATA et, en amont, les régions promotrices comprenant les éléments de réponse à Tax de type 1 (TRE-1) et de type 2 (TRE-2). Le TRE-1 est constitué de trois séquences de 21 paires de bases (pb) situées, par rapport au TSS, à -84 (proximal), -183 (central) et -215 pb, incluant un motif de six pb homologue au site de liaison du facteur de transcription CREB (domaine B/vCRE). Les domaines adjacents A et C sont reconnus par Tax et permettent la stabilisation des complexes Tax/CREB sur les domaines vCRE. Le TRE-2 permet le recrutement de facteurs de transcription cellulaires intervenant dans l’activation basale et la transactivation par Tax. Le LTR contient également six sites de fixation au facteur de transcription Sp1, qui influencent de façon positive ou négative la transactivation par Tax, les deux sites Sp1 de la région U5 intervenant en outre dans le contrôle de la transcription virale antisens. |
Tax n’étant pas incorporée dans les particules virales lors de leur formation, elle est donc absente de la cellule infectée au moment de la phase d’infection des cellules par le HTLV-1. Dans cette configuration, la transcription du génome viral intégré dépend alors uniquement de facteurs de transcription cellulaires. Cette transcription basale permet néanmoins une synthèse des transcrits viraux suffisante pour que Tax soit produite à faible niveau dans la cellule. C’est lorsque la quantité de Tax atteint un seuil adéquat que l’activation en trans (transactivation) du promoteur viral se met en place. Tax contrôle alors sa propre production ainsi que celles de tous les produits viraux sens, par la mise en place d’une boucle d’amplification liée à son action sur le LTR5’.
Tax tire les ficelles de la transcription virale !
L’expression des gènes est un mécanisme complexe et très finement régulé. La position du gène, qui influence le statut ouvert ou fermé de la chromatine, module le niveau de son expression. Différents complexes protéiques, capables de modifier localement l’architecture de la chromatine, coopèrent également avec les facteurs de transcription et leurs co-facteurs (protéines connectant le facteur de transcription au complexe ARNpolII [ARN polymérase II]). Finalement, la machinerie de transcription par l’ARNpolII fait intervenir successivement des complexes de facteurs généraux de transcription (GTF pour general transcription factor) : TFIID, TFIIA et TFIIB (pour la création de la bulle de transcription) ; TFIIE, TFIIF et TFIIH (pour l’ouverture du promoteur, l’échappement de l’ARNpolII, et la phosphorylation de la sérine 2 du domaine C-terminal de l’ARNpolII) ; et P-TEFb (pour la sortie de pause, la phosphorylation de la sérine 5 du domaine C-terminal de l’ARNpolII, et l’élongation) (voir la revue [15]).
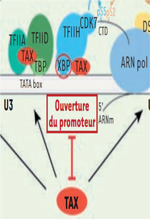
Nous décrivons dans cette partie de la revue ces différentes séquences lorsque Tax est présente dans la cellule, ainsi que les différents acteurs ciblés par Tax au cours du processus de transcription virale (Figure 3).
 |
Figure 3. Figure 3. Tax tire les ficelles de la transcription virale. Sont représentées les différentes étapes du processus de transcription (en haut) et les facteurs de transcription cellulaires impliqués, ainsi que les partenaires recrutés par Tax à chaque étape (en bas). L’étape d’ouverture du promoteur impliquant le recrutement récemment décrit de la sous-unité XPB de TFIIH par Tax est illustrée. |
Levée de la répression
Les génomes des rétrovirus endogènes, comme ceux des rétrovirus exogènes, sont la cible de répressions épigénétiques mises en place par la cellule hôte. En retour, ces virus ont développé des stratégies pour bloquer ces répressions. Ainsi, l’infection par le HTLV-1, ou l’expression seule de Tax, est associée à une diminution du taux d’histones dans les lymphocytes T, augmentant ainsi le niveau de transcription des cellules, dont la transcription virale [16]. En l’absence de Tax, le complexe de remodelage de la chromatine à action répressive, SWI/SNF (switch/sucrose non-fermentable), est présent sur le promoteur viral. Mais Tax, en interagissant avec les sous-unités BAF-53, BAF-57 et BAF-155 de ce complexe, est capable de les exclure, déplaçant les nucléosomes hors du promoteur viral [17]. Le promoteur viral est également recouvert, en l’absence de Tax, par des histones déacétylases (HDAC 1/2/3), des protéines répressives qui éliminent certaines marques activatrices des gènes. Tax interagit directement avec ces HDAC et les dissocie du promoteur [18]. Tax interagit également avec la méthyltransférase CARM1 (coactivator-associated arginine methyltransferase 1), qui catalyse la méthylation de l’arginine 2 de l’histone H3 (H3R2me3) [19]. Ces mécanismes augmentent l’accessibilité du promoteur aux cofacteurs de l’ARNPolII, et donc l’efficacité de la transactivation.
L’hyperméthylation de l’ADN joue un rôle dans le contrôle de l’expression du HTLV-1. Le LTR5’ comporte en effet plusieurs îlots CpG qui sont les cibles de la méthylation, qui représente une marque répressive [20]. Tax est néanmoins capable de transactiver partiellement un promoteur hyperméthylé, ce qui suggère un mécanisme particulier de contournement de cette répression. L’interaction de Tax avec la protéine MBD2 (methyl-CpG-binding domain protein 2), qui se lie aux îlots CpG méthylés, pourrait expliquer la capacité de Tax à transactiver un promoteur méthylé [21].
Transactivation du promoteur viral
L’évènement qui permet de déclencher l’amplification de la transcription virale par Tax est le recrutement de CREB au niveau des domaines vCRE du génome viral. Tax forme un complexe avec CREB et avec différents autres membres de la même famille (CREM, CREB-2, ATF-1, etc.), qui sont donc détectés au niveau du promoteur viral [13]. Sous la forme de dimères, Tax facilite la dimérisation de CREB, ce qui augmente l’affinité du complexe Tax/CREB pour les vCRE. La stabilisation qui découle de cette affinité accrue implique en outre le contact entre le complexe Tax/CREB et les régions riches en GC localisées de part et d’autre des vCRE (Figure 2B) [22]. Dans le cas de promoteurs cellulaires, la phosphorylation de la sérine 133 de CREB (pCREB) est nécessaire au recrutement des HAT (acétyltransférases des histones) CBP (CREB-binding protein) et p300, l’acétylation de ces histones représentant une marque d’activation transcriptionnelle. Tax augmente la phosphorylation de CREB, imitant ainsi l’effet de l’activation de la voie de l’AMP cyclique [23], et favorise également sa O-GlcNacylation (O-linked-N-acetylglucosaminylation), une modification post-traductionnelle, activatrice (comme dans le cas présent) ou inhibitrice, correspondant à l’ajout de N-acétylglucosamine sur les résidus sérine ou thréonine des protéines [24] (→).
(→) Voir la Nouvelle de C. Pique et T. Issad, m/s n° 2, février 2018, page 120
En interagissant directement avec CBP et p300, Tax permet la formation d’un pont entre vCRE, pCREB, et CBP/p300 [25]. Tax recrute de plus la protéine P/CAF (p300/CBP-associated factor) [26] et les protéines TORC (transducers of regulated CREB) qui facilitent l’activation de la transcription par CREB [27]. Au final, le complexe pCREB/Tax/co-activateurs induit l’exclusion des nucléosomes au niveau du promoteur, favorisant ainsi l’accessibilité des complexes de transcription sur le promoteur [28].
Formation du complexe de pré-initiation sur le promoteur viral
Au niveau des éléments TRE du LTR du HTLV-1, la transcription a pu être reconstituée in vitro en utilisant les facteurs TFIIA, TFIID, TFIIE et TFIIF et l’ARNPolII purifiés [29]. Il a ensuite été démontré que Tax recrutait directement TFIIA [30] et TFIID, via deux de ses sous-unités, TBP (TATA-box binding protein) et hTAFII28 (human TBP-associated factor 28) [31]. Ces interactions multiples permettent de former un complexe stable au niveau de la boîte TATA du promoteur viral. TFIIH est le dernier facteur recruté dans le complexe de pré-initiation, et est constitué de dix sous-unités réparties en trois modules [32]. Le second module, formé de l’hélicase/translocase XPB (Xeroderma Pigmentosum complementation group B), qui possède une activité hélicase/translocase ATP-dépendante (3’-5’), et de la kinase CDK7 (cyclin-dependent kinase 7), est nécessaire à la transcription. TFIIH participe à l’étape d’ouverture du promoteur (via XPB) et à l’étape d’échappement de l’ARNPolII (via CDK7). Étonnamment, l’implication de TFIIH dans la transcription du HTLV-1 n’a été que peu étudiée. Une étude ayant suggéré que Tax n’interagissait pas avec CDK7 [33], nous nous sommes intéressés à l’autre sous-unité du second module de TFIIH, XPB. Nous avons pu démontrer que Tax interagissait directement avec XPB, permettait son recrutement au niveau de la région U3 du LTR, et que la dégradation de XPB réduisait la production des transcrits viraux par des lymphocytes T transformés par le HTLV-1 [34]. TFIIH, via sa sous-unité XPB, fait donc également partie des facteurs généraux de transcription détournés par Tax pour amplifier la production des transcrits viraux.
Élongation de l’ARNm viral
Lorsque le complexe de pré-initiation est en place, l’ARNpolII peut débuter la transcription. Cependant, celle-ci arrête ensuite sa progression, après quelques dizaines de nucléotides (pause). L’étape suivante implique donc la sortie de cette pause, puis la mise en place du processus de l’élongation [35] (→).
(→) Voir la Synthèse de A. Furlan et al., m/s n° 8-9, août-septembre 2018, page 685
Ces étapes sont prises en charge par le complexe P-TEFb (positive transcription elongation factor b) formé de la kinase CDK9 et de la protéine cycline T1. Tax interagit directement avec CDK9 et avec la cycline T1, et permet ainsi le recrutement de P-TEFb au niveau du promoteur viral [33, 36]. Tax est néanmoins également capable de bloquer l’élongation de la transcription. Sa présence dans le complexe P-TEFb induit en effet l’autophosphorylation de CDK9, inhibant son activité kinase et la phosphorylation du domaine C-terminal de l’ARNPolII [33]. Tax participe ainsi à la temporisation mise en place entre les étapes de pré-initiation et d’élongation. Cette temporisation est considérée comme une phase de régulation importante, permettant de synchroniser et de contrôler l’amplitude de la synthèse de transcrits en réponse à différents stimulus activateurs [37].
Phases post-transcription
Le transcrit primaire, produit à partir du LTR5’, se termine au niveau du site de polyadénylation (An) localisé dans la région U5 du LTR3’ (Figure 1). Le transcrit viral ainsi produit est utilisé pour la traduction des polyprotéines virales Gag et Pol. Les autres protéines virales sont traduites à partir de cet ARNm, après mono- ou bi-épissage2. La balance entre la production des ARNm viraux doublement épissés et ceux mono- ou non épissés, est régulée par la protéine virale Rex qui assure l’exportation des transcrits viraux vers le cytoplasme de la cellule. Lors des premiers évènements de transcription du provirus, le niveau de Rex est faible, le transcrit primaire reste donc dans le noyau où les complexes d’épissage le transforment en transcrits doublement épissés, dont celui traduit en protéines Tax et Rex (Figure 1). Lorsque le taux de Rex augmente, une partie des transcrits est exportée dans le cytoplasme (échappant ainsi aux complexes d’épissage) pour produire les transcrits viraux simplement épissés ou non épissés. À l’inverse de Rex, la protéine virale p30 est à l’origine de la rétention nucléaire des transcrits viraux [38]. Aucune donnée n’est disponible concernant l’effet de Tax sur l’épissage des transcrits viraux, mais cette protéine joue néanmoins un rôle important en régulant le niveau des protéines virales Rex et p30, selon l’état d’activation du LTR5’. Notons, ici, la capacité de Tax à interférer avec le processus de dégradation des ARNm (nonsense-mediated mRNA decay pathway) en recrutant des acteurs de cette voie, un mécanisme ciblant les transcrits du HTLV-1 mais aussi les transcrits cellulaires [39].
Conclusion
L’ensemble des données que nous avons exposées dans cette revue montre que Tax peut recruter sur le promoteur viral non seulement des facteurs de transcription spécifiques sous la forme de complexes avec leurs cofacteurs, mais qu’elle contrôle également les étapes ultérieures du processus de transcription, en recrutant successivement au moins une sous-unité de chaque complexe de facteurs généraux de transcription (GTF) agissant avec l’ARNPolII. Tax n’agit donc pas comme un facteur de transcription dont la fonction est de se fixer sur des sites précis de l’ADN, mais plutôt comme un « super » activateur de l’ARNpolII. Cela révèle la remarquable capacité de Tax à exploiter la cellule, en interagissant avec des enzymes et des effecteurs cellulaires.
HTLV-1 n’est pas le seul virus à cibler l’hélicase/translocase XPB pour faciliter sa transcription. C’est également le cas du virus d’Epstein-Barr (EBV) et du virus de l’immunodéficience humaine de type 1 (VIH-1). Dans le cas de l’EBV, XPB est nécessaire à l’activation des promoteurs de la phase lytique du virus par la protéine virale SM [40]. Dans le cas du VIH-1, XPB est recrutée par le transactivateur Tat et son absence bloque l’activation du LTR5’ [41]. Tat et Tax recrutent donc toutes deux XPB. Elles interagissent également avec pTEF-b mais, contrairement à Tat, Tax est également capable de recruter d’abord TFIIA et TFIID sur le promoteur. XPB est donc une cible importante des virus. Cela peut être rapproché du fait que TFIIH est particulièrement important dans le cas de transcriptions induites par des cytokines [42] ou dans le cas de la transcription du HTLV-1 ou du VIH-1, induite par un transactivateur viral.
En manipulant chacune des étapes du processus de transcription virale, Tax contrôle sa propre production mais également la capacité du HTLV-1 à reprogrammer le lymphocyte T infecté vers un processus d’immortalisation. Ces activités oncogéniques font appel aux recrutements par Tax de nombreuses protéines cellulaires, une capacité démultipliée par ses modifications post-traductionnelles. L’étude du HTLV-1, et de Tax en particulier, représente donc un domaine de recherche intéressant, non seulement pour les aspects virologiques, mais également pour la compréhension des voies responsables de la prolifération et de la transformation cellulaires.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Les ARN messagers (ARNm) peuvent être produits à partir de gènes présentant uniquement des séquences codantes (exons) mais également à partir de gènes présentant une succession de séquences codantes et non codantes (exons et introns). L’épissage est le mécanisme biologique par lequel les introns sont excisés de l’ARNm pour ne garder que les parties codantes. Dans le cas du HTLV-1, l’épissage génère des transcrits dans lesquels soit un intron (mono-épissage) soit deux introns (double épissage) sont retirés.
Références
- Iwanaga M. Epidemiology of HTLV-1 Infection and ATL in Japan: An Update. Front Microbiol 2020; 11 : 1124. [CrossRef] [PubMed] [Google Scholar]
- Duc Dodon M, Mesnard JM, Barbeau B. Leucémies T induites par HTLV-1 - Y a-t-il un avant et un après HBZ ? Med Sci (Paris) 2010; 26 : 391–6. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Ramassamy JL, Tortevoye P, Ntab B, et al. Adult T-cell leukemia/lymphoma incidence rate in French Guiana: a prospective cohort of women infected with HTLV-1. Blood Adv 2020; 4 : 2044–8. [CrossRef] [PubMed] [Google Scholar]
- Gessain A, Cassar O. Epidemiological Aspects and World Distribution of HTLV-1 Infection. Front Microbiol 2012 ; 3 : 388. [CrossRef] [PubMed] [Google Scholar]
- Kfoury Y, Nasr R, Journo C, et al. The multifaceted oncoprotein Tax: subcellular localization, posttranslational modifications, and NF-kappaB activation. Adv Cancer Res 2012 ; 113 : 85–120. [CrossRef] [PubMed] [Google Scholar]
- Shirinian M, Kfoury Y, Dassouki Z, et al. Tax-1 and Tax-2 similarities and differences: focus on post-translational modifications and NF-kappaB activation. Front Microbiol 2013 ; 4 : 231–244. [CrossRef] [PubMed] [Google Scholar]
- Lodewick J, Sampaio C, Boxus M, et al. Acetylation at lysine 346 controls the transforming activity of the HTLV-1 Tax oncoprotein in the Rat-1 fibroblast model. Retrovirology 2013 ; 10 : 75. [CrossRef] [PubMed] [Google Scholar]
- Nasr R, Chiari E, El-Sabban M, et al. Tax ubiquitylation and sumoylation control critical cytoplasmic and nuclear steps of NF-kappaB activation. Blood 2006 ; 107 : 4021–4029. [CrossRef] [PubMed] [Google Scholar]
- Bonnet A, Randrianarison-Huetz V, Nzounza P, et al. Low nuclear body formation and tax SUMOylation do not prevent NF-kappaB promoter activation. Retrovirology 2012 ; 9 : 77. [CrossRef] [PubMed] [Google Scholar]
- Pene S, Waast L, Bonnet A, et al. A non-SUMOylated tax protein is still functional for NF-kappaB pathway activation. J Virol 2014 ; 88 : 10655–10661. [CrossRef] [PubMed] [Google Scholar]
- Hleihel R, Khoshnood B, Dacklin I, et al. The HTLV-1 oncoprotein Tax is modified by the ubiquitin related modifier 1 (Urm1). Retrovirology 2018 ; 15 : 33. [CrossRef] [PubMed] [Google Scholar]
- Mohanty S, Harhaj EW. Mechanisms of Oncogenesis by HTLV-1 Tax. Pathogens 2020; 9 : 543. [CrossRef] [Google Scholar]
- Lemasson I, Polakowski NJ, Laybourn PJ, et al. Transcription regulatory complexes bind the human T-cell leukemia virus 5’ and 3’ long terminal repeats to control gene expression. Mol Cell Biol 2004 ; 24 : 6117–6126. [CrossRef] [PubMed] [Google Scholar]
- Yin MJ, Paulssen E, Gaynor RB. cAMP-response element-binding protein induces directed DNA bending of the HTLV-I 21-base pair repeat. J Biol Chem 1996 ; 271 : 4781–4790. [CrossRef] [PubMed] [Google Scholar]
- Greber BJ, Nogales E. The Structures of Eukaryotic Transcription Pre-initiation Complexes and Their Functional Implications. Subcell Biochem 2019 ; 93 : 143–192. [CrossRef] [PubMed] [Google Scholar]
- Bogenberge JM, Laybourn PJ. Human T Lymphotropic Virus Type 1 protein Tax reduces histone levels. Retrovirology 2008 ; 5 : 9. [CrossRef] [PubMed] [Google Scholar]
- Wu K, Bottazzi ME, de la Fuente C, et al. Protein profile of tax-associated complexes. J Biol Chem 2004 ; 279 : 495–508. [CrossRef] [PubMed] [Google Scholar]
- Lu H, Pise-Masison CA, Linton R, et al. Tax relieves transcriptional repression by promoting histone deacetylase 1 release from the human T-cell leukemia virus type 1 long terminal repeat. J Virol 2004 ; 78 : 6735–6743. [CrossRef] [PubMed] [Google Scholar]
- Jeong SJ, Lu H, Cho WK, et al. Coactivator-associated arginine methyltransferase 1 enhances transcriptional activity of the human T-cell lymphotropic virus type 1 long terminal repeat through direct interaction with Tax. J Virol 2006 ; 80 : 10036–10044. [CrossRef] [PubMed] [Google Scholar]
- Taniguchi Y, Nosaka K, Yasunaga J, et al. Silencing of human T-cell leukemia virus type I gene transcription by epigenetic mechanisms. Retrovirology 2005 ; 2 : 64. [CrossRef] [PubMed] [Google Scholar]
- Ego T, Tanaka Y, Shimotohno K. Interaction of HTLV-1 Tax and methyl-CpG-binding domain 2 positively regulates the gene expression from the hypermethylated LTR. Oncogene 2005 ; 24 : 1914–1923. [CrossRef] [PubMed] [Google Scholar]
- Lenzmeier BA, Baird EE, Dervan PB, et al. The tax protein-DNA interaction is essential for HTLV-I transactivation in vitro. J Mol Biol 1999 ; 291 : 731–744. [CrossRef] [PubMed] [Google Scholar]
- Kim YM, Ramirez JA, Mick JE, et al. Molecular characterization of the Tax-containing HTLV-1 enhancer complex reveals a prominent role for CREB phosphorylation in Tax transactivation. J Biol Chem 2007 ; 282 : 18750–18757. [CrossRef] [PubMed] [Google Scholar]
- Pique C, Issad T. Tax : une oncoprotéine virale qui aime les CREB sucrés !. Med Sci (Paris) 2018 ; 34 : 120–122. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Nyborg JK, Egan D, Sharma N. The HTLV-1 Tax protein: revealing mechanisms of transcriptional activation through histone acetylation and nucleosome disassembly. Biochim Biophys Acta 2010 ; 1799 : 266–274. [CrossRef] [PubMed] [Google Scholar]
- Jiang H, Lu H, Schiltz RL, et al. PCAF interacts with tax and stimulates tax transactivation in a histone acetyltransferase-independent manner. Mol Cell Biol 1999 ; 19 : 8136–8145. [CrossRef] [PubMed] [Google Scholar]
- Siu YT, Chin KT, Siu KL, et al. TORC1 and TORC2 coactivators are required for tax activation of the human T-cell leukemia virus type 1 long terminal repeats. J Virol 2006 ; 80 : 7052–7059. [CrossRef] [PubMed] [Google Scholar]
- Sharma N, Nyborg JK. The coactivators CBP/p300 and the histone chaperone NAP1 promote transcription-independent nucleosome eviction at the HTLV-1 promoter. Proc Natl Acad Sci U S A 2008 ; 105 : 7959–7963. [CrossRef] [PubMed] [Google Scholar]
- Duvall JF, Kashanchi F, Cvekl A, et al. Transactivation of the human T-cell lymphotropic virus type 1 Tax1-responsive 21-base-pair repeats requires Holo-TFIID and TFIIA. J Virol 1995 ; 69 : 5077–5086. [CrossRef] [PubMed] [Google Scholar]
- Clemens KE, Piras G, Radonovich MF, et al. Interaction of the human T-cell lymphotropic virus type 1 tax transactivator with transcription factor IIA. Mol Cell Biol 1996 ; 16 : 4656–4664. [CrossRef] [PubMed] [Google Scholar]
- Caron C, Mengus G, Dubrowskaya V, et al. Human TAF(II)28 interacts with the human T cell leukemia virus type I Tax transactivator and promotes its transcriptional activity. Proc Natl Acad Sci U S A 1997 : 3662–3667. [CrossRef] [PubMed] [Google Scholar]
- Rimel JK, Taatjes DJ. The essential and multifunctional TFIIH complex. Protein Sci 2018 ; 27 : 1018–1037. [CrossRef] [PubMed] [Google Scholar]
- Zhou M, Lu H, Park H, et al. Tax interacts with P-TEFb in a novel manner to stimulate human T-lymphotropic virus type 1 transcription. J Virol 2006 ; 80 : 4781–4791. [CrossRef] [PubMed] [Google Scholar]
- Martella C, Tollenaere AI, Waast L, et al. Human T-Cell Lymphotropic Virus Type 1 Transactivator Tax Exploits the XPB Subunit of TFIIH during Viral Transcription. J Virol 2020; 94 :e02171–19. [CrossRef] [PubMed] [Google Scholar]
- Furlan A, Agbazahou F, Henry M, et al. P-TEFb et Brd4: Acteurs de la levée de pause transcriptionnelle, possibles cibles thérapeutiques. Med Sci (Paris) 2018 ; 34 : 685–692. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Cho WK, Jang MK, Huang K, et al. Human T-lymphotropic virus type 1 Tax protein complexes with P-TEFb and competes for Brd4 and 7SK snRNP/HEXIM1 binding. J Virol 2010 ; 84 : 12801–12809. [CrossRef] [PubMed] [Google Scholar]
- Liu X, Kraus WL, Bai B. Ready, pause, go: regulation of RNA polymerase II pausing and release by cellular signaling pathways. Trends Biochem Sci 2015 ; 40 : 516–525. [CrossRef] [PubMed] [Google Scholar]
- Baydoun HH, Bellon M, Nicot C. HTLV-1 Yin and Yang: Rex and p30 master regulators of viral mRNA trafficking. AIDS Rev 2008 ; 10 : 195–204. [PubMed] [Google Scholar]
- Fiorini F, Robin JP, Kanaan J, et al. HTLV-1 Tax plugs and freezes UPF1 helicase leading to nonsense-mediated mRNA decay inhibition. Nat Commun 2018 ; 9 : 431. [CrossRef] [PubMed] [Google Scholar]
- Verma D, Church TM, Swaminathan S. Epstein-Barr virus co-opts TFIIH component XPB to specifically activate essential viral lytic promoters. Proc Natl Acad Sci U S A 2020; 117 : 13044–55. [CrossRef] [PubMed] [Google Scholar]
- Lacombe B, Morel M, Margottin-Goguet F, et al. Specific Inhibition of HIV Infection by the Action of Spironolactone in T Cells. J Virol 2016 ; 90 : 10972–10980. [CrossRef] [PubMed] [Google Scholar]
- Kouzine F, Wojtowicz D, Yamane A, et al. Global regulation of promoter melting in naive lymphocytes. Cell 2013 ; 153 : 988–999. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Représentation du génome intégré du HTLV-1. Le génome viral intégré dans le génome de la cellule infectée (provirus), d’une taille de 9 034 paires de bases (pb) et encadré par les deux longues répétitions terminales (ou LTR, pour long terminal repeat) est représenté en respectant l’échelle de ses différents composants. Le génome est transcrit à partir du brin sens, sous le contrôle du LTR5’ et à partir du brin antisens, sous le contrôle du LTR3’. Il code les protéines classiquement exprimées par les rétrovirus : les protéines de structure et les enzymes (Gag, Pol, Env, en bleu), mais également les protéines dites auxiliaires, dont la caractéristique est d’être nécessaires lors de l’infection in vivo mais pas pour la réplication in vitro (p30/p13, p12, p8, HBZ, en mauve), ainsi que les protéines régulatrices, dont la caractéristique est d’être nécessaires à la fois in vivo et in vitro (Rex, Tax, en orange). Les transcrits sens ou antisens sont soit non épissés (Gag/Pol, usHBZ) soit mono- (Env, sHBZ) ou bi- (p30/p13, p12/p8, Tax, Rex) épissés. Les positions des cadres ouverts de lecture et du codon d’initiation de la traduction (ATG) sont indiquées en rouge et celles des sites donneurs (SD) et accepteurs d’épissage (SA) en bleu clair et vert, respectivement. An : site de polyadénylation des transcrits. |
| Dans le texte | |
 |
Figure 2. Les acteurs de la transcription, Tax et le LTR5’. A. Partie haute : représentation de la protéine Tax montrant ses différents domaines structuraux (dimérisation, leucine zipper), régulant son import nucléaire (NLS) ou son export nucléaire (NES), la formation de corps nucléaires (TSLS, Tax speckles localization signal), NLS et NES, le recrutement de partenaires cellulaires (PBM, PDZ-binding motif). Partie basse : les modifications post-traductionnelles de Tax et leurs positions dans la séquence : K (lysine), S (sérine), T (thréonine). B.Schéma du LTR5’ indiquant les régions U3, R et U5. Le début de transcription (+1, TSS) se situe à la jonction des régions U3 et R. La région U3 contient la boîte TATA et, en amont, les régions promotrices comprenant les éléments de réponse à Tax de type 1 (TRE-1) et de type 2 (TRE-2). Le TRE-1 est constitué de trois séquences de 21 paires de bases (pb) situées, par rapport au TSS, à -84 (proximal), -183 (central) et -215 pb, incluant un motif de six pb homologue au site de liaison du facteur de transcription CREB (domaine B/vCRE). Les domaines adjacents A et C sont reconnus par Tax et permettent la stabilisation des complexes Tax/CREB sur les domaines vCRE. Le TRE-2 permet le recrutement de facteurs de transcription cellulaires intervenant dans l’activation basale et la transactivation par Tax. Le LTR contient également six sites de fixation au facteur de transcription Sp1, qui influencent de façon positive ou négative la transactivation par Tax, les deux sites Sp1 de la région U5 intervenant en outre dans le contrôle de la transcription virale antisens. |
| Dans le texte | |
 |
Figure 3. Figure 3. Tax tire les ficelles de la transcription virale. Sont représentées les différentes étapes du processus de transcription (en haut) et les facteurs de transcription cellulaires impliqués, ainsi que les partenaires recrutés par Tax à chaque étape (en bas). L’étape d’ouverture du promoteur impliquant le recrutement récemment décrit de la sous-unité XPB de TFIIH par Tax est illustrée. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




