| Issue |
Med Sci (Paris)
Volume 37, Number 10, Octobre 2021
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 939 - 941 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2021157 | |
| Published online | 14 October 2021 | |
Mucoviscidose: Quand les bactéries coopèrent pour mieux régner
La recherche en microbiologie vue par les étudiants de l’ENS de Lyon
Bacteria in cystic fibrosis: United they stand
Recent advances in microbiology research through the eyes of ENS students
1
École normale supérieure de Lyon, Département de biologie, Master Biosciences, Lyon, France
2
ETH Zurich, Institute of Food, Nutrition and Health, Zurich, Suisse
a romane.dorado-doncel@ens-lyon.fr
b phileas.larcher@ens-lyon.fr
c celine.schmitter@ens-lyon.fr
d sarah.zouaghi@ens-lyon.fr
Le dossier que nous présentons a été rédigé par les étudiantes et étudiants de Master 1 de Biologie de l’École Normale Supérieure de Lyon à l’issue de l’UE Microbiologie Moléculaire et Structurale (2020-2021).
Le Master de Biologie de l’ENS de Lyon accueille chaque année environ 40 étudiants en M1 et en M2 et propose une formation de haut niveau à la recherche en biosciences. Chaque étudiant y construit son parcours à la carte, en choisissant ses options parmi un large panel de modules, favorisant ainsi une approche pluridisciplinaire des sciences du vivant, et cela en relation étroite avec les laboratoires de recherche du tissu local, national et international.
En participant à diverses activités scientifiques liées aux UE de leur formation, les étudiants préparent également l’obtention du Diplôme de l’ENS de Lyon, qui valide leur scolarité à l’ENS. La rédaction du présent dossier, qui vise à transmettre de façon claire les messages issus d’une sélection d’articles scientifiques publiés récemment dans le domaine de la microbiologie, constitue l’une de ces activités connexes proposées aux étudiants.
© 2021 médecine/sciences – Inserm

Contact Équipe pédagogique
Chloé Journo (maître de conférences, ENS de Lyon). Responsable de l’UE microbiologie moléculaire et structurale. Équipe oncogenèse rétrovirale, Centre international de recherche en infectiologie, Inserm U1111 - CNRS UMR5308, École normale supérieure de Lyon, Lyon, France
Amélie Joly (doctorante monitrice ENS de Lyon). Équipe génomique fonctionnelle des interactions hôte/bactéries, Institut de génomique fonctionnelle de Lyon, Université de Lyon, École normale supérieure de Lyon, CNRS UMR 5242, Université Claude Bernard Lyon 1, Lyon, France
Contact : chloe.journo@ens-lyon.fr
Série cordonnée par Sophie Sibéril (sophie.siberil@upmc.fr)
La mucoviscidose est une maladie génétique caractérisée par un épaississement des sécrétions de divers organes (dont le foie, le pancréas, ou les poumons) engendrant leur dysfonctionnement. Au niveau des voies aériennes, l’épaississement du mucus constitue une niche idéale pour la prolifération d’une multitude de micro-organismes. Cette colonisation microbienne entraîne une diminution drastique de la fonction respiratoire des patients. Les bactéries Pseudomonas aeruginosa et Staphylococcus aureus sont fréquemment portées de façon asymptomatique. Leur interaction avec l’homme est alors dite commensale car les bactéries trouvent un/des bénéfice(s) à cette interaction, comme l’accès à des nutriments, tandis que le porteur n’y trouve ni avantage ni inconvénient. En revanche, lors d’une dysbiose (déséquilibre de l’écosystème bactérien), elles peuvent devenir pathogènes et/ou aggraver certaines maladies. On sait notamment que ces deux espèces bactériennes sont les plus prévalentes chez les patients atteints de mucoviscidose. En général, l’infection par ces deux bactéries suit un certain enchaînement, commençant par une importante prédominance de S. aureus qui décroît avec l’âge du patient, au profit d’une infection à P. aeruginosa. Néanmoins, ces deux bactéries peuvent simultanément infecter le patient et entrer en phase de compétition [1]. Par la suite, d’autres souches de P. aeruginosa non compétitrices peuvent également coloniser les poumons du patient : les deux espèces bactériennes sont alors en phase de coexistence [2]. Dans cette étude [3], Briaud et al. ont cherché à identifier l’impact de P. aeruginosa sur S. aureus dans un contexte de coexistence. Ils se sont notamment concentrés sur les changements transcriptomiques chez S. aureus, et leurs conséquences sur l’antibiorésistance de S. aureus et son internalisation par les cellules de l’épithélium pulmonaire.
L’interaction spécifique avec Pseudomonas aeruginosa induit une dérégulation de l’expression de certains gènes de Staphylococcus aureus
Les auteurs se sont d’abord intéressés aux variations d’expression des gènes chez S. aureus mis en présence de souches de P. aeruginosa qui sont soit coexistantes, soit compétitrices. Ils ont ainsi identifié 77 gènes dont l’expression est modulée en situation de compétition, 140 gènes dont l’expression est modulée en situation de coexistence et 16 gènes modulés dans les deux conditions. Ces résultats ont été confirmés par quantification de l’ARN transcrit à partir de chaque gène, via des RT-PCR quantitatives, isolés à partir de souches directement prélevées chez des patients. Parmi les gènes identifiés, le gène tet38 est surexprimé chez S. aureus en présence de P. aeruginosa. Ce gène fait partie de la famille des gènes nor, qui comprend également norA, norB et norC, aussi surexprimés chez S. aureus. Ces gènes sont impliqués dans des mécanismes de résistance aux antibiotiques : la tétracycline pour tet38 [4] et la ciprofloxacine pour norA et norC [5]. Leur rôle est donc particulièrement intéressant à examiner dans un contexte clinique.
L’étape suivante fut d’identifier les mécanismes à l’origine de la modulation de l’expression des gènes nor. L’équipe de chercheurs a d’abord supposé que le gène codant MgrA, un régulateur des gènes nor, pourrait voir son expression affectée par P. aeruginosa. Cette hypothèse a cependant été réfutée, l’expression de mgrA n’étant pas modifiée lors de la cohabitation. Comme MgrA régule les gènes par phosphorylation, les auteurs ont alors supposé que sa fonction, et non son expression, pourrait être affectée par P. aeruginosa. Pour vérifier cette hypothèse, le rôle de MgrA sur la surexpression des gènes nor a été étudié en contexte de coexistence et a révélé qu’une souche S. aureus, dont le gène mgrA a été inactivé, ne surexprime ni tet38 ni norC, mais surexprime toujours norA et norB. Ainsi, MgrA est nécessaire à la régulation par P. aeruginosa de l’expression de tet38 et norC chez S. aureus. On peut donc supposer que P. aeruginosa modifie l’activité régulatrice de MgrA chez S. aureus lors de leur coexistence. Par la suite, deux hypothèses ont été envisagées pour expliquer la modulation transcriptomique observée en présence de P. aeruginosa : soit les changements d’expression génique sont induits par le contact direct avec P. aeruginosa, soit ils sont induits par un facteur soluble, produit par P. aeruginosa dans le milieu, et capable d’agir sur S. aureus. Pour tester ces hypothèses, P. aeruginosa et S. aureus ont été cocultivés soit ensemble soit en étant séparées par un filtre (auquel cas, seules les molécules solubles peuvent passer d’un compartiment à l’autre). Ces expériences ont montré qu’un contact direct est nécessaire pour induire la surexpression de tet38, norA et norC. Il est donc possible que P. aeruginosa produise une protéine transmembranaire ou un lipide membranaire spécifique, dont un récepteur présent chez S. aureus engendrerait une cascade de signalisation conduisant aux changements transcriptomiques observés chez S. aureus.
Les auteurs ont alors vérifié si cette dérégulation était spécifiquement due à P. aeruginosa ou si d’autres bactéries pouvaient influencer S. aureus de la même façon. Ils ont ainsi mesuré, par RT-PCR quantitative, le niveau d’expression de tet38, norA et norC de S. aureus après avoir cocultivé ces dernières avec d’autres bactéries fréquemment retrouvées chez des patients atteints de mucoviscidose : P. aeruginosa, Burkholderia cenocepacia ou Stenotrophomonas maltophilia [6]. Les trois gènes testés n’étant surexprimés chez S. aureus que lors de la coculture avec P. aeruginosa, la dérégulation d’expression génique est effectivement spécifique de la cohabitation avec P. aeruginosa.
Pseudomonas aeruginosa augmente l’antibiorésistance de Staphylococcus aureus ainsi que son internalisation dans les cellules épithéliales
Les gènes nor étant impliqués dans la résistance aux antibiotiques, les modifications d’expression de gènes entrainées par P. aeruginosa pourraient augmenter la résistance, et donc la survie, de S. aureus face aux antibiotiques. Pour étudier cela, la viabilité de S. aureus a été testée avec ou sans P. aeruginosa et après ajout ou non de tétracycline ou de ciprofloxacine. Les auteurs ont alors montré qu’en absence d’antibiotiques, S. aureus survivait aussi bien seul qu’en coculture. En revanche, lors d’une exposition aux antibiotiques, S. aureus ne survit qu’en coculture. La coexistence de P. aeruginosa avec S. aureus favorise donc la résistance de S. aureus aux antibiotiques. Des expériences complémentaires ont démontré que cette résistance accrue aux antibiotiques était bien dépendante de l’expression de tet38.
De précédentes études ont également démontré l’implication de tet38 dans l’internalisation de S. aureus dans les cellules épithéliales du poumon. Une telle internalisation induit la formation d’un réservoir bactérien au sein de ces cellules, ainsi qu’une potentielle augmentation de la résistance aux antibiotiques. De ce fait, les auteurs se sont intéressés à l’impact de la présence de P. aeruginosa sur le taux de cette internalisation. Ainsi, ils ont démontré que P. aeruginosa augmentait d’un facteur 3 le taux d’internalisation de S. aureus. En favorisant un réservoir bactérien intracellulaire, ce phénomène pourrait contribuer à l’aggravation de la maladie sur le long terme et aux échecs thérapeutiques récurrents [7].
Conclusion
L’étude menée par Briaud et al. permet de mieux caractériser l’influence de P. aeruginosa sur S. aureus lors de leur coexistence (Figure 1), en particulier chez des patients atteints de mucoviscidose. Dans ces conditions, l’expression de nombreux gènes est modifiée chez S. aureus, probablement à la suite d’une dérégulation de la voie MgrA. Certains gènes de la famille nor (tet38, norA et norC) sont surexprimés lors du contact spécifique avec P. aeruginosa. L’étude a par ailleurs montré une résistance accrue de S. aureus aux antibiotiques grâce à ces gènes qui codent des protéines formanat des pompes à efflux [8]. Enfin, dans ce contexte, S. aureus est également internalisé plus efficacement par les cellules épithéliales, ce qui pourrait encore renforcer sa résistance aux antibiotiques. Les auteurs suggèrent que cette internalisation accrue pourrait être liée à la capacité de la protéine Tet38 à se fixer au récepteur CD36 présent sur les cellules de l’épithélium pulmonaire.
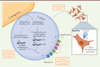 |
Figure 1. P. aeruginosa module le transcriptome, augmente l’antibiorésistance et favorise l’internalisation de S. aureus dans les cellules épithéliales pulmonaires. Les flèches en pointillé et l’encart « hypothèse » ne sont pas vérifiés expérimentalement à ce jour. |
L’ensemble de ces processus permettrait une meilleure survie de S. aureus ainsi qu’une potentielle aggravation de la maladie. Il semble effectivement qu’une cohabitation entre P. aeruginosa et S. aureus conduise à des infections plus graves qu’avec une infection à S. aureus seule. Cependant, ces résultats n’ont pu être obtenus que par des études incluant un faible effectif de patients, nécessitant donc leur confirmation par d’autres laboratoires de recherche [9].
Enfin, la survenue de cette phase de coexistence à la suite d’une phase de compétition entre les bactéries semble pouvoir provenir de diverses modifications génétiques chez les deux souches bactériennes, ainsi que de divers changements physico-chimiques au sein des poumons de personnes atteintes de mucoviscidose. Ces résultats aident ainsi à mieux comprendre d’une part la mise en place de cette cohabitation et, d’autre part, le possible impact de cette dernière sur les patients, bien que ce dernier point reste à vérifier par des études comportant de plus grandes cohortes [10].
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Michelsen CF, Christensen AMJ, Bojer MS, et al. Staphylococcus aureus alters growth activity, autolysis, and antibiotic tolerance in a human host-adapted Pseudomonas aeruginosa lineage. J Bacteriol 2014 ; 196 : 3903–3911. [PubMed] [Google Scholar]
- Frydenlund Michelsen C, Hossein Khademi SM, Krogh Johansen H, et al. Evolution of metabolic divergence in Pseudomonas aeruginosa during long-term infection facilitates a proto-cooperative interspecies interaction. ISME J 2016; 10 : 1323–36. [PubMed] [Google Scholar]
- Briaud P, Camus L, Bastien S, et al. Coexistence with Pseudomonas aeruginosa alters Staphylococcus aureus transcriptome, antibiotic resistance and internalization into epithelial cells. Sci Rep 2019 ; 9 : 16564. [PubMed] [Google Scholar]
- Truong-Bolduc QC, Dunman PM, Strahilevitz J, et al. MgrA is a multiple regulator of two new efflux pumps in Staphylococcus aureus. J Bacteriol 2005 ; 187 : 2395–2405. [PubMed] [Google Scholar]
- Truong-Bolduc QC, Strahilevitz J, Hooper DC. NorC, a new efflux pump regulated by MgrA of Staphylococcus aureus. Antimicrob Agents Chemother 2006 ; 50 : 1104–1107. [PubMed] [Google Scholar]
- Bosch A, Miñán A, Vescina C, et al. Fourier transform infrared spectroscopy for rapid identification of nonfermenting Gram-negative bacteria isolated from sputum samples from cystic fibrosis patients. J Clin Microbiol 2008 ; 46 : 2535–2546. [PubMed] [Google Scholar]
- Peyrusson F, Varet H, Nguyen TK, et al. Intracellular Staphylococcus aureus persisters upon antibiotic exposure. Nat Commun 2020; 11 : 2200. [PubMed] [Google Scholar]
- Ding Y, Onodera Y, Lee JC, et al. NorB, an efflux pump in Staphylococcus aureus strain MW2, contributes to bacterial fitness in abscesses. J Bacteriol 2008 ; 190 : 7123–7129. [PubMed] [Google Scholar]
- Briaud P, Bastien S, Camus L, et al. Impact of coexistence phenotype between Staphylococcus aureus and Pseudomonas aeruginosa isolates on clinical outcomes among cystic fibrosis patients. Front Cell Infect Microbiol 2020; 10 : 266. [PubMed] [Google Scholar]
- Camus L, Briaud P, Vandenesch F, et al. How bacterial adaptation to cystic fibrosis environment shapes interactions between Pseudomonas aeruginosa and Staphylococcus aureus. Front Microbiol 2021; 12 : 411. [Google Scholar]
Liste des figures
 |
Figure 1. P. aeruginosa module le transcriptome, augmente l’antibiorésistance et favorise l’internalisation de S. aureus dans les cellules épithéliales pulmonaires. Les flèches en pointillé et l’encart « hypothèse » ne sont pas vérifiés expérimentalement à ce jour. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




