| Issue |
Med Sci (Paris)
Volume 37, Number 1, Janvier 2021
|
|
|---|---|---|
| Page(s) | 41 - 46 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2020257 | |
| Published online | 25 January 2021 | |
Les lipides ne doivent plus être diabolisés… ni chez l’adulte, ni chez l’enfant
Lipids should not be demonized in adults and in infants
1
Laboratoire de biochimie et nutrition humaine, Institut Agro, 65 rue de Saint-Brieuc, 35042, Rennes, France
2
Inserm, INRAe, Univ Rennes, Institut NUMECAN ( nutrition metabolisms and cancer) UMR_A 1341, UMR_S 1241, 35000, Rennes, France
*
vincent.rioux@agrocampus-ouest.fr
Après une période très dogmatique, mais en partie explicable, de diabolisation des lipides, les données acquises en physiologie et en épidémiologie constituent désormais la base pour une réhabilitation de l’importance de la proportion de lipides dans l’apport énergétique, chez l’adulte et chez l’enfant. Dès 2010, les apports nutritionnels conseillés (ANC) ont initié cette nécessaire revalorisation, confirmée depuis par plusieurs études. Même si cela apparaît un peu paradoxal dans le contexte actuel de surpoids et d’obésité de la population, la bonne dose de lipides dans l’alimentation est importante à respecter, en particulier chez le jeune enfant.
Abstract
Following a long and dogmatic period, which has demonized the dietary lipids, a cautious review of the literature led the scientists to propose a new paradigm and rehabilitation for lipids. French guidelines have endorsed it since 2010, and recent data confirm this new and necessary approach, especially for infants.
© 2021 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.

Vignette (Photo © Inserm/Valet, Philippe).
La perception des lipides (« le gras ! ») a été très négative durant les cinquante dernières années, avec une diabolisation, voire de fausses informations (fake news), et des discours d’évictions drastiques. Il en a été de même avec les acides gras saturés, un sous-groupe d’acides gras. Après la remise en cause scientifique de ce dogme anti-gras et de la lipido-phobie, et tandis qu’une même vindicte caricaturale semble se tourner désormais vers les glucides, en particulier les sucres, que nous disent les données scientifiques sur l’aspect général de la part lipidique dans l’alimentation, mesurée en pourcentage énergétique ? Et qu’en est-il respectivement chez l’adulte et chez l’enfant ?
Les lipides totaux, en pourcentage de l’énergie du régime chez l’adulte
La lipido-phobie tient sans doute son origine, en partie, dans le principe d’incorporation, c’est-à-dire « je suis ce que je mange ». En effet, appliquée aux lipides, cette perception suggérait de manière simpliste que tous les bourrelets associés à nos surpoids (qui sont effectivement constitués de lipides !) provenaient de l’ingestion exclusive de lipides. Mais ce n’était pas si simple, et, très vite, il a été impossible de relier la proportion de lipides du régime alimentaire (en %) et l’obésité ou le surpoids [1] (Figure 1). Les travaux de Andrew M Prentice à la fin des années 1990 [2, 3] n’avaient en effet pas montré de relation entre fraction lipidique de l’alimentation et obésité (estimée par l’IMC1), alors que des liens existaient entre obésité et nombre de voiture par famille, ou heures passées devant la télévision… (Figure 2). Son article intitulé « Obésité : gourmandise ou paresse ? » permit ainsi de suggérer le lien entre obésité et sédentarité et de commencer à dédouaner la part de lipides contenue dans le régime alimentaire. D’autres études [4, 5] avaient confirmé l’absence d’effet de cette proportion de lipides alimentaires sur l’obésité, et certaines ont même montré une augmentation de l’obésité quand les lipides étaient diminués [6-9]. Aux États-Unis, lorsque la proportion de lipides a été réduite de 42 % (en pourcentage de l’énergie du régime) dans les années 1970, à 34 % en 2000, l’obésité a paradoxalement fortement augmenté, et ceci parallèlement à la part des glucides dans le régime [8, 10-12]. Ces corrélations inverses invitaient ainsi à dé-diaboliser qualitativement les lipides et donc, à revoir les analyses et les recommandations, en incluant également les glucides, mais surtout l’équilibre énergétique du régime global en fonction de la dépense énergétique de l’individu.
 |
Figure 1. Indice de masse corporelle (IMC) des populations de femmes adultes de plusieurs pays, en fonction de la richesse en lipides des régimes (en % d’énergie d’origine lipidique). Plusieurs sous-groupes de populations peuvent apparaître pour certains pays (d’après [1]). 1. Belgique, 2. Danemark, 3. Suisse, 4. Royaume-Uni, 5. France, 6. Islande, 7. Allemagne de l’Ouest, 8. Finlande, 9. Espagne, 10. Suède, 11. Hongrie, 12. Italie, 13. Allemagne de l’Est, 14. Tchécoslovaquie, 15. Malte, 16. Pologne, 17. Yougoslavie, 18. URSS (ensemble de données obtenues avant 1989, date de la chute du mur de Berlin). |
 |
Figure 2. Les mesures de l’obésité, de l’énergie totale ingérée, des lipides ingérés, ainsi que du temps passé devant la télévision et de la disponibilité des voitures dans les ménages, sont présentées en fonction du temps, entre 1940 et 1990, en Angleterre (d’après [2]). |
Au niveau épidémiologique, le rôle, encore controversé, des glucides a été suggéré par Chaput et al. [8]. Ses études n’ont en effet révélé aucune différence de poids ou de tour de taille entre des individus suivant un régime constitué soit de 27 %, soit de 40 % de lipides. Pour les individus les plus répondeurs à l’insuline (tertile supérieur2), une augmentation significative de leur poids et de leur tour de taille a même été observée avec un régime pauvre en lipides (27 %). Cette observation a été confirmée par Jakob Hjorth et Alexander Ludwig [13, 14] qui ont montré que les individus présentant une bonne insulino-sensibilité répondaient aussi bien aux régimes pauvres en glucides (low-carb) qu’aux régimes pauvres en lipides (low-fat), alors que les individus insulino-résistants pouvaient perdre plus de poids avec un régime pauvre en glucides et riche en lipides (Figure 3). Les paramètres biologiques associés au syndrome métabolique (glycémie, insulinémie, marqueurs lipidiques, etc.) sont également nettement plus défavorables avec les régimes pauvres en lipides. Il en est de même pour certains marqueurs de risque de maladies cardiovasculaires, comme le taux sanguin de triglycérides et le rapport cholestérol total sur HDL (high density lipoprotein)-cholestérol [15]. Ces travaux ont d’ailleurs alerté sur l’importance du sous-groupe « LDL petites et denses » des LDL (low density lipoprotein), dont le taux est particulièrement élevé dans le cas de régimes pauvres en lipides. La réduction des glucides dans le régime, plutôt que celle des lipides, semble également plus puissante pour améliorer plusieurs paramètres du syndrome métabolique [15-18], et l’étude prospective PREDIMED (PREvencion con Dieta MEDiterranea), a révélé que l’apport lipidique, en pourcentage de l’énergie du régime, était associé à un risque plus faible de maladies cardiovasculaires et de mortalité [19]. Enfin citons l’étude épidémiologique PURE (Prospective Urban Rural Epidemiology) [20], sur les habitudes alimentaires et les risques cardiovasculaires, qui montre que le plus grand risque dû à la part énergétique des lipides est, finalement, que celle-ci soit trop faible (Figure 4).
 |
Figure 3. Variation du poids moyen de volontaires en surpoids, en fonction du temps sur une durée de 24 mois : comparaison d’un régime pauvre en lipides à un régime pauvre en glucides (d’après [30]). |
 |
Figure 4. Risque relatif de mortalité totale (A et B) et de mortalité cardiovasculaire (C et D), en fonction de la part (% d’énergie d’origine lipidique) de lipides (A et C) et de glucides (B et D) (d’après [20]). |
D’autres études, portant sur les relations entre régimes et situations de surpoids, ne mettent cependant pas en évidence de lien entre glucides et obésité [21]. Dans le tissu adipeux, la part de la lipogenèse utilisant le glucose ou le fructose alimentaires est en effet faible [22] et coûteuse en énergie [23]. Dans le foie, en revanche, la lipogenèse de novo, à partir des glucides alimentaires consommés en excès, représente une contribution potentiellement non négligeable, bien que difficile à quantifier, à l’apport de triglycérides au tissu adipeux, via les VLDL (very low density lipoproteins) [24-26]. Il convient donc de ne pas incriminer qualitativement les glucides car, comme les lipides, il semble que l’excès énergétique du régime, par rapport à la dépense, reste le facteur le plus important.
En France, l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses) recommande 35 à 40 % d’énergie lipidique [27]. La consommation actuelle de lipides de la population se situant entre 34 et 38 % [28], rien ne justifie donc le rejet des lipides qui sévit encore, en termes de perception et, parfois même, en termes de recommandations de santé publique. Il reste néanmoins vrai qu’en cas de surconsommations individuelles, en « masse de lipides » ou en « masse de glucides », par rapport aux dépenses énergétiques, il est nécessaire pour l’individu de réduire son apport quantitatif de glucides mais aussi de lipides.
Même si le tissu adipeux est constitué de lipides, une part importante de ceux-ci provient également de la conversion hépatique des glucides consommés en excès (et de l’alcool !). Les travaux réalisés chez l’homme ont en effet montré une contribution élevée des glucides à la lipogenèse hépatique qui, dans ce cas, produit surtout de l’acide palmitique [24-26, 29, 30]. Cette synthèse hépatique d’acide palmitique à partir des glucides, ajoutée à son apport exogène3, explique ainsi que le taux de cet acide gras saturé dans le sang reste corrélé au risque cardiovasculaire, s’il est consommé en excès. Rappelons aussi que l’insuline, qui est induite par la consommation de glucides, est anti-lipolytique : tant que le taux d’insuline dans le sang restera élevé, les lipides ne pourront donc être utilisés par catabolisme (Figure 5).
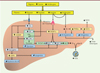 |
Figure 5. Schéma de l’évolution des paramètres plasmatiques principaux et de l’orientation du métabolisme hépatique, lors d’une baisse des glucides et d’une hausse des lipides du régime. La réorientation métabolique due à une diminution de l’insuline résulte 1) en une diminution de la glycolyse, de la lipogenèse et de la sécrétion des VLDL d’une part, et 2) en une augmentation de la lipolyse, de la b-oxydation des acides gras et de la cétogenèse d’autre part. AG : acide gras ; GLUT2 : transporteur du glucose 2 ; Glu : glucose ; GK : glucokinase ; PFK : phosphofructokinase ; L-PK : liver pyruvate kinase ; AMPK : AMP-activated proteine kinase ; ChREBP : carbohydrate response element-binding protein ; AcCoA : acétyl coenzyme A ; ACC : acétyl coenzyme A carboxylase ; FAS : fatty acid synthase ; SREBP 1c : sterol response element-binding protein 1c ; PPAR-a : peroxisome proliferator activated receptor-a ; FGF21 : fibroblast growth factor 21 ; VLDL : very low density lipoprotein ; Apo B : apolipoprotéine B. |
Chez des personnes en surpoids ou en situation d’obésité, certaines études montrent que réduire l’apport en glucides apparaît être une approche diététique utile pour perdre du poids [31, 32]. En ce qui concerne le diabète de type 2 et les maladies cardiovasculaires, les revues générales récentes indiquent également que les régimes pauvres en glucides sont plus efficaces que les régimes pauvres en lipides pour réduire le poids à court et moyen terme, particulièrement en cas de faible cétogenèse induite [11, 15, 17, 18, 20, 30, 33-37]. Néanmoins, devant certains régimes caricaturaux tels que les régimes « pauvres/riches » (high fat/low carb et high carb/low fat), il ne faudrait pas remplacer la diabolisation des lipides par celle des glucides.
Finalement, en fonction des données biochimiques et physiologiques et des données épidémiologiques de la littérature, on peut conclure : que les lipides ne doivent plus être discrédités, cela se révélant souvent contre-productif ; que le curseur entre la proportion de lipides et celle de glucides dans le régime alimentaire ne doit pas être dogmatique, mais doit tendre vers un équilibre tel que celui proposé par l’Anses entre ces deux familles de macronutriments : 35-40 % de lipides et 40-55 % de glucides digestibles [38]. Enfin, il convient avant tout de respecter l’équilibre global entre apports et dépenses énergétiques.
Et chez l’enfant ?
La lipido-phobie des parents et le rejet des lipides par une partie des professionnels de santé pendant une longue période ont sans doute été plus délétères pour les enfants que pour les adultes. Chez le jeune enfant, la consommation actuelle de lipides, en pourcentage de l’apport énergétique, est en effet très inférieure aux recommandations. Les mesures de consommation, décrites dans la cohorte française EDEN4 (regroupant 1 275 enfants âgés de 8 à 12 mois), indiquent ainsi que 95 % des enfants de 8 mois ont des apports lipidiques qui se situent en dessous de leurs besoins, et que moins de 5 % d’entre eux atteignent le seuil de 40 % d’énergie d’origine lipidique (la valeur basse préconisée par l’Organisation des Nations Unies pour l’alimentation et l’agriculture [FAO]) [39]. Cette étude montre parallèlement que 95 % de ces enfants atteignent ou dépassent une proportion de 45 % d’énergie d’origine glucidique.
L’Anses recommande pour ces âges un apport d’origine lipidique de 45 à 50 % de l’énergie totale, dans les aliments pour nourrisson et préparations de suite (Tableau I). Les besoins énergétiques des enfants sont en effet très importants entre la naissance et 1 an, de même qu’entre 1 an et 3 ans, en raison d’un métabolisme basal très intense lié à leur très forte croissance, en particulier au cours des premiers 6 mois [40]. Le développement du système nerveux (central et périphérique) et la myélinisation des nerfs requièrent également des lipides spécifiques, dont des acides gras indispensables [41-43]. L’enquête française Nutri-Bébé5 avait montré, en 2013, que 80 % des enfants âgés de plus d’un an avaient des apports inférieurs aux valeurs recommandées par l’Autorité européenne de sécurité des aliments (EFSA) [44].
Les recommandations chez l’enfant jusqu’à 6 mois en lipides totaux (% énergie) des différentes instances. Anses : Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail ; FAO-WHO : Food and Agriculture Organization-World Health Organization ; directive 2006/141/EC, commission du 22 décembre 2006 concernant les préparations pour nourrissons et les préparations de suite et modifiant la directive 1999/21/CE.
Cinquante pour cent de l’énergie totale du lait humain sont constitués de lipides. Cette proportion de lipides représente ainsi une base de réflexion pour les recommandations faites pour l’alimentation des enfants. La définition de la limite basse des apports lipidiques reste cependant une question toujours débattue. Il semble néanmoins que respecter 40 % d’énergie d’origine lipidique dans l’alimentation du nourrisson permettrait d’assurer des apports suffisants en acides gras indispensables (acide eicosapentaénoïque [EPA] et acide docosahexaénoïque [DHA], mais également acide arachidonique [ARA]) [41, 43] et autres nutriments lipidiques mineurs du lait [45] nécessaires à sa croissance.
Il est encore difficile actuellement d’évaluer les conséquences possibles, à moyen ou long terme, d’un déficit lipidique en périodes péri- et post-natales sur la prévention de l’obésité infantile. Parmi les études qui ont suggéré que l’apport lipidique était trop faible au cours de l’enfance, citons l’étude DONALD6 qui a montré que l’indice de masse corporelle était significativement plus élevé chez les enfants sous régimes pauvres en lipides [46]. L’absence d’inconvénient d’un apport élevé de lipides a été par ailleurs confirmée par d’autres études [47, 48], de même que l’effet protecteur sur l’obésité de la consommation de produits laitiers comportant une large proportion de lipides (high-fat), qui correspondent à ce qu’on appelle lait entier [49, 50]. Plus encore que pour les adultes, la peur et le dénigrement des lipides n’a plus de justification pour l’enfant. Ils peuvent même être délétères quand les apports sont nettement en dessous de ses besoins. Le lait entier devrait donc être utilisé.
Concernant les aliments salés donnés aux nourrissons plus âgés, le conseil d’ajouter systématiquement des lipides (huiles ou beurre) à la préparation, indiqué sur l’étiquetage des « petits pots » et autres consommables spécifiques pour les bébés, constitue le seul moyen d’atteindre les 40 % d’énergie d’origine lipidique préconisés. Les pédiatres soulignent également que l’abandon trop précoce du lait de croissance et des préparations infantiles pourrait participer au déficit d’énergie d’origine lipidique que l’on observe chez les enfants. Entre 1 et 2 ans, seuls 65 % des enfants consomment des laits infantiles. Ils sont 31 % entre 2 et 3 ans (d’après l’étude Nutri-Bébé). Dans tous les cas, suivre les recommandations des apports nutritionnels conseillés (ANC) reste souhaitable et constitue une base de principe de précaution, surtout pour l’enfant.
Conclusion
Après une période très dogmatique, mais en partie explicable, de diabolisation des lipides, il convient d’inverser cette perception, très vraisemblablement contre-productive chez l’adulte et surtout chez l’enfant. On peut s’interroger aussi sur l’intérêt, voire le danger, de certaines approches, comme le Nutri-Score7, qui reste fondé sur la lipido-phobie des décades précédentes, et semble encore moins adapté à l’enfant qu’il ne l’est à l’adulte en ce qui concerne les lipides.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Willett WC, Leibel RL. Dietary fat is not a major determinant of body fat. Am J Med 2002 ; 113(suppl 9B): S47–S59. [CrossRef] [Google Scholar]
- Prentice AM, Jebb SA. Obesity in Britain: gluttony or sloth?. BMJ 1995 ; 311 : 437. [CrossRef] [Google Scholar]
- Prentice AM. Overeating: the health risks. Obes Res 2001 ; 9(suppl 4): S234–S238. [CrossRef] [Google Scholar]
- Lissner L, Heitmann BL. Dietary fat and obesity: evidence from epidemiology. Eur J Clin Nutr 1995 ; 49 : 79–90. [Google Scholar]
- Willett WC. Dietary fat and obesity: an unconvincing relation. Am J Clin Nutr 1998 ; 68 : 1149–1150. [CrossRef] [PubMed] [Google Scholar]
- Kuczmarski RJ, Flegal KM, Campbell SM, Johnson CL. Increasing prevalence of overweight among US adults: the national health and nutrition examination surveys, 1960 to 1991. JAMA 1994 ; 272 : 205–211. [CrossRef] [PubMed] [Google Scholar]
- Heini AF, Weinsier RL. Divergent trends in obesity and fat intake patterns: the American paradox. Am J Med 1997 ; 102 : 259–264. [CrossRef] [Google Scholar]
- Chaput JP, Tremblay A, Rimm EB, et al. A novel interaction between dietary composition and insulin secretion: effects on weight gain in the Quebec family study. Am J Clin Nutr 2008 ; 87 : 303–309. [CrossRef] [PubMed] [Google Scholar]
- Halton TL, Willett WC, Liu S, et al. Low-carbohydrate-diet score and the risk of coronary heart disease in women. N Engl J Med 2006 ; 355 : 1991–2002. [CrossRef] [PubMed] [Google Scholar]
- Austin GL, Ogden LG, Hill JO. Trends in carbohydrate, fat, and protein intakes and association with energy intake in normal-weight, overweight, and obese individuals: 1971–2006. Am J Clin Nutr 2011 ; 93 : 836–843. [CrossRef] [PubMed] [Google Scholar]
- Tobias DK, Chen M, Manson JAE, et al. Effect of low-fat diet interventions versus other diet interventions on long-term weight change in adults: a systematic review and meta-analysis. Lancet Diabetes Endocrinol 2015 ; 3 : 968–979. [CrossRef] [PubMed] [Google Scholar]
- Ludwig DS, Willett WC, Volek JS, Neuhouser ML. Dietary fat: from foe to friend?. Science 2018 ; 362 : 764–770. [CrossRef] [Google Scholar]
- Hjorth MF, Zohar Y, Hill JO, Astrup A. Personalized dietary management of overweight and obesity based on measures of insulin and glucose. Annu Rev Nutr 2018 ; 38 : 245–272. [CrossRef] [PubMed] [Google Scholar]
- Ludwig DS, Ebbeling CB. The carbohydrate-insulin model of obesity: beyond calories in, calories out. JAMA Intern Med 2018 ; 178 : 1098–1103. [CrossRef] [PubMed] [Google Scholar]
- Volek JS, Phinney SD, Forsythe CE, et al. Carbohydrate restriction has a more favorable impact on the metabolic syndrome than a low fat diet. Lipids 2009 ; 44 : 297–309. [CrossRef] [PubMed] [Google Scholar]
- Mansoor N, Vinknes KJ, Veierod MB, Retterstol K. Effects of low-carbohydrate diets v. low-fat diets on body weight and cardiovascular risk factors a meta-analysis of randomised controlled trials. Br J Nutr 2016 ; 115 : 466–479. [CrossRef] [PubMed] [Google Scholar]
- Volek JS, Fernandez ML, Feinman RD, Phinney SD. Dietary carbohydrate restriction induces a unique metabolic state positively affecting atherogenic dyslipidemia, fatty acid partitioning, and metabolic syndrome. Prog Lipid Res 2008 ; 47 : 307–318. [CrossRef] [PubMed] [Google Scholar]
- Van Zuuren EJ, Fedorowicz Z, Kuijpers T, Pijl H. Effects of low-carbohydrate- compared with low-fat-diet interventions on metabolic control in people with type 2 diabetes: a systematic review including GRADE assessments. Am J Clin Nutr 2018 ; 108 : 300–331. [CrossRef] [PubMed] [Google Scholar]
- Guasch-Ferré M, Babio N, Martínez-González MA, et al. Dietary fat intake and risk of cardiovascular disease and all-cause mortality in a population at high risk of cardiovascular disease. Am J Clin Nutr 2015 ; 102 : 1563–1573. [CrossRef] [PubMed] [Google Scholar]
- Dehghan M, Mente A, Zhang X, et al. Associations of fats and carbohydrate intake with cardiovascular disease and mortality in 18 countries from five continents (PURE): a prospective cohort study. Lancet 2017 ; 390 : 2050–2062. [CrossRef] [PubMed] [Google Scholar]
- Campos VC, Tappy L. Physiological handling of dietary fructose-containing sugars: Implications for health. Int J Obes 2016 ; 40 : S6–11. [CrossRef] [PubMed] [Google Scholar]
- Tappy L, Lê KA. Health effects of fructose and fructose-containing caloric sweeteners: where do we stand 10 years after the initial whistle blowings?. Curr Diab Rep 2015 ; 15 : [CrossRef] [Google Scholar]
- Tappy L, Jéquier E. Fructose and dietary thermogenesis. Am J Clin Nutr 1993 ; 58 : 766S–7670. [CrossRef] [PubMed] [Google Scholar]
- Aarsland A, Wolfe RR. Hepatic secretion of VLDL fatty acids during stimulated lipogenesis in men. J Lipid Res 1998 ; 39 : 1280–1286. [CrossRef] [PubMed] [Google Scholar]
- Chong MFF, Hodson L, Bickerton AS, et al. Parallel activation of de novo lipogenesis and stearoyl-CoA desaturase activity after 3 d of high-carbohydrate feeding. Am J Clin Nutr 2008 ; 87 : 817–823. [CrossRef] [PubMed] [Google Scholar]
- Wilke MS, French MA, Goh YK, et al. Synthesis of specific fatty acids contributes to VLDL-triacylglycerol composition in humans with and without type 2 diabetes. Diabetologia 2009 ; 52 : 1628–1637. [CrossRef] [PubMed] [Google Scholar]
- Anses. Actualisation des apports nutritionnels conseillés pour les acides gras. Rapport d’expertise collective. Paris : Anses, 2011. [Google Scholar]
- Anses. Rapport INCa 2. Paris, 2007. [Google Scholar]
- Forsythe CE, Phinney SD, Fernandez ML, et al. Comparison of low fat and low carbohydrate diets on circulating fatty acid composition and markers of inflammation. Lipids 2008 ; 43 : 65–77. [CrossRef] [PubMed] [Google Scholar]
- Shai I, Schwarzfuchs D, Henkin Y, et al. Weight loss with a low-carbohydrate, Mediterranean, or low-fat diet. N Engl J Med 2008 ; 359 : 229–241. [CrossRef] [PubMed] [Google Scholar]
- Ebbeling CB, Feldman HA, Klein GL, et al. Effects of a low carbohydrate diet on energy expenditure during weight loss maintenance: randomized trial. BMJ 2018 ; 363 : [Google Scholar]
- Gow ML, Ho M, Burrows TL, et al. Impact of dietary macronutrient distribution on BMI and cardiometabolic outcomes in overweight and obese children and adolescents: a systematic review. Nutr Rev 2014 ; 72 : 453–470. [CrossRef] [PubMed] [Google Scholar]
- Shai I, Stampfer MJ. Weight-loss diets - Can you keep it off?. Am J Clin Nutr 2008 ; 88 : 1185–1186. [PubMed] [Google Scholar]
- Mansoor N, Vinknes KJ, Veierød MB, Retterstøl K. Low-carbohydrate diets increase LDL-cholesterol, and thereby indicate increased risk of CVD. Br J Nutr 2016 ; 115 : 2264–2266. [CrossRef] [PubMed] [Google Scholar]
- Bueno NB, De Melo ISV, De Oliveira SL, Da Rocha Ataide T. Very-low-carbohydrate ketogenic diet v. low-fat diet for long-term weight loss: A meta-analysis of Randomised controlled trials. Br J Nutr 2013 ; 110 : 1178–1187. [CrossRef] [PubMed] [Google Scholar]
- Sackner-Bernstein J, Kanter D, Kaul S. Dietary intervention for overweight and obese adults: comparison of low-carbohydrate and low-fat diets. a meta-analysis. PLoS One 2015 ; 10 : e0139817. [CrossRef] [Google Scholar]
- Bozzetto L, Prinster A, Annuzzi G, et al. Liver fat is reduced by an isoenergetic MUFA diet in a controlled randomized study in type 2 diabetic patients. Diabetes Care 2012 ; 35 : 1429–1435. [CrossRef] [PubMed] [Google Scholar]
- Anses. Avis et rapport de l’Anses relatifs à l’Actualisation des repères du PNNS. Paris : Anses, 2016. [Google Scholar]
- Yuan WL, Nicklaus S, Lioret S, et al. Early factors related to carbohydrate and fat intake at 8 and 12 months: results from the EDEN mother-child cohort. Eur J Clin Nutr 2017 ; 71 : 219–226. [CrossRef] [PubMed] [Google Scholar]
- Fomon SJ, Haschke F, Ziegler EE, Nelson SE. Body composition of reference children from birth to age 10 years. Am J Clin Nutr 1982 ; 35 : 1169–1175. [CrossRef] [PubMed] [Google Scholar]
- Briend A, Legrand P, Bocquet A, et al. Lipid intake in children under 3years of age in France. A position paper by the Committee on nutrition of the French society of paediatrics. Arch Pediatr 2014 ; 21 : 424–438. [CrossRef] [PubMed] [Google Scholar]
- Auestad N, Halter R, Hall RT, et al. Growth and development in term infants fed long-chain polyunsaturated fatty acids: a double-masked, randomized, parallel, prospective, multivariate study. Pediatrics 2001 ; 108 : 372–381. [CrossRef] [PubMed] [Google Scholar]
- Koletzko B, Bergmann K, Thomas Brenna J, et al. Should formula for infants provide arachidonic acid along with DHA? A position paper of the European academy of paediatrics and the child health foundation. Am J Clin Nutr 2020; 111 : 10–6. [PubMed] [Google Scholar]
- Résultats du 2e volet de l’Étude Nutri-Bébé SFAE, Apports nutritionnels chez les 0 à 3 ans. J Pédiatrie Puériculture 2013 ; 2014(27): 265–269. [Google Scholar]
- Guillocheau E, Legrand P, Rioux V. Trans-palmitoleic acid (trans-9-C16:1, or trans-C16:1 n-7): nNutritional impacts, metabolism, origin, compositional data, analytical methods and chemical synthesis. A review. Biochimie 2020; 169 : 144–60. [CrossRef] [PubMed] [Google Scholar]
- Alexy U, Sichert-Hellert W, Kersting M, Schultze-Pawlitschko V. Pattern of long-term fat intake and BMI during childhood and adolescence. Results of the Donald Study. Int J Obes 2004 ; 28 : 1203–1209. [CrossRef] [PubMed] [Google Scholar]
- Vanderhout SM, Birken CS, Parkin PC, et al. Relation between milk-fat percentage, vitamin D, and BMI z score in early childhood1,2. Am J Clin Nutr 2016 ; 104 : 1657–1664. [CrossRef] [PubMed] [Google Scholar]
- Agostoni C, Caroli M. Role of fats in the first two years of life as related to later development of NCDs. Nutr Metab Cardiovasc Dis 2012 ; 22 : 775–780. [CrossRef] [PubMed] [Google Scholar]
- Kratz M, Baars T, Guyenet S. The relationship between high-fat dairy consumption and obesity, cardiovascular, and metabolic disease. Eur J Nutr 2013 ; 52 : 1–24. [CrossRef] [Google Scholar]
- Vanderhout SM, Aglipay M, Torabi N, et al. Whole milk compared with reduced-fat milk and childhood overweight: a systematic review and meta-analysis. Am J Clin Nutr 2020; 111 : 266–79. [CrossRef] [PubMed] [Google Scholar]
Liste des tableaux
Les recommandations chez l’enfant jusqu’à 6 mois en lipides totaux (% énergie) des différentes instances. Anses : Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail ; FAO-WHO : Food and Agriculture Organization-World Health Organization ; directive 2006/141/EC, commission du 22 décembre 2006 concernant les préparations pour nourrissons et les préparations de suite et modifiant la directive 1999/21/CE.
Liste des figures
 |
Figure 1. Indice de masse corporelle (IMC) des populations de femmes adultes de plusieurs pays, en fonction de la richesse en lipides des régimes (en % d’énergie d’origine lipidique). Plusieurs sous-groupes de populations peuvent apparaître pour certains pays (d’après [1]). 1. Belgique, 2. Danemark, 3. Suisse, 4. Royaume-Uni, 5. France, 6. Islande, 7. Allemagne de l’Ouest, 8. Finlande, 9. Espagne, 10. Suède, 11. Hongrie, 12. Italie, 13. Allemagne de l’Est, 14. Tchécoslovaquie, 15. Malte, 16. Pologne, 17. Yougoslavie, 18. URSS (ensemble de données obtenues avant 1989, date de la chute du mur de Berlin). |
| Dans le texte | |
 |
Figure 2. Les mesures de l’obésité, de l’énergie totale ingérée, des lipides ingérés, ainsi que du temps passé devant la télévision et de la disponibilité des voitures dans les ménages, sont présentées en fonction du temps, entre 1940 et 1990, en Angleterre (d’après [2]). |
| Dans le texte | |
 |
Figure 3. Variation du poids moyen de volontaires en surpoids, en fonction du temps sur une durée de 24 mois : comparaison d’un régime pauvre en lipides à un régime pauvre en glucides (d’après [30]). |
| Dans le texte | |
 |
Figure 4. Risque relatif de mortalité totale (A et B) et de mortalité cardiovasculaire (C et D), en fonction de la part (% d’énergie d’origine lipidique) de lipides (A et C) et de glucides (B et D) (d’après [20]). |
| Dans le texte | |
 |
Figure 5. Schéma de l’évolution des paramètres plasmatiques principaux et de l’orientation du métabolisme hépatique, lors d’une baisse des glucides et d’une hausse des lipides du régime. La réorientation métabolique due à une diminution de l’insuline résulte 1) en une diminution de la glycolyse, de la lipogenèse et de la sécrétion des VLDL d’une part, et 2) en une augmentation de la lipolyse, de la b-oxydation des acides gras et de la cétogenèse d’autre part. AG : acide gras ; GLUT2 : transporteur du glucose 2 ; Glu : glucose ; GK : glucokinase ; PFK : phosphofructokinase ; L-PK : liver pyruvate kinase ; AMPK : AMP-activated proteine kinase ; ChREBP : carbohydrate response element-binding protein ; AcCoA : acétyl coenzyme A ; ACC : acétyl coenzyme A carboxylase ; FAS : fatty acid synthase ; SREBP 1c : sterol response element-binding protein 1c ; PPAR-a : peroxisome proliferator activated receptor-a ; FGF21 : fibroblast growth factor 21 ; VLDL : very low density lipoprotein ; Apo B : apolipoprotéine B. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




