| Issue |
Med Sci (Paris)
Volume 36, Number 4, Avril 2020
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 404 - 407 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2020064 | |
| Published online | 01 May 2020 | |
Les bactéries, organismes de choix pour comprendre les mécanismes de réparation des protéines oxydées
Bacteria, model organisms to investigate the repair mechanisms of oxidized proteins
1
Master 2 Microbiologie Intégrative et Fondamentale, Aix Marseille Université, Marseille, France
2
Aix Marseille Université, CNRS, LCB UMR, 7283, IMM, Marseille, France
a marianne.broc@etu.univ-amu.fr
b mohand-said.hachemane@etu.univ-amu.fr
c marine.novelli@etu.univ-amu.fr
d mathieu.sourice@etu.univ-amu.fr
e aussel@imm.cnrs.fr
Dans le cadre de l’unité d’enseignement « Rédiger en sciences » proposée par l’université d’Aix-Marseille, les étudiants du Master 2 de microbiologie se sont confrontés aux exigences de l’écriture scientifique.
Quatre thématiques leur ont été proposées : les virus géants, les systèmes de sécrétion, la motilité bactérienne et la réparation des protéines oxydées. Après un travail préparatoire effectué avec l’équipe pédagogique et les auteurs des publications originales, les étudiants, organisés en groupes de trois ou quatre, ont rédigé une Nouvelle soulignant les résultats majeurs et l’originalité des quatre articles étudiés. Complété par un entretien avec les chercheurs auteurs de ces articles, l’ensemble offre un éclairage original sur la compréhension du vivant dans le domaine de la microbiologie.
© 2020 médecine/sciences – Inserm
L’actualité scientifique vue par les étudiants du Master 2 de microbiologie d’Aix-Marseille Université (AMU), Parcours Microbiologie Intégrative et Fondamentale (MIF), Unité d’Enseignement « Rédiger en sciences »

Responsable de l’Unité d’Enseignement
Laurent Aussel
Équipe pédagogique
Amel Latifi (professeur, Aix-Marseille Université) latifi@imm.cnrs.fr Laurent Aussel (maître de conférences, Aix-Marseille Université) aussel@imm.cnrs.fr
Série coordonnée par Sophie Sibéril.
Tous les organismes vivants sont exposés à l’oxygène et ses dérivés : les formes réactives de l’oxygène (FRO), dont l’anion superoxyde (O2-•), le peroxyde d’hydrogène (H2O2) et le radical hydroxyle (OH•). L’homéostasie de ces FRO peut être contrôlée par des molécules antioxydantes (glutathion, vitamines C et E) ou par des enzymes (catalase, superoxyde dismutase ou peroxydase) capables de chélater ou de dégrader ces FRO, diminuant ainsi leur concentration intracellulaire. Le stress oxydant résulte d’un déséquilibre entre la production des FRO et leur dégradation. La conséquence majeure de ce phénomène est l’oxydation des constituants cellulaires – ADN, protéines et lipides – pouvant aboutir à une modification structurale et/ou une perte de leurs activités biologiques. Les protéines sont les biomolécules les plus représentées dans les cellules, ce qui en fait des cibles privilégiées du stress oxydant. Six acides aminés y sont particulièrement sensibles. Les résidus lysine, arginine, thréonine et proline peuvent subir une carbonylation irréversible sur leur chaîne latérale. Les résidus cystéine et méthionine (Met) peuvent, eux, être convertis de manière réversible en cystine et méthionine sulfoxyde (MetSO). La réduction des MetSO en Met est assurée par les méthionine sulfoxyde réductases (Msr), des enzymes conservées chez tous les organismes vivants. Leur rôle apparaît donc primordial pour la cellule puisqu’elles assurent une fonction antioxydante en réparant les protéines oxydées. D’après l’axiome de Jacques Monod, ce qui est vrai pour la bactérie est vrai pour l’éléphant. L’étude du système Msr procaryote représente donc une étape clé dans la caractérisation des mécanismes de défense contre le stress oxydant et ouvre de nombreuses perspectives quant à la compréhension de ces mécanismes chez l’homme.
Escherichia coli, un organisme modèle pour l’étude des Msr
Escherichia coli est la bactérie la plus utilisée dans les laboratoires de recherche : sa croissance est rapide, son génome a été séquencé et les manipulations génétiques y sont simples et maîtrisées. Le système Msr d’E. coli a ainsi fait l’objet de nombreux travaux de recherche qui ont permis l’identification d’enzymes impliquées dans la réparation des protéines oxydées. À ce jour, cinq enzymes dotées d’une fonction Msr ont été caractérisées. Dans le cytoplasme, deux d’entre elles agissent sur les MetSO libres (MsrC et BisC) et deux autres sur les résidus MetSO présents au sein des protéines (MsrA et MsrB). Chez les bactéries à Gram négatif, une Msr supplémentaire est localisée dans le périplasme : MsrP (Figure 1).
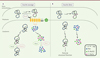 |
Figure 1. Réparation des méthionines oxydées par le système Msr. Les formes réactives de l’oxygène (FRO) transforment les résidus méthionine (Met) en méthionine sulfoxyde (MetSO). A. Dans le périplasme, le système MsrPQ réduit les MetSO sans diastéréospécificité. Dans le cytoplasme, MsrA et BisC réduisent respectivement les MetSO protéiques et libres sous forme S tandis que MsrB et MsrC réduisent les formes R. B. En l’absence de gènes codant les enzymes Msr, les Met oxydées ne sont pas réparées. Q : quinones ; e- : électrons. |
Les Msr cytoplasmiques, des procaryotes aux eucaryotes
MsrA fut la première enzyme Msr identifiée par les travaux de Nathan Brot en 1981 [1]. Depuis, des études ont permis de mieux caractériser sa structure et son mécanisme d’action [2]. Lors de la réparation d’une MetSO, le site actif de l’enzyme est oxydé, puis réduit par une enzyme, la thiorédoxine. En 2001, l’équipe de Frédéric Barras, au Laboratoire de Chimie bactérienne à Marseille, a identifié chez E. coli une nouvelle enzyme possédant une activité Msr nommée MsrB [3]. Cette étude a démontré que l’action de MsrA n’était pas suffisante pour réparer la totalité des méthionines oxydées des protéines et que les enzymes MsrA et MsrB avaient des effets complémentaires. L’oxydation des Met en MetSO aboutit à la formation stochastique de deux diastéréoisomères R et S via le positionnement asymétrique de l’atome de soufre. Ainsi, la réparation de tous les résidus MetSO implique la prise en charge individuelle de chacune des deux formes. MsrA n’agissant que sur les formes S, la présence de MsrB est donc indispensable au processus complet, permettant ainsi de réparer également les formes R [3] (Figure 1). En 2004, l’équipe marseillaise a démontré, chez E. coli, que la protéine Ffh (fifty-four homolog), conservée dans tous les règnes du vivant, était un substrat des Msr in vivo. Cette protéine, liée à un ARN 4,5S, forme la particule de reconnaissance du signal (SRP) impliquée dans l’adressage des protéines aux membranes. Les auteurs ont montré in vitro que l’oxydation de Ffh entraînait une perte de liaison à l’ARN 4,5S. En ajoutant MsrA et MsrB, ils ont pu restaurer la capacité de Ffh à lier l’ARN en réduisant les MetSO de la protéine oxydée en Met [4]. Ils ont ensuite démontré in vivo que l’adressage de la protéine Ffh à la membrane interne n’était pas possible dans une souche dépourvue des gènes msrA et msrB. La complémentation d’un des deux gènes est néanmoins suffisante pour restaurer l’adressage de la protéine, suggérant qu’une réparation partielle des méthionines oxydées est suffisante pour rétablir l’activité de Ffh [4]. Dans cette étude, il a donc été montré pour la première fois que la protéine Ffh pouvait être inactivée par les FRO et réparée par le système MsrA/B, soulignant ainsi l’importance de ce dernier chez les procaryotes [4]. Ffh étant ubiquitaire, cela suggère que le système Msr pourrait jouer un rôle important chez les eucaryotes. Dans différents travaux, il a été rapporté que des souris dont le gène msrA avait été inactivé étaient plus vulnérables au stress oxydant [5] et présentaient des phénotypes similaires à ceux observés dans des pathologies neurodégénératives, comme la maladie d’Alzheimer [6]. Paradoxalement, une étude publiée par Lo Laï et ses collaborateurs en 2019, démontre que des souris dépourvues de la totalité des gènes codant les Msr résistaient mieux au stress oxydant que des souris sauvages [7]. Ce résultat paradoxal reste, à ce jour, inexpliqué. L’absence totale d’activité Msr chez ces souris suggère qu’un autre mécanisme de lutte contre le stress oxydant pourrait exister chez ces organismes, se substituant au système Msr lorsque celui-ci ne fonctionne pas. Étonnament, il semblerait que cette « voie alternative » soit plus efficace que le système Msr lui-même.
Entretien avec Benjamin Ezraty mené par les auteurs de la Nouvelle

Benjamin Ezraty est chargé de recherche au CNRS. Il a contribué à la découverte de plusieurs enzymes importantes pour la réparation des méthionines oxydées. Il a également étudié l’implication de la teneur en fer dans la résistance aux antibiotiques, travail pour lequel il a reçu le prix AXA de l’académie des sciences en 2014. Il dirige désormais une équipe de huit personnes au Laboratoire de Chimie bactérienne (LCB) à Marseille, qui s’intéresse aux systèmes de réparation des protéines oxydées.
Qu’est-ce qui vous a amené à travailler sur les Msr, les enzymes impliquées dans la réparation des méthionines oxydées ?
Benjamin Ezraty : C’est au cours d’un stage effectué lors de ma deuxième année de master que j’ai été confronté pour la première fois à ces enzymes. À partir d’un crible génétique, MsrA a été identifiée comme étant un facteur de virulence de la bactérie phytopathogène Erwinia chrysanthemi. Dès lors, les Msr ont été étudiées au sein du LCB et j’ai choisi de prolonger mes recherches sur ce sujet lors de ma thèse.
Quelles sont les plus grandes avancées de votre carrière sur le projet Msr ?
BE : Sans conteste, il s’agit de la découverte de MsrB chez la bactérie modèle Escherichia coli. Lors de ma thèse, je me suis intéressé à une protéine de fonction inconnue fusionnée à MsrA chez certains organismes. En caractérisant son activité biologique, j’ai découvert qu’elle était complémentaire à celle de MsrA et que leurs actions conjointes permettaient de réparer une protéine oxydée dans sa totalité. Depuis, cette découverte a été prolongée puisque ces Msr ont été caractérisées chez tous les êtres vivants, y compris chez l’homme. D’autres questionnements ont alors rapidement vu le jour : pourquoi ce système de réparation est-il présent ? Quelles sont les protéines réparées par les Msr ? Sont-elles toutes réparées ? L’identification du système SRP (particule de reconnaissance du signal) comme substrat des Msr fut également une belle découverte à mes yeux puisqu’il s’agit d’un système essentiel et ubiquitaire impliqué dans l’adressage et la translocation des protéines. Enfin, la troisième découverte qui me tient à cœur est l’identification de MsrP qui est périplasmique et uniquement présente chez les bactéries à Gram négatif. Il s’agit d’une belle avancée dans le domaine de la microbiologie, qui s’est soldée par une jolie publication.
Comment avez-vous vécu votre passage de chercheur à chef d’équipe ? Quels changements cela a-t-il impliqué pour vous ?
BE : J’aime prendre des responsabilités et être à l’initiative de projets. Avant d’être chef d’équipe, j’avais la responsabilité de projets scientifiques que je portais au sein d’un groupe dont je n’étais pas responsable. Désormais, l’aspect « ressources humaines » est plus présent : il faut gérer les budgets, les tâches administratives et essayer de faire travailler les uns avec les autres afin de faire avancer l’équipe. Être chef d’équipe, c’est aussi savoir gérer ce qui nous préoccupe le plus : l’avenir de nos étudiants. Par exemple, il faut accompagner les doctorants au bout de leur thèse – avec si possible de belles publications – pour qu’ils puissent valoriser cette expérience et trouver un emploi. De nos jours, ce n’est pas évident. Il faut donc faire au mieux pour que tous les membres de l’équipe puissent tirer leur épingle du jeu. Il y a aussi une pression pour la pérennité de l’équipe et les sujets d’étude : c’est quelque chose qui me tient à cœur. Être chef d’équipe, c’est une aventure qu’il faut vivre pleinement. Il y a des moments plus durs que d’autres, mais il faut avoir la « niaque ». Je pense que la clé de la réussite, c’est de ne rien lâcher, tel un sportif de haut niveau !
Quels sont vos projets pour l’avenir ?
BE : Plusieurs étapes importantes attendent mon équipe. D’abord la concrétisation d’études qui ont été initiées il y a plusieurs années, avec l’objectif de les publier dans des journaux importants. Ensuite, deux thèses vont bientôt arriver à leur terme et il faut que leur contenu soit de bon niveau pour que les étudiantes puissent publier leurs travaux. Enfin, il y a les demandes de nouveaux financements, car certains de mes contrats approchent de leur fin et il est important de renouveler les apports d’argent. L’organisation de congrès, c’est aussi quelque chose que je fais beaucoup. Au CNRS, je suis responsable – avec Mireille Ansaldi – de l’École thématique de microbiologie, organisée tous les quatre ans. Il y a également le congrès « Microbiology at a glance » qui repose sur un format original en donnant la parole aux étudiants en fin de thèse. Mon objectif est de pérenniser cet évènement afin que notre unité soit reconnue à l’échelle internationale. Évidemment, plusieurs éditions seront nécessaires pour cela, même si l’on commence à avoir une certaine renommée.
Que pensez-vous de la situation actuelle concernant la recherche scientifique en France ?
BE : On évolue dans une société où l’on se tourne de plus en plus vers soi-même et où l’on manque de vision collective. Certains ne voient pas l’intérêt de la recherche car ils ne réfléchissent pas sur le long-terme. Je pense que la recherche scientifique souffre de cette vision. Les politiques ont besoin de résultats à court terme. C’est compliqué et les chercheurs tentent d’intégrer cette complexité à leur mode de fonctionnement. Comparé à certains pays, plusieurs regrettent les faibles moyens alloués à la recherche. Je ne peux pas dire que c’est faux mais je pense qu’il n’y a pas que ça. Il faut aussi que notre communauté fasse des efforts pour communiquer vers le grand public afin de montrer ce que l’on fait au quotidien.
Quels sont pour vous les points forts et les points faibles de la France en matière de recherche scientifique ?
BE : Nous manquons d’argent, de moyens, de visibilité et peut-être même de technologies de pointe. Mais l’aspect positif, c’est que les doctorants que l’on forme en France trouvent facilement du travail à l’étranger et que les laboratoires sont généralement ravis de les recevoir. Nos étudiants sont bien formés et c’est une fierté pour la recherche française. Il faut maintenant faire en sorte que ces étudiants, partis à l’étranger, puissent revenir en France pour s’y établir. Après, il y a de très bons laboratoires en France comme à l’étranger.
Un mot pour la fin ?
BE : Je vis donc je rouille. Mais bon, j’ai des systèmes de défense.
Msr périplasmique, une nouvelle cible thérapeutique ?
Le périplasme des bactéries est le premier compartiment cellulaire à être touché par les FRO exogènes qui peuvent provenir de différentes sources. Les pathogènes intracellulaires sont en effet soumis aux FRO qui sont générées par le système immunitaire lors de l’infection. Les bactéries présentes dans l’environnement sont quant à elles exposées à d’autres sources d’agents oxydants, telles que les métaux lourds ou l’eau de javel (HOCl). Chez les bactéries à Gram négatif, il existe un système qui permet de maintenir l’homéostasie des protéines dans le compartiment périplasmique. Découvert en 2015 chez E. coli, il se compose de deux protéines codées au sein du même opéron, MsrP, une molybdo-enzyme (enzyme nécessitant le molybdène comme co-facteur pour son activité biologique) et MsrQ, une protéine de membrane interne [8]. Le rôle de cette dernière est de régénérer MsrP en lui transférant des électrons issus des quinones de la chaîne respiratoire. Le système MsrPQ se distingue des autres par sa localisation périplasmique et sa régénération thiorédoxine-indépendante. Il s’affranchit également de la diastéréospécificité en s’attaquant simultanément aux MetSO sous forme R et S. Chez certains pathogènes tels que Campilobacter jejuni, MsrP semble être impliquée dans la virulence [9], en permettant à la souche de lutter contre les FRO générées par les défenses immunitaires. Au vu de ses caractéristiques, considérer MsrPQ comme une potentielle cible thérapeutique est envisageable [10] (→), l’avantage étant sa localisation périplasmique et sa présence exclusive chez les bactéries à Gram négatif. Cependant, l’inactivation de MsrPQ pourrait être insuffisante du fait de la présence des enzymes Msr cytoplasmiques. Ainsi, il serait intéressant d’étudier l’effet de la délétion de tous les systèmes Msr sur la virulence de certaines souches pathogènes. La mise en place d’un procédé thérapeutique s’avère néanmoins complexe du fait de la multitude des cibles à atteindre.
(→) Voir la Nouvelle de B. Ezraty et F. Barras, m/s n° 6-7, juin-juillet 2016, page 542
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Brot N, Weissbach L, Werth J, et al. Enzymatic reduction of protein-bound methionine sulfoxide. Proc Natl Acad Sci USA 1981 ; 78 : 2155–2158. [CrossRef] [Google Scholar]
- Coudevylle N, Antoine M, Bouquet-Bonnet S, et al. Solution structure and backbone dynamcs of the reduced form and an oxidized form of E. coli methionine sulfoxide reductase A (MsrA): structural insight of the MsrA catalytic cycle. J Mol Biol 2007 ; 366 : 193–206. [Google Scholar]
- Grimaud R, Ezraty B, Mitchell JK, et al. Repair of oxidized proteins. Identification of a new methionine sulfoxide reductase. J Biol Chem 2001 ; 276 : 48915–48920. [CrossRef] [PubMed] [Google Scholar]
- Ezraty B, Grimaud R, El Hassouni M, et al. Methionine sulfoxide reductases protect Ffh from oxidative damages in Escherichia coli. EMBO J 2004 ; 23 : 1868–1877. [CrossRef] [PubMed] [Google Scholar]
- Salmon AB, Pérez VI, Bokov A, et al. Lack of methionine sulfoxide reductase A in mice increases sensitivity to oxidative stress but does not diminish life span. FASEB J 2009 ; 23 : 3601–3608. [CrossRef] [PubMed] [Google Scholar]
- Pal R, Oien DB, Ersen FY, et al. Elevated levels of brain-pathologies associated with neurodegenerative diseases in the methionine sulfoxide reductase A knockout mouse. Exp Brain Res 2007 ; 180 : 765–774. [CrossRef] [PubMed] [Google Scholar]
- Lai L, Sun J, Tarafdar S, et al. Loss of methionine sulfoxide reductases increases resistance to oxidative stress. Free Radic Biol Med 2019 ; 145 : 374–384. [CrossRef] [PubMed] [Google Scholar]
- Gennaris A, Ezraty B, Henry C, et al. Repairing oxidized proteins in the bacterial envelope using respiratory chain electrons. Nature 2015 ; 528 : 409–412. [Google Scholar]
- Hitchcock A, Hall SJ, Myers JD, et al. Roles of the twin-arginine translocase and associated chaperones in the biogenesis of the electron transport chains of the human pathogen Campylobacter jejuni. Microbiology 2010 ; 156 : 2994–3010. [CrossRef] [PubMed] [Google Scholar]
- Ezraty B, Barras F. L’eau de javel et les bactéries. Identification d’une nouvelle cible thérapeutique potentielle. Med Sci (Paris) 2016 ; 32 : 542–544. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Réparation des méthionines oxydées par le système Msr. Les formes réactives de l’oxygène (FRO) transforment les résidus méthionine (Met) en méthionine sulfoxyde (MetSO). A. Dans le périplasme, le système MsrPQ réduit les MetSO sans diastéréospécificité. Dans le cytoplasme, MsrA et BisC réduisent respectivement les MetSO protéiques et libres sous forme S tandis que MsrB et MsrC réduisent les formes R. B. En l’absence de gènes codant les enzymes Msr, les Met oxydées ne sont pas réparées. Q : quinones ; e- : électrons. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




