| Issue |
Med Sci (Paris)
Volume 36, Number 1, Janvier 2020
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 83 - 86 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2019263 | |
| Published online | 04 February 2020 | |
Des néo-antigènes non mutés, les TEIPP, comme nouvelles cibles des immunothérapies du cancer
Non-mutated neoantigens, TEIPP, as new targets for cancer immunotherapies
1
Master 1 cancer, module d’immunologie-virologie, université de Lyon, université Claude Bernard Lyon 1, Lyon, France
2
UMR Inserm 1052, CNRS 5286, centre Léon Bérard, centre de recherche en cancérologie de Lyon, 28 rue Laennec 69373 Lyon cedex 08, France
* adrien.vouilloz@etu.univ-lyon1.fr
** laurent.serre@gmail.com
Le cancer est aujourd’hui un des principaux enjeux de santé publique. Le développement de traitements capables de guérir et de protéger durablement les patients est une priorité. Actuellement, les principaux traitements sont la chimiothérapie, la radiothérapie, et l’exérèse chirurgicale. Cependant, bien qu’en constant perfectionnement, ces thérapies restent insuffisantes. De nombreux patients ne répondent pas au traitement ou rechutent après une période de rémission. Parmi les nouvelles thérapies prometteuses, les immunothérapies consistent à aider artificiellement le système immunitaire à combattre la tumeur. Au cours de leur développement, les tumeurs mettent en place des mécanismes d’inhibition de la réponse immunitaire.
Certaines immunothérapies font intervenir des anticorps, qui bloquent ces signaux inhibiteurs1. Ces thérapies sont très efficaces, mais seulement chez un quart des patients traités, et l’activation généralisée du système immunitaire des patients peut induire des effets secondaires importants.
Ainsi, d’importants efforts sont entrepris pour développer de nouvelles stratégies d’immunothérapies spécifiques de la réponse immunitaire anti-cancéreuse. Cet objectif peut être atteint grâce aux stratégies de vaccination ciblant des marqueurs spécifiques des tumeurs, les néoantigènes (néoAg) [1–3].
Réponse immunitaire et notion d’antigène dans le contexte tumoral
Le système immunitaire est constitué de plusieurs populations de cellules ayant chacune des fonctions précises. Les cellules dendritiques (dendritic cells, DC) sont chargées d’identifier les signaux de danger et de déclencher une réponse immunitaire spécifique [4]. Les lymphocytes T (LT) sont des cellules effectrices qui sont activées par les DC. Pour cela, les DC capturent des fragments de cellules tumorales et en extraient des molécules appelées antigènes. Un antigène est une molécule reconnue par le système immunitaire lors d’une réponse immunitaire, et qui est capable de déclencher cette réponse immunitaire. Ces antigènes dits « tumoraux » (AgT) sont ensuite dégradés en peptides, puis associés aux molécules du complexe majeur d’histocompatibilité de classe I et II (CMH I et CMH II), qui sont reconnus respectivement par les lymphocytes T CD8+ (LT8) et CD4+(LT4). Suite à leur activation, les LT8 acquièrent des capacités cytotoxiques et migrent dans la tumeur. Les cellules tumorales exprimant à leur surface les mêmes complexes peptide-CMH I sont reconnues et éliminées par les LT8 spécifiques. De leur côté, les LT4 acquièrent des capacités de contrôle et d’orientation de la réponse immunitaire. Ils peuvent ainsi amplifier la réponse des autres cellules immunitaires ou à l’inverse, les inhiber en acquérant des fonctions dites régulatrices.
Les antigènes dits du « soi » sont produits par les cellules de l’organisme et sont codés dans le génome de l’individu. à l’inverse, les antigènes du « non-soi » sont reconnus par le système immunitaire qui va tenter de les éliminer. Au cours du développement des LT dans le thymus, des mécanismes de sélection « positive » ou « négative » permettent d’éliminer un maximum de LT spécifiques des antigènes du soi afin de limiter le développement de maladies auto-immunes, tout en préservant les LT spécifiques du non-soi.
Les AgT peuvent être divisés en plusieurs catégories. Certains gènes codant des protéines spécifiques du tissu d’origine de la tumeur, comme la protéine PMEL des mélanocytes dans le mélanome, peuvent voir leur expression augmenter fortement dans les tumeurs, ce qui peut induire une rupture de la tolérance au soi et une réponse immunitaire contre ces antigènes. Les tumeurs peuvent également exprimer des gènes qui ne sont normalement pas exprimés dans leur tissu d’origine ou qui ne sont exprimés que lors du développement embryonnaire. La protéine NY-ESO-1, par exemple, qui est exprimée durant le développement embryonnaire, dont l’expression est ensuite restreinte au placenta lors de la grossesse et dans les cellules germinales à l’âge adulte, est ré-exprimée par les cellules tumorales dans un très grand nombre de cancers (neuroblastome, myélome, mélanome, sarcome, cancer de la vessie, cancer du poumon, etc.) [1–5]. Dans le cas particulier des cancers d’origine virale (papillomavirus, virus de l’hépatite C, etc.), des Ag T peuvent dériver de protéines virales et être reconnus par les LT8, qui élimineront les cellules infectées par le virus. Enfin, les néoAg dérivent de gènes mutés produisant des protéines modifiées qui seront considérées par le système immunitaire comme étant du soi. Récemment, les travaux de l’équipe de Thorbald van Hall ont permis d’identifier une nouvelle catégorie de néoAg dérivant de gènes non mutés et dont l’expression n’est pas nécessairement anormale, mais pour lesquels la présentation par les molécules du CMH est dépendante de conditions très spécifiques [6].
Les TEIPP, origine et expression chez l’homme
La présentation des Ag par les molécules du CMH I fait intervenir un ensemble de mécanismes. Les peptides produits dans le cytoplasme par dégradation enzymatique passent dans le réticulum endoplasmique (RE) grâce au complexe de protéines TAP (transporter associated with antigen processing) [4–6]. Les peptides peuvent alors subir une autre étape de dégradation enzymatique avant d’être associés aux molécules du CMH I et exportés vers la surface de la cellule. Ce processus de présentation est présent aussi bien dans les cellules immunitaires que dans les tumeurs. Étant donné l’importance du complexe TAP dans le processus de présentation d’antigène, de nombreuses tumeurs acquièrent une déficience en TAP pour échapper au système immunitaire. Cette déficience entraîne une importante diminution de l’expression en surface des molécules de CMH I permettant l’échappement de la cellule tumorale à la surveillance du système immunitaire.
Les travaux de l’équipe de Thorbald van Hall ont montré que, dans les cellules déficientes pour le complexe TAP, les rares molécules de CMH I en surface de la cellule pouvaient présenter un répertoire de peptides inédits et variés [6], alors que ces peptides ne sont pas présentés dans une cellule exprimant normalement le complexe TAP. Ces peptides ont été nommés TEIPP (T-cell epitopes associated with impaired peptide processing). Les TEIPP sont produits à partir de diverses protéines, non-mutées, associées à la membrane du RE, et dont un fragment est libéré dans la lumière du RE suite à des processus de maturation comme le clivage d’une séquence signal (Figure 1). Les TEIPP identifiés dans cette étude proviennent de protéines apparemment sans point commun (LRPAP1, SEP15, IL-12, IFI30, etc.). Les auteurs supposent que, dans des conditions normales, les TEIPP ne sont produits qu’en très faibles quantités et se retrouvent en proportion négligeable par rapport aux peptides fournis par l’activité du complexe TAP. Ainsi, il n’y a que dans un contexte de déficience pour ce complexe protéique, lorsqu’il n’y a que les TEIPP disponibles, que ces peptides peuvent être associés aux molécules de CMH I et présentés à la surface des cellules. Étant donné leur rareté, ces TEIPP ne sont potentiellement pas ou que peu présentés dans le thymus. Ainsi, la tolérance immunitaire vis-à-vis de ces TEIPP est faible. Les travaux de van Hall ont montré que, chez la souris, des LT8 spécifiques de TEIPP pouvaient ralentir la croissance d’une tumeur déficiente en TAP. Plus récemment, la même équipe a identifié 16 TEIPP à partir de données de protéome humain dérivées de gènes de ménage [7]. Les auteurs ont détecté une population de LT8 spécifique de chacun de ces 16 TEIPP à partir du sang de donneurs sains. Les LT8 spécifiques de ces TEIPP sont principalement dans un état naïf indiquant que ces TEIPP ne sont pas ou rarement présentés chez les individus sains. Les auteurs se sont particulièrement intéressés à la protéine ubiquitaire LRPAP1, une protéine chaperonne pour les protéines liées aux récepteurs LDL. LRPAP1 est exprimée dans de nombreux types de cancer. à l’aide de clones LT8 spécifiques de LRPAP1, ils ont confirmé que ceux-ci ne sont activés que par des cellules déficientes en TAP, et que le blocage du CMH I sur les cellules cibles empêche l’activation de ces LT8. LRPAP1 est exprimée dans différents tissus de l’organisme, mais les cellules provenant de ces tissus n’activent pas les LT8 spécifiques de LRPAP1. Ces données suggèrent donc que LRPAP1 produit un TEIPP qui n’est présenté en association avec le CMH I que par les cellules déficientes en TAP.
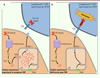 |
Figure 1. Représentation schématique de la voie de présentation des antigènes par le CMH de classe I et de l’effet de la déficience en TAP dans une cellule cancéreuse. A. Les protéines sont dégradées par le protéasome et un ensemble de protéases (Enz) en peptides, qui passent dans le réticulum endoplasmique (RE) en grande quantité. Les peptides ainsi apportés sont chargés sur les molécules du CMH I, puis exportés à la surface de la cellule cancéreuse. Les lymphocytes T CD8+ spécifiques des TEIPP ne sont pas capables de reconnaitre ces peptides via leur récepteur (TCR) et ne sont donc pas activés. B. Dans les cellules cancéreuses déficientes pour TAP, les peptides produits par le protéasome et les protéases ne peuvent pas passer dans le RE. Les protéines associées à la membrane du RE (PAM) libèrent des peptides (TEIPP) dans la lumière du RE, peptides qui sont chargés sur les molécules du CMH I et exportés à la surface de la cellule. Les lymphocytes T CD8+ spécifiques des TEIPP reconnaissent leur cible et s’activent en réponse au signal perçu. |
Potentiel thérapeutique et investigations futures
La présence de LT spécifiques de TEIPP chez les donneurs sains suggère que ces TEIPP ne sont pas ou que peu présentés lors de la sélection négative des LT dans le thymus au cours du développement. Toutefois, les auteurs ont montré que les protéines à l’origine des TEIPP étaient bien exprimées dans le thymus. Dans une étude précédente, la même équipe avait montré, dans un modèle de souris déficientes en TAP, que les LT spécifiques de TEIPP sont éliminés par sélection négative dans le thymus [6]. Ces résultats renforcent l’hypothèse selon laquelle l’absence de présentation des TEIPP dans les cellules exprimant TAP est due à l’apport massif de peptides dans le RE par l’activité du complexe TAP. La majorité des LT spécifiques de TEIPP identifiés dans cette étude proviennent du répertoire naïf des donneurs, et n’ont donc pas rencontré leur Ag. De plus, les donneurs ayant des LT spécifiques de TEIPP dans leur répertoire effecteur ne présentent pas de signe d’auto-immunité. Ensemble, ces résultats suggèrent que les cellules saines ayant une activité normale du complexe TAP ne sont pas reconnues par les LT spécifiques de TEIPP.
Chez les patients porteurs de tumeurs déficientes en TAP, la réaction immunitaire spécifique de TEIPP est soit indétectable, soit inefficace pour éliminer la tumeur. Les mécanismes immunosuppresseurs associés à une faible expression des TEIPP dans les tumeurs pourraient empêcher l’activation de la réponse du système immunitaire ciblant les TEIPP. Pour potentialiser cette réponse anti-tumorale, le groupe de Van Hall propose d’utiliser les mêmes stratégies que celles déjà à l’étude pour les néoAg provenant de protéines mutées. Ainsi, les auteurs proposent soit de mettre en place une stratégie vaccinale chez le patient, soit d’extraire et d’amplifier les LT spécifiques de TEIPP in vitro avant de les réinjecter au patient. Dans une précédente publication, les auteurs ont déjà apporté la « preuve de concept » de ces stratégies dans des modèles animaux [6], mais de nouvelles études seront nécessaires pour évaluer la sécurité et l’efficacité de ces stratégies chez les patients.
La déficience en TAP a été identifiée dans de nombreux cancers incluant des carcinomes de nombreux organes, le mélanome, des cancers du système nerveux et du système hématopoïétique [8]. Dans le cas du mélanome, environ 2 % des tumeurs présentent une mutation délétère d’au moins un des gènes codant les protéines du complexe TAP. Beaucoup de tumeurs présentent également une diminution de l’activité de ce complexe due à la répression de l’expression de ces gènes par un mécanisme épigénétique. Ainsi, une stratégie vaccinale fondée sur les TEIPP pourrait être utilisée chez de nombreux patients, y compris ceux ne présentant pas de mutation dans ces gènes, mais chez lesquels leur expression est réduite par d’autres mécanismes.
Il faut noter que les auteurs ont restreint leur analyse des TEIPP à un allèle particulier du CMH I, HLA-A*02:01 [7]. Bien que cet allèle soit particulièrement fréquent dans la population, il existe de nombreux autres allèles du gène HLA-A qui peuvent eux aussi être à l’origine d’une spécificité de liaison des peptides correspondants. Par ailleurs, deux autres gènes du CMH I, HLA-B et HLA-C, possèdent eux aussi un grand nombre d’allèles. De nouvelles études sont donc nécessaires pour identifier les TEIPP associés à ces allèles de CMH I afin de proposer une stratégie personnalisée de traitement pour chaque patient en fonction de son haplotype.
Les données de la littérature indiquent que lorsque les conditions favorables sont réunies, le système immunitaire est le meilleur « prédateur » de la tumeur. Dans cette optique, de nombreux essais cliniques en cours portant sur les immunothérapies, seules ou en combinaison avec d’autres molécules, évaluent l’efficacité de ces stratégies afin de mieux combattre les cancers. Au cours des dernières années, d’importants efforts ont été faits pour la mise au point de vaccins thérapeutiques à base de néoAg, notamment dans le mélanome, avec des résultats encourageants [9–10]. L’utilisation des TEIPP pourrait venir en complément des néoAg identifiés chez le patient afin de fournir un spectre plus large de réponses immunitaires, et ainsi augmenter l’efficacité de ces stratégies. De plus, la vaccination par TEIPP, en activant la réponse immunitaire spécifique, pourrait venir en complément de l’utilisation des immunothérapies par anticorps bloquants, créant ainsi une synergie entre les deux traitements.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Schumacher TN Schreiber RD Neoantigens in cancer immunotherapy. Science 2015 ; 348 : 69–74. [Google Scholar]
- Aldous AR Dong JZ Personalized neoantigen vaccines: a new approach to cancer immunotherapy. Bio Med Chem 2018 ; 26 : 2842–2849. [CrossRef] [PubMed] [Google Scholar]
- Cohen CJ Gartner JJ Horovitz-Fried M et al. Isolation of neoantigen-specific T cells from tumor and peripheral lymphocytes. J Clin Invest 2015 ; 125 : 3981–3991. [CrossRef] [PubMed] [Google Scholar]
- Neefjes J Jongsma MLM Paul P et al. Towards a systems understanding of MHC class I and MHC class II antigen presentation. Nat Rev Imm 2011 ; 11 : 823–836. [CrossRef] [Google Scholar]
- Gros A Parkhurst MR Tran E et al. Prospective identification of neoantigen-specific lymphocytes in the peripheral blood of melanoma patients. Nat Med 2016 ; 22 : 433–438. [CrossRef] [PubMed] [Google Scholar]
- Doorduijn EM Sluijter M Querido BJ et al. TAP-independent self-peptides enhance T cell recognition of immune-escaped tumors. J Clin Invest 2016 ; 126 : 784–794. [CrossRef] [PubMed] [Google Scholar]
- Marijt KA Blijleven L Verdegaal EME et al. Identification of non-mutated neoantigens presented by TAP-deficient tumors. J Exp Med 2018 ; 215 : 2325–2337. [CrossRef] [PubMed] [Google Scholar]
- Leone P Shin EC Perosa F et al. MHC class I antigen processing and presenting machinery: organization, function, and defects in tumor cells. J Natl Cancer Inst 2013 ; 105 : 1172–1187. [CrossRef] [PubMed] [Google Scholar]
- Ott PA Hu Z Keskin DB et al. An immunogenic personal neoantigen vaccine for patients with melanoma. Nature 2017 ; 547 : 217–221. [Google Scholar]
- Sahin U Derhovanessian E Miller M et al. Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature 2017 ; 547 : 222–226. [Google Scholar]
© 2020 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Représentation schématique de la voie de présentation des antigènes par le CMH de classe I et de l’effet de la déficience en TAP dans une cellule cancéreuse. A. Les protéines sont dégradées par le protéasome et un ensemble de protéases (Enz) en peptides, qui passent dans le réticulum endoplasmique (RE) en grande quantité. Les peptides ainsi apportés sont chargés sur les molécules du CMH I, puis exportés à la surface de la cellule cancéreuse. Les lymphocytes T CD8+ spécifiques des TEIPP ne sont pas capables de reconnaitre ces peptides via leur récepteur (TCR) et ne sont donc pas activés. B. Dans les cellules cancéreuses déficientes pour TAP, les peptides produits par le protéasome et les protéases ne peuvent pas passer dans le RE. Les protéines associées à la membrane du RE (PAM) libèrent des peptides (TEIPP) dans la lumière du RE, peptides qui sont chargés sur les molécules du CMH I et exportés à la surface de la cellule. Les lymphocytes T CD8+ spécifiques des TEIPP reconnaissent leur cible et s’activent en réponse au signal perçu. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




