| Issue |
Med Sci (Paris)
Volume 35, Number 11, Novembre 2019
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 901 - 903 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2019176 | |
| Published online | 17 December 2019 | |
Rôle de l’interaction entre le récepteur de la thrombopoïétine et la calréticuline mutée dans les néoplasmes myéloprolifératifs
Thrombopoietin receptor and mutant calreticulin : the pathogenic interaction leading to myeloproliferative neoplasms
1
M1 Biologie Santé, Université Paris-Saclay, 91405 Orsay, France
2
Inserm, UMR1170, Gustave Roussy, Villejuif, France
3
Université Paris-Saclay, UMR 1170, Gustave Roussy, Villejuif, France
4
Gustave Roussy, UMR 1170, Villejuif, France
a maude.tetu@u-psud.fr
b kenza.el-hachami@u-psud.fr
c caroline.marty@gustaveroussy.fr
Mutations du gène de la calréticuline dans les néoplasmes myéloprolifératifs
Les néoplasmes myéloprolifératifs (NMP) classiques sont des maladies rares (incidence de 1/100 000 cas par an) caractérisées par l’accumulation d’un ou plusieurs types de cellules myéloïdes : les érythrocytes, dans la polyglobulie de Vaquez, les plaquettes, dans la thrombocythémie essentielle (TE) et les mégacaryocytes et les granulocytes, dans la myélofibrose primaire (MFP). Cette dernière forme est la plus grave avec le développement d’une fibrose conduisant à une aplasie médullaire et une splénomégalie [1]. Les principaux risques associés aux NMP sont des complications thrombotiques et hémorragiques, ainsi qu’une évolution possible en leucémie myéloïde aiguë. L’avantage prolifératif des cellules myéloïdes dans les NMP est dû à l’acquisition de mutations génétiques par les cellules souches hématopoïétiques, touchant les voies de signalisation des récepteurs de facteurs de croissance hématopoïétiques, érythropoïétine, thrombopoïétine (TPO) et G-CSF (granulocyte-colony stimulating factor). Ces mutations activatrices affectent les gènes codant le récepteur de la thrombopoïétine (MPL), la tyrosine kinase JAK2 (janus kinase 2) et la calréticuline (CALR) [2–5]. Les mutations du gène CALR, en particulier une délétion de 52 paires de bases (pb) (del52) et une insertion de 5 pb, sont les plus fréquentes après la mutation JAK2 V617F, et sont exclusivement associées aux TE et MFP.
La CALR est une protéine chaperonne, résidente du réticulum endoplasmique (RE) grâce au signal de rétention KDEL présent dans sa partie carboxy-terminale (C-ter). Le RE est un lieu de maturation et de transport des protéines néo-synthétisées destinées à la membrane et à la sécrétion et CALR est directement impliquée dans le repliement de protéines N-glycosylées, c’est-à-dire qui portent une ou plusieurs chaînes oligosaccharidiques sur des résidus asparagine (N).
Les mutations de la CALR génèrent un décalage du cadre de lecture (+ 1 pb) aboutissant au remplacement d’une partie du C-ter par une nouvelle séquence chargée positivement commune à tous les mutants et à la perte du signal KDEL. La CALR mutée continue à être acheminée vers le RE de façon co-traductionnelle grâce à son peptide signal.
MPL est N-glycosylé sur 4 résidus N de son domaine extracellulaire dans le RE avant de subir plusieurs autres étapes de maturation des chaînes oligosaccharidiques et d’atteindre la surface; cependant, MPL ne fait pas partie des substrats de la CALR sauvage. La CALR mutée acquiert la capacité à se fixer sur MPL au cours des premières étapes de sa maturation dans le RE et l’accompagne à la surface (Figure 1), où l’interaction CALR del52-MPL entraine l’activation de la voie de signalisation JAK2-STAT [6, 7]. Une étude menée par l’équipe de Mullally publiée dans Blood [8], vise à caractériser la manière par laquelle la CALR mutée active la voie de signalisation MPL-JAK2 aboutissant à l’apparition de la TE et/ou MFP en identifiant précisément les bases moléculaires responsables de l’interaction entre MPL et la CALR del52.
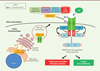 |
Figure 1 Interactions moléculaires de la CALR mutée avec MPL dans les NMP. Des mutations du gène de la CALR entraînent une perte du peptide signal KDEL de rétention dans le RE et le remplacement d’une extrémité C-ter acide par un domaine C-ter basique chargé positivement (C-ter ∆52 pb). La CALR del52 mutée (CALR mut) se fixe, via son domaine lectine, aux sites de glycosylation du domaine extracellulaire du récepteur de la thrombopoïétine (MPL). Ce site d’interaction est différent du site de liaison du ligand de MLP, la thrombopoïétine (TPO). L’interaction CALR mut-MPL a lieu dans le RE puis dans l’appareil de Golgi jusqu’à la membrane plasmique. L’extrémité C-ter ∆52 pb de la protéine mutée permet, grâce à sa forte charge positive, l’activation constitutive du MPL. Le signal est alors transduit via la tyrosine kinase JAK2 qui phosphoryle la tyrosine Y626 de MPL. Cela entraine le recrutement et l’activation constitutive d’effecteurs comme les facteurs de transcription STAT qui régulent l’expression de certains gènes, favorisant ainsi une prolifération cellulaire excessive, caractéristique des néoplasmes myéloprolifératifs. |
La CALR mutée fixe la partie extracellulaire du récepteur MPL
Dans un premier temps, les auteurs de cette étude ont analysé l’interaction entre la CALR del52 et les différents domaines de MPL (extracellulaire ou intracellulaire, accompagnés du domaine transmembranaire) par des techniques d’immunoprécipitation. Ils ont ainsi montré que CALR del52 se lie à la partie extracellulaire de MPL, confirmant ainsi les données de l’équipe de Constantinescu [7]. De plus, une mutation du site de fixation du ligand endogène TPO dans la partie extracellulaire de MPL n’affecte pas la capacité de liaison de la CALR mutée au récepteur. Cela suggère que le site d’interaction de la CALR mutée avec MPL est différent de celui de la TPO.
L’extrémité C-ter de la protéine CALR mutée nécessite un seuil minimal de charges positives pour son activité oncogénique
La CALR del52 possède une extrémité C-ter constituée de résidus basiques chargés positivement, contrairement à la protéine sauvage dont la partie C-ter est chargée négativement. Des mutants de la CALR del52 plus ou moins tronqués en charges positives ont été testés pour leur capacité à interagir avec MPL par des expériences de co-immunoprécipitation, ainsi que pour leur capacité à activer la signalisation MPL-JAK2-STAT et à induire une prolifération spontanée, en absence d’interleukine-3 (IL-3), des cellules Ba/F31 exprimant MPL. Les auteurs ont pu mettre en évidence que la CALR del52 avec une extrémité C-ter tronquée en charges positives reste capable d’interagir avec MPL mais sans que la force de cette interaction soit suffisante pour induire la signalisation en aval de ce récepteur [9].
La fonction lectine de la protéine CALR mutée est impliquée dans son activité oncogénique
La fonction de chaperonne de CALR repose sur deux composantes : le domaine « poly-peptide binding » qui interagit avec les chaines polypeptidiques, et le domaine lectine, qui lie les oligosaccharides fixés sur les résidus asparagine des protéines (N-glycosylations). Des mutations ciblant des résidus impliqués dans chacune de ces activités [10] ont permis de déterminer que la fonction lectine est nécessaire pour induire la prolifération des cellules Ba/F3-MPL en l’absence d’IL-3, alors que la fonction de chaperonne et l’activité de poly-peptide binding ne sont pas indispensables (Figure 1). En mutant les sites de N-glycosylation de MPL, Elf et al ont montré que le récepteur doit nécessairement être glycosylé pour permettre la fixation de la CALR mutée.
La tyrosine 626 du récepteur MPL est nécessaire à l’activité oncogénique de la CALR mutée
La liaison de la TPO à MPL ou l’interaction de la CALR mutée avec MPL permet le rapprochement des domaines intracellulaires et donc la juxtaposition des deux protéines JAK2 liées à chacun des monomères MPL. L’activation des JAK2 par auto/trans phosphorylation permet la phosphorylation de résidus tyrosines (Y) clés de MPL et le recrutement d’effecteurs comme les STAT. L’analyse des résidus Y591, Y626 et Y631 du domaine intracellulaire de MPL impliqués dans sa signalisation [11] a révélé l’importance prédominante de Y626 dans l’activation de la signalisation de MPL et la croissance cellulaire autonome (sans IL-3) induite par la CALR del52. Cependant, d’autres résidus que les tyrosines du récepteur pourraient aussi jouer un rôle dans l’induction des voies de signalisation de MPL par la CALR mutée [12].
Interaction MPL-CALR mutée : un espoir thérapeutique ?
Les chercheurs ont montré que l’interaction anormale CALR del52-MPL implique le domaine lectine de la CALR mutée et la N-glycosylation de sites spécifiques de MPL. Cependant, la présence d’un nombre minimal de charges positives dans l’extrémité C-ter de la protéine CALR mutée est nécessaire à son activité oncogénique. Cette activité est dépendante de la capacité de CALR del52 à activer la signalisation de MPL, indépendamment de la TPO, faisant intervenir la Y626 de MPL. Une meilleure caractérisation moléculaire de l’interaction entre la protéine CALR mutée et MPL pourrait ainsi permettre le développement de thérapies ciblées. ◊
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Vainchenker W, Kralovics R. Genetic basis and molecular pathophysiology of classical myeloproliferative neoplasms. Blood 2017 ; 129 : 667–79. [Google Scholar]
- James C, Ugo V, Le Couédic JP, et al. A unique clonal JAK2 mutation leading to constitutive signaling causes polycythaemia vera. Nature 2005 ; 434 : 1144–8. [Google Scholar]
- Klampfl T, Gisslinger H, Harutyunyan AS, et al. Somatic mutations of calreticulin in myeloprolifertaive neoplasms. N Engl J Med 2013 ; 369 : 2379–90. [Google Scholar]
- Nangalia J, Massie CE, Baxter EJ, et al. Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2. N Engl J Med 2013 ; 369 : 2391–405. [Google Scholar]
- Pikman Y, Lee BH, Mercher T, et al. MPLW515L is a novel somatic activating mutation in myelofibrosis with myeloid metaplasia. PLoS Med 2006 ; 3 : e270. [CrossRef] [PubMed] [Google Scholar]
- Marty C, Pecquet C, Nivarthi H, et al. Calreticulin mutants in mice induce an MPL-dependent thrombocytosis with frequent progression to myelofibrosis. Blood 2016 ; 127 : 1317–24. [Google Scholar]
- Chachoua I, Pecquet C, El-Khoury M, et al. Thrombopoietin receptor activation by myeloproliferative neoplasm associated calreticulin mutants. Blood 2016 ; 127 : 1325–35. [Google Scholar]
- Elf S, Abdelfattah NS, Baral AJ, et al. Defining the requirements for the pathogenic interaction between mutant calreticulin and MPL in MPN. Blood 2018 ; 131 : 782–6. [Google Scholar]
- Elf S, Abdelfattah NS, Chen E, et al. Mutant calreticulin requires both its mutant C-terminus and the thrombopoietin receptor for oncogenic transformation. Cancer Discov 2016 A ; 6 : 368–81. [CrossRef] [PubMed] [Google Scholar]
- Lum R, Ahmad S, Hong SJ, et al. Contributions of the lectin and polypeptide binding sites of calreticulin to its chaperone functions in vitro in cells. J Biol Chem 2016 ; 2 91 : 19631–41. [Google Scholar]
- Morita H, Tahara T, Matsumoto A, et al. Functional analysis of the cytoplasmic domain of the human Mpl receptor for tyrosine-phosphorylation of the signaling molecules, proliferation and differentiation. FEBS Lett 1996 ; 395 : 228–34. [CrossRef] [PubMed] [Google Scholar]
- Han L, Schubert C, Köhler J, et al. Calreticulin-mutant proteins induce megakaryocytic signaling to transform hematopoietic cells and undergo accelerated degradation and Golgi-mediated secretion. J Hematol Oncol 2016 ; 9 : 45. [CrossRef] [PubMed] [Google Scholar]
© 2019 médecine/sciences – Inserm
Liste des figures
 |
Figure 1 Interactions moléculaires de la CALR mutée avec MPL dans les NMP. Des mutations du gène de la CALR entraînent une perte du peptide signal KDEL de rétention dans le RE et le remplacement d’une extrémité C-ter acide par un domaine C-ter basique chargé positivement (C-ter ∆52 pb). La CALR del52 mutée (CALR mut) se fixe, via son domaine lectine, aux sites de glycosylation du domaine extracellulaire du récepteur de la thrombopoïétine (MPL). Ce site d’interaction est différent du site de liaison du ligand de MLP, la thrombopoïétine (TPO). L’interaction CALR mut-MPL a lieu dans le RE puis dans l’appareil de Golgi jusqu’à la membrane plasmique. L’extrémité C-ter ∆52 pb de la protéine mutée permet, grâce à sa forte charge positive, l’activation constitutive du MPL. Le signal est alors transduit via la tyrosine kinase JAK2 qui phosphoryle la tyrosine Y626 de MPL. Cela entraine le recrutement et l’activation constitutive d’effecteurs comme les facteurs de transcription STAT qui régulent l’expression de certains gènes, favorisant ainsi une prolifération cellulaire excessive, caractéristique des néoplasmes myéloprolifératifs. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




