Figure 1
Télécharger l'image originale
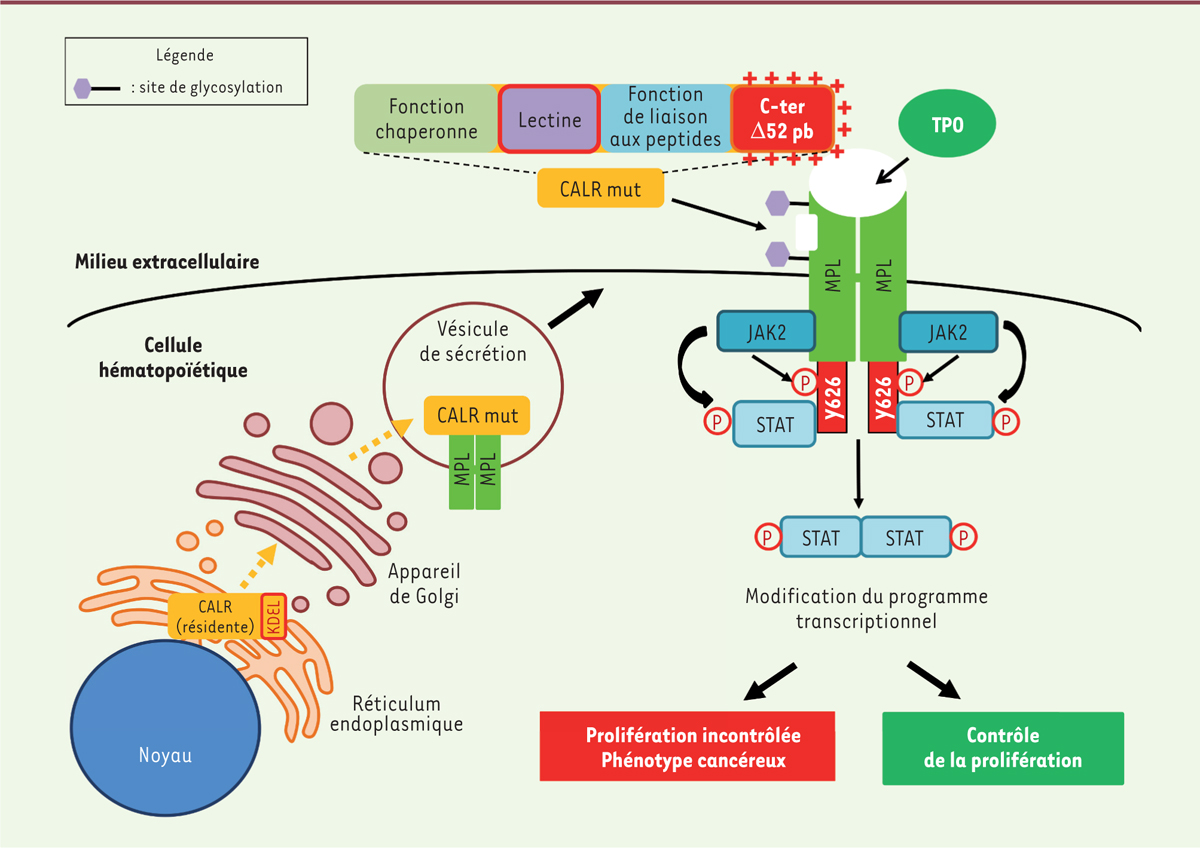
Interactions moléculaires de la CALR mutée avec MPL dans les NMP. Des mutations du gène de la CALR entraînent une perte du peptide signal KDEL de rétention dans le RE et le remplacement d’une extrémité C-ter acide par un domaine C-ter basique chargé positivement (C-ter ∆52 pb). La CALR del52 mutée (CALR mut) se fixe, via son domaine lectine, aux sites de glycosylation du domaine extracellulaire du récepteur de la thrombopoïétine (MPL). Ce site d’interaction est différent du site de liaison du ligand de MLP, la thrombopoïétine (TPO). L’interaction CALR mut-MPL a lieu dans le RE puis dans l’appareil de Golgi jusqu’à la membrane plasmique. L’extrémité C-ter ∆52 pb de la protéine mutée permet, grâce à sa forte charge positive, l’activation constitutive du MPL. Le signal est alors transduit via la tyrosine kinase JAK2 qui phosphoryle la tyrosine Y626 de MPL. Cela entraine le recrutement et l’activation constitutive d’effecteurs comme les facteurs de transcription STAT qui régulent l’expression de certains gènes, favorisant ainsi une prolifération cellulaire excessive, caractéristique des néoplasmes myéloprolifératifs.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




