| Issue |
Med Sci (Paris)
Volume 35, Number 5, Mai 2019
Modèles alternatifs
|
|
|---|---|---|
| Page(s) | 463 - 466 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2019079 | |
| Published online | 22 May 2019 | |
Crassostrea gigas, une huître au service de la recherche sur le cancer
The oyster Crassostrea gigas, a new model against cancer
1
Équipe soutenue par la fondation ARC, Ifremer, UMR 6539 CNRS-UBO-IRD-Ifremer, Laboratoire des sciences de l’environnement marin, 29280 Plouzané, France
2
Inserm U1180, Université Paris Sud, 5, rue JB Clément, 92296 Châtenay-Malabry, France
3
Inserm U1065, Centre méditerranéen de médecine moléculaire, 151, route St Antoine de Ginestière, 06204 Nice, France
*
charlotte.corporeau@ifremer.fr
L’effet Warburg est l’une des caractéristiques des cellules cancéreuses chez l’homme. C’est une véritable reprogrammation métabolique vers la glycolyse aérobie, permettant aux cellules cancéreuses de satisfaire leurs besoins énergétiques en fonction du microenvironnement qu’elles rencontrent au sein de la tumeur. De par son mode de vie, l’huître Crassostrea gigas possède des capacités particulières afin d’adapter son métabolisme aux changements extrêmes du milieu dans lequel elle se trouve. Elle est naturellement capable de reprogrammer son métabolisme vers l’effet Warburg. C. gigas représente ainsi un modèle d’intérêt pour étudier comment l’environnement peut contrôler l’effet Warburg dans des conditions qui ne pourraient être explorées chez des espèces modèles vertébrés.
Abstract
The Warburg effect is one of the hallmarks of cancer cells in humans. It is a true metabolic reprogramming to aerobic glycolysis, allowing cancer cells to meet their particular energy needs for growth, proliferation, and resistance to apoptosis, depending on the microenvironment they encounter within the tumor. We have recently discovered that the Crassostrea gigas oyster can naturally reprogram its metabolism to the Warburg effect. Thus, the oyster becomes a new invertebrate model useful for cancer research. Due to its lifestyle, the oyster C. gigas has special abilities to adapt its metabolism to the extreme changes in the environment in which it is located. The oyster C. gigas is therefore a model of interest to study how the environment can control the Warburg effect under conditions that could not be explored in vertebrate model species.
© 2019 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.

Crassostrea gigas, des capacités inédites d’adaptation
L’huître creuse Crassostrea gigas (Figure 1) est une espèce peuplant les écosystèmes marins. Elle est emblématique de la réussite économique aquacole du siècle dernier. Cet invertébré marin a une origine évolutive très ancienne de 500 millions d’années. C. gigas est un animal euryhalin et eurytherme, c’est-à-dire qu’il est capable de vivre dans des conditions de salinité et de température très variables. L’huître est en effet soumise quotidiennement à de grandes variations de son environnement, au rythme des marées, car elle vit fixée dans la zone côtière qui se découvre avec les marées (l’estran). Immergée, C. gigas respire et se nourrit dans les conditions de l’eau de mer (conditions de température, d’oxygène, de pH) ; émergée, elle se ferme. Elle subit alors de fortes températures (dues aux radiations solaires et à l’air) et est privée d’oxygène pendant plusieurs heures. L’estran est ainsi considéré comme un milieu extrême.
 |
Figure 1. Jeunes huîtres creuses Crassostrea gigas. |
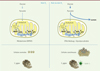 |
Figure 2. Crassostrea gigas, un nouveau modèle de l’effet Warburg. En présence d’oxygène, les cellules normales respirent : elles utilisent le pyruvate issu de la glycolyse pour produire leur ATP via les phosphorylations oxydatives (OXPHOS). Les cellules cancéreuses, elles, sont capables de reprogrammer leur métabolisme en fonction de leur microenvironnement : indépendamment de la présence ou non en oxygène, elles respirent toujours et convertissent une fraction importante de leur pyruvate en lactate : c’est l’effet Warburg (ou glycolyse aérobie). Nous proposons l’huître creuse comme un nouveau modèle pour la recherche contre le cancer. En effet, Crassostrea gigas peut naturellement reprogrammer son métabolisme vers l’effet Warburg lorsqu’elle est infectée par le virus OsHV-1 (ostreid herpes virus-1). L’effet Warburg invertébré est maintenant prêt à être exploré pour identifier de nouvelles voies d’attaque contre l’effet Warburg de la cellule cancéreuse. AcétylCoA : acétyl coenzyme A ; CR : chaîne respiratoire ; NAD : nicotinamide adénine dinucléotide ; FAD : flavine adénine dinucléotide. |
De par son mode de vie, l’huître C. gigas possède des capacités particulières afin d’adapter son métabolisme aux changements extrêmes du milieu dans lequel elle se trouve. Contrairement à l’homme, C. gigas est en effet capable de maintenir ses activités physiologiques dans de larges gammes de facteurs environnementaux : la température, entre - 2 °C et 38 °C ; l’oxygène, de 0 % à 100 % ; la salinité de l’eau de mer, entre 10 et 35 ‰ ; le pH, de 6,0 à 8,1 (mesuré dans sa cavité interne en exondation). Elle représente donc un modèle clé pour les études visant à comprendre les mécanismes de régulation du métabolisme cellulaire par l’environnement.
En 2012, le génome de C. gigas a été décrypté. Il contient 28 027 gènes codants (l’homme en compte environ 25 000) dont 30 % (soit 8 654 gènes) sont strictement spécifiques de C. gigas [1]. Alors que ces gènes inconnus chez l’homme pourraient révéler de nouvelles fonctions chez C. gigas au mode de vie si particulier, certaines caractéristiques du génome de l’huître constituent déjà une base moléculaire permettant de comprendre son adaptation à l’environnement : une expansion spécifique du nombre de gènes liés aux activités chaperones, à la régulation de l’apoptose, aux activités anti-oxydantes, aux réponses cytokinique et inflammatoire. L’huître possède ainsi 48 gènes dont les produits interfèrent avec les processus d’apoptose (le génome humain en contient moins d’une dizaine), reflétant probablement ses capacités inédites d’adaptation et de survie.
Un effet Warburg chez l’huître
Au siècle dernier, Otto Warburg avait observé que les cellules cancéreuses avaient une caractéristique métabolique commune, qui fut désignée par la suite effet Warburg [2]. Il s’agit d’une véritable reprogrammation métabolique vers la glycolyse aérobie au cours de laquelle les cellules respirent et produisent simultanément du lactate à partir du glucose et du pyruvate [3, 4] (→).
(→) Voir les Synthèses de M. Cordier-Bussat et al., m/s n° 8-9, août-septembre 2018, page 701, et de J. Razungles et al., m/s n° 11, novembre 2013, page 1026
L’effet Warburg facilite le transfert d’énergie pour l’élaboration de nouveaux constituants cellulaires, tels que des nucléotides, des acides aminés et des lipides. Ces éléments néo-synthétisés permettront aux cellules cancéreuses de satisfaire leurs besoins énergétiques particuliers, pour leur croissance, leur prolifération, ainsi que pour leur résistance à l’apoptose, en fonction du microenvironnement qu’elles rencontrent au sein de la tumeur. Ce microenvironnement tumoral peut être considéré comme un milieu extrême : il peut être hypoxique, acide (résultat du métabolisme fermentaire), et présenter des déplétions sévères en nutriments. La reprogrammation métabolique vers l’effet Warburg permet ainsi aux cellules de s’adapter aux contraintes métaboliques dues au microenvironnement de la tumeur.
C’est à la faveur d’une recherche sur la dissémination d’une maladie virale dans les élevages d’huîtres que nous avons découvert, en 2014, que l’huître creuse C. gigas pouvait, comme les cellules cancéreuses, reprogrammer son métabolisme vers l’effet Warburg [5]. Chez l’homme, une telle reprogrammation du métabolisme vers l’effet Warburg peut être induite par quatre virus oncogéniques : le papillomavirus, le cytomégalovirus, l’herpès virus du sarcome de Kaposi et le virus de l’hépatite C. Chez l’huître, cette reprogrammation est induite en réponse à l’infection par le virus marin OsHV-1 (ostreid herpesvirus-1), lorsque le métabolisme de l’huître s’adapte au virus pour permettre sa réplication [5, 6]. Cela montre donc que l’effet Warburg n’est pas seulement une caractéristique spécifique des cellules cancéreuses, et l’huître creuse est devenue aujourd’hui un nouveau modèle permettant de l’explorer (Figure 2). Le génome du virus OsHV-1 a été séquencé : 56 % des cadres de lecture (ORF, open reading frame) identifiés codent des protéines dont la fonction reste encore inconnue. On peut donc envisager l’existence potentielle d’autant de mécanismes encore inexplorés chez l’homme impliquant un virus dans les régulations métaboliques des cellules qu’il infecte.
L’huître C. gigas, un modèle pour décrypter des mécanismes originaux
Le jeûne comme initiateur de l’effet Warburg
De par sa capacité à vivre dans un milieu hyper dynamique, l’huître C. gigas est un modèle d’intérêt pour étudier comment l’environnement peut contrôler l’effet Warburg dans des conditions qui ne pourraient être explorées chez des espèces modèles vertébrés. L’une des originalités de C. gigas est, par exemple, sa capacité de tolérance aux conditions de jeûne prolongé. Elle peut en effet survivre à jeun plus de 6 mois [7], un état nutritionnel qui ne peut être obtenu dans aucun modèle vertébré pour lesquels seuls de courts cycles de restriction alimentaire peuvent être étudiés (de 24 à 48 heures). Chez la souris, les périodes de jeûne, même courtes, se traduisent par un retard de croissance de la tumeur et sensibilisent certains types de cellules cancéreuses à la chimiothérapie. L’huître C. gigas, par sa capacité à résister à de plus longues périodes sans apport nutritionnel, pourrait ainsi représenter un modèle original pour étudier comment une période de jeûne prolongé peut modifier la réponse métabolique d’une cellule, en particulier en favorisant l’effet Warburg.
VDAC, régulateur de l’effet Warburg
Dans la cellule cancéreuse, l’une des protéines clés dans la mise en place de l’effet Warburg est la protéine mitochondriale VDAC (voltage-dependent anion channel), dont la fonction est dérégulée dans de nombreux cancers très agressifs. VDAC est un senseur de multiples stress (oxydant, hypoxique, calcique, lipidique et pH) qui permet l’adaptation du fonctionnement mitochondrial au cours de l’effet Warburg dans la cellule cancéreuse. Il assure en effet le transport des ions et des petits métabolites, tels que l’ADP et l’ATP, de part et d’autre de la membrane de la mitochondrie [8]. Selon le contexte dans lequel il se trouve, VDAC se lie de façon dynamique à l’hexokinase, la première enzyme de la voie glycolytique, et en régule le fonctionnement. VDAC joue aussi un rôle clé dans la survie de la cellule cancéreuse. Il contrôle les mécanismes d’apoptose via la régulation du calcium intracellulaire et en interagissant avec les protéines anti-apoptotiques de la famille Bcl-2 (B cell lymphoma 2) [9]. Contrairement à l’homme qui en possède trois isoformes, C. gigas ne possède qu’un seul gène codant VDAC qui, surexprimé pendant l’effet Warburg, présente toutes les caractéristiques fonctionnelles des VDAC humains [6]. L’huître creuse apparaît donc comme une espèce modèle pour étudier la fonction d’un VDAC ancestral dans l’effet Warburg.
Les kinases et l’effet Warburg
L’effet Warburg résulte en partie d’une dérégulation des voies de signalisation énergétique qui contrôlent le métabolisme cellulaire selon l’environnement, en particulier de la cellule cancéreuse. Bien que C. gigas présente des capacités d’adaptation à l’environnement tout à fait inédites, les voies de signalisation énergétique sont parfaitement conservées entre l’huître et l’homme [10]. Le kinome1 de C. gigas est très comparable au kinome humain et les sites de régulation des kinases sont totalement conservés.
Chez l’homme, la kinase AMPK (AMP-activated protein kinase) joue un rôle fondamental dans le contrôle du métabolisme énergétique. Son activation, par exemple par des médicaments antidiabétiques, inhibe l’effet Warburg et la croissance tumorale in vivo. Des études récentes suggèrent également un rôle pour des pseudokinases dans l’effet Warburg. Les pseudokinases résultent de la transcription de pseudogènes, d’un épissage alternatif, ou de la coupure d’une protéine kinase entière. Elles joueraient le rôle de leurre intracellulaire, en captant les substrats des kinases, dérégulant ainsi le contrôle du métabolisme. Comme chez l’homme, l’AMPK contrôle le métabolisme énergétique de C. gigas. Or, nous avons montré que C. gigas exprime deux pseudokinases de l’AMPK [11]. L’huître creuse se révèle donc un modèle innovant pour étudier le rôle d’AMPK et ses pseudokinases dans l’effet Warburg.
L’huître creuse, un nouveau modèle pour la recherche contre le cancer
Chez l’homme, la cellule cancéreuse présente huit caractéristiques complexes : une prolifération soutenue, un échappement aux inhibiteurs de croissance, une résistance à l’apoptose, une capacité prolongée de réplication, l’induction de l’angiogenèse, une capacité de migration et d’invasion, une résistance à l’immunité et la reprogrammation métabolique. L’effet Warburg constitue donc aujourd’hui une nouvelle cible thérapeutique prometteuse comme une voie d’attaque ou de contrôle du cancer. Caenorhabditis elegans est considéré comme une espèce modèle de la tumorigénèse et aujourd’hui, C. gigas se révèle être un modèle prometteur permettant d’identifier de nouvelles voies interférant avec l’effet Warburg dans la cellule cancéreuse. La force de ce nouveau modèle est d’utiliser les capacités inédites d’adaptation à l’environnement de C. gigas pour comprendre comment l’effet Warburg peut être reprogrammé par l’environnement.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Zhang G, Fang X, Guo X, et al. The oyster genome reveals stress adaptation and complexity of shell formation. Nature. 2012 ; 490 : 49–54. [CrossRef] [PubMed] [Google Scholar]
- Warburg O.. On the origin of cancer cells. Science. 1956 ; 123 : 309–314. [Google Scholar]
- Cordier-Bussat M, Thibert C, Sujobert P, et al. Même l’effet Warburg est oxydable : coopération métabolique et développement tumoral. Med Sci (Paris). 2018 ; 34 : 701–708. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Razungles J, Cavaillès V, Jalaguier S, et al. L’effet Warburg : de la théorie du cancer aux applications thérapeutiques en cancérologie. Med Sci (Paris). 2013 ; 29 : 1026–1033. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Corporeau C, Tamayo D, Pernet F, et al. Proteomic signatures of the oyster metabolic response to herpesvirus OsHV-1 μVar infection. J Proteomics. 2014 ; 109 : 176–187. [CrossRef] [PubMed] [Google Scholar]
- Delisle L, Fuhrmann M, Quéré C, et al. The voltage-dependent anion channel (VDAC) of pacific oysters Crassostrea gigas is upaccumulated during infection by the Ostreid Herpesvirus-1 (OsHV-1): an indicator of the Warburg effect. Mar Biotechnol. 2018 ; 20 : 87–97. [Google Scholar]
- Whyte JNC, Englar JR, Carswell BL. Biochemical composition and energy reserves in Crassostrea gigas exposed to different levels of nutrition. Aquaculture. 1990 ; 90 : 157–172. [Google Scholar]
- Martel C, Wang Z, Brenner C. VDAC phosphorylation, a lipid sensor influencing the cell fate. Mitochondrion. 2014 ; 19 : 69–77. [CrossRef] [PubMed] [Google Scholar]
- Mazure NM. VDAC in cancer. Biochim Biophys Acta Bioenerg. 2017 ; 1858 : 665–673. [CrossRef] [PubMed] [Google Scholar]
- Epelboin Y, Quintric L, Guévélou E, et al. The kinome of pacific oyster Crassostrea gigas, its expression during development and in response to environmental factors. PLoS One. 2016 ; 11 : e0155435. [CrossRef] [PubMed] [Google Scholar]
- Guévélou E, Huvet A, Sussarellu R, et al. Regulation of a truncated isoform of AMP-activated protein kinase α (AMPKα) in response to hypoxia in the muscle of Pacific oyster Crassostrea gigas. J Comp Physiol B. 2013 ; 183 : 597–611. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Jeunes huîtres creuses Crassostrea gigas. |
| Dans le texte | |
 |
Figure 2. Crassostrea gigas, un nouveau modèle de l’effet Warburg. En présence d’oxygène, les cellules normales respirent : elles utilisent le pyruvate issu de la glycolyse pour produire leur ATP via les phosphorylations oxydatives (OXPHOS). Les cellules cancéreuses, elles, sont capables de reprogrammer leur métabolisme en fonction de leur microenvironnement : indépendamment de la présence ou non en oxygène, elles respirent toujours et convertissent une fraction importante de leur pyruvate en lactate : c’est l’effet Warburg (ou glycolyse aérobie). Nous proposons l’huître creuse comme un nouveau modèle pour la recherche contre le cancer. En effet, Crassostrea gigas peut naturellement reprogrammer son métabolisme vers l’effet Warburg lorsqu’elle est infectée par le virus OsHV-1 (ostreid herpes virus-1). L’effet Warburg invertébré est maintenant prêt à être exploré pour identifier de nouvelles voies d’attaque contre l’effet Warburg de la cellule cancéreuse. AcétylCoA : acétyl coenzyme A ; CR : chaîne respiratoire ; NAD : nicotinamide adénine dinucléotide ; FAD : flavine adénine dinucléotide. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




