| Issue |
Med Sci (Paris)
Volume 34, Number 6-7, Juin–Juillet 2018
Numérique et santé
|
|
|---|---|---|
| Page(s) | 590 - 594 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20183406020 | |
| Published online | 31 July 2018 | |
Suivi et survie des patients atteints de cancer du poumon par web-application
Web-mediated follow-up and prognosis in lung cancer patients
1
Institut inter-régional de cancérologie Jean Bernard, 9, rue Beauverger, 72000 Le Mans, France
2
CORIA UMR 6614-Normandie université, CNRS - université et INSA de Rouen, campus universitaire du Madrillet, F-76800 Saint-Étienne du Rouvray, France
La e-santé est à la mode, mais les éléments cliniques démontrant son utilité sont rares et se limitent à de la transmission de données relatant des symptômes, sans analyse spécifique. La théorie du chaos est applicable à la dynamique du cancer. Elle apporte des possibilités d’utilisation de ses propriétés pour développer des outils pratiques de surveillance pertinents et validés pour les patients. La théorie du chaos déterministe est applicable à la compréhension de la dynamique tumorale du fait des interactions entre les cellules tumorales, endothéliales et immunitaires. La théorie de l’observabilité est une de ses propriétés qui suggère que le suivi de l’hôte (le patient, par ses symptômes et son poids) est une variable puissante pour évaluer la dynamique de la maladie et son impact. Le suivi intensif et l’analyse des symptômes des patients pour détecter des récidives et des complications cliniques par une web-application2 (MoovcareTM) ont démontré leur intérêt chez près de 300 patients dans 4 études prospectives dont 1 essai pilote montrant un bénéfice de 27 % en survie à 1 an, et un essai randomisé de phase 3 avec un bénéfice de 26 % de survie à 1 an, par rapport à un suivi classique. Six autres études de suivi intensif montrent des résultats favorables en oncologie pour un total de plus de 2 000 patients randomisés.
Abstract
E-health is fashionable, but clinical evidence of its usefulness is rare and limited to reporting symptoms without specific analysis. The Chaos theory is applicable to the dynamics of the cancer and brings possibilities of use of its properties to develop useful, relevant and validated tools for cancer patients monitoring. The Chaos theory is applicable to the understanding of tumor dynamics due to interactions between tumor, host, endothelial and immune cells. Observability theory is one of its properties which suggests that the follow-up of the host (the patient via its symptoms and its weight) is a strong variable to evaluate the dynamics of the disease and its impact. Intensive follow-up and analysis of patients’ symptoms to detect recurrences and clinical complications via a web-application (MoovcareTM) demonstrated its interest in nearly 300 patients in 4 prospective studies including 1 pilot trial showing a benefit of 27% survival rate at 1 year, and a randomized phase 3 trial with a 26% 1-year survival improvement as compared to a conventional follow-up. Six other intensive follow-up studies show favorable results in oncology for a total of more than 2,000 randomized patients.
Les équations de prédation de Lotka-Volterra, désignées sous le terme de « modèle proie-prédateur », sont un couple d’équations différentielles non-linéaires du premier ordre, couramment utilisées pour décrire la dynamique de systèmes biologiques dans lesquels un prédateur et sa proie interagissent.
© 2018 médecine/sciences – Inserm

Théorie du chaos et cancer
La prédiction individuelle de l’évolution clinique des patients atteints de cancer est difficile car le système cancer-patient est, en fait, un système dynamique dans lequel la croissance des cellules cancéreuses est fortement modulée par les cellules normales, les cellules endothéliales et les cellules immunitaires [1–4]. Cette modulation de la croissance des cellules tumorales par les cellules environnantes est démontrée par les différences que l’on observe entre la croissance des cellules in vitro (en l’absence de cellules environnantes) et celle dans l’organisme (dans lequel les cellules environnantes limitent la division des cellules souches cancéreuses) [5].
Ces interactions entre ces différentes cellules conduisent à une dynamique de la croissance tumorale régie par la théorie du chaos, c’est-à-dire imprévisible à long terme car très sensible aux conditions initiales. Cela signifie qu’une petite variation de l’un des paramètres de prolifération/mort cellulaire d’une des quatre composantes cellulaires (cellules tumorales, normales, endothéliales et immunitaires) peut infléchir la dynamique du système (c’est le cas de la transition [switch] angiogénique, à un stade précoce, jusqu’au phénotype métastatique, à un stade plus tardif) et donc la croissance tumorale [2]. Les modèles mathématiques chaotiques se rapprochant le plus du modèle « cancer » sont les modèles en compétition et les modèles proie/prédateur2. Ces modèles sont imprévisibles à long terme : il suffit d’un changement minime d’un paramètre pour modifier totalement la dynamique du système. La théorie de l’observabilité de ces modèles démontre en revanche que la variable la plus pertinente à observer, pour mieux évaluer la dynamique de ce type de système, est la proie (c’est-à-dire les cellules hôtes). Dans notre modèle à quatre populations, c’est la population de cellules normales (ou hôtes) qui doit fournir la meilleure observabilité de la dynamique du système cancer-patient [2, 6]
Applications cliniques
Pour valider ce modèle, qui suggère que les cellules hôtes (la proie) représentent une variable importante constituant la meilleure observabilité de la dynamique d’un cancer, une application internet permettant au patient de rapporter, chaque semaine, ses symptômes et son poids dans le but de détecter une récidive dès les premiers signes, a été développée dans notre laboratoire.
Cette application, appelée MoovcareTM, analyse la dynamique et l’association des symptômes au fil du temps. Elle déclenche des alertes spécifiques pour le médecin (rechute, complications cliniquement pertinentes de type embolie pulmonaire, sepsis, etc.) lorsque certaines conditions sont réunies. L’assistante du médecin contacte alors le patient par téléphone, afin de vérifier l’absence d’erreur de saisie et la présence effective des symptômes. Le médecin décide ensuite de convoquer, ou non, le patient en consultation pour une prise en charge rapide. Le choix du cancer du poumon dans l’élaboration de l’application a été guidé par l’absence de standard de surveillance des stades avancés de ce cancer, 90 % des rechutes étant symptomatiques et, plus généralement, les rechutes, en oncologie, apparaissant rarement le jour de la visite ! En revanche, les patients symptomatiques attendent souvent leur scanner prévu dans les semaines ou mois à venir avant de consulter. Ils ne sont pas enclins à aller d’eux-mêmes voir le cancérologue, afin de ne pas entrer de nouveau dans le circuit des thérapies souvent lourdes qu’ils viennent de quitter.
Deux études prospectives incluant 42 et 43 patients à haut risque de rechute ont été réalisées, afin de valider un algorithme définissant les règles de déclenchement d’alerte fondées sur l’analyse de 6 puis 11 symptômes. Les sensibilités de la méthode ont été respectivement de 86 et 100 %, et les alertes sont apparues en moyenne six semaines avant les dates prévues (tous les 3 à 4 mois) pour la réalisation des scanners et les visites systématiques [7,8]. Une étude pilote réalisée chez 98 patients, non randomisée et mono-centrique, avait suggéré un bénéfice de la survie de 27 % à 1 an chez les patients utilisant l’application par rapport à une cohorte historique [9].
Étude de phase 3
Une étude randomisée de phase 3, multicentrique, a été réalisée. Elle évaluait la survie globale entre (1) un suivi hebdomadaire par la web-application (bras expérimental), dans laquelle les patients transmettaient, entre les consultations programmées, leurs symptômes à leur oncologue (Figure 1), et (2) un suivi clinique classique avec scanner systématique (tous les 3 à 6 mois ou plus souvent, à la discrétion de l’investigateur - bras standard). Les patients à haut risque de rechute non évolutifs après traitement ont été inclus dans l’étude. Un traitement de maintien, ou par des inhibiteurs de tyrosine kinase (TKI) était autorisé. Un accès à internet était requis.
 |
Figure 1. Formulaire que remplit le patient chaque semaine sur la web-application MoovcareTM. Une fenêtre de texte libre permet au patient de transmettre des symptômes autres que ceux des menus du formulaire. |
Dans le bras expérimental, un message d’alerte était envoyé au médecin si des critères d’association ou de dynamique de symptômes étaient remplis (perte de poids, nouveaux signes symptomatiques généraux, nodule sous-cutané, dysphonie, etc.) (Figure 2). Un bilan d’imagerie était alors rapidement prescrit et des soins de support précoces étaient réalisés selon la symptomatologie. La qualité de vie et l’état général à la rechute ont également été examinés.
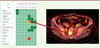 |
Figure 2. Écran du médecin montrant les résultats des symptômes du patient. Cas d’une récidive osseuse et sus-claviculaire confirmée par tomographie par émission de positons (TEP) s’étant manifestée par des douleurs, une asthénie et une anorexie débutante. |
Cent trente-trois patients ont été randomisés. Cent vingt et un ont pu être inclus dans l’analyse en intention de traiter (ITT). La survie médiane était de 19 mois versus 12 mois, en faveur du bras expérimental (hazard ratio HR = 0,325 ; IC à 95 % : 0,157-0,672, p = 0,0014) (Figure 3). À la rechute, 76 % des patients du bras expérimental avaient conservé un bon ou un très bon état général versus 33 % dans le bras standard (p < 0,001). La qualité de vie était significativement améliorée dans le bras expérimental et le nombre d’imageries par scanner et tomographie par émission de positons a été divisé par deux par patient et par an [10].
 |
Figure 3. A. Survie globale des patients de l’étude pilote non-randomisée. B. Survie globale des patients de l’étude de phase 3 randomisée. Les 2 études retrouvent un bénéfice en survie globale en faveur du suivi par web-application. |
Les bénéfices observés dans l’étude ont été attribués aux traitements des récidives, qui ont été délivrés plus précocement et de façon plus intensive chez des patients dont l’état général permettait des thérapeutiques plus optimales, ainsi qu’à la détection précoce d’événements intercurrents dangereux (embolie pulmonaire, sepsis), et à la réalisation de soins de support plus précoces et mieux suivis, grâce au formulaire de l’application permettant au patient de décrire l’évolution de ses symptômes.
Plusieurs autres études randomisées de suivi intensif, qu’il repose ou non sur l’utilisation d’applications e-santé, suggèrent un fort bénéfice clinique sur l’amélioration des symptômes et/ou en survie globale [11–16] (Tableau I). Elles n’étaient cependant pas toutes multicentriques, et aucune n’avait évalué la survie globale. Ce sont cependant déjà plus de 2 000 patients qui ont été impliqués dans ce type d’études de surveillance.
Études de surveillance intensive, avec ou sans applications de e-santé. QoL : qualité de vie.
Conclusion
Les éléments cliniques valident le concept mathématique d’observabilité de l’hôte suggéré par les modèles mathématiques de dynamique tumorale chaotique, comme les modèles proie/prédateur ou les modèles en compétition. Le suivi intensif de l’hôte (c’est-à-dire le patient et ses symptômes) par une web-application améliore ainsi la survie du patient, en permettant l’établissement rapide d’un traitement intensif de la rechute et un maintien d’une qualité de vie la plus élevée possible, par la réalisation de soins de support plus intenses et personnalisés.
Perspectives
La place du suivi clinique intensif par e-santé combiné à des suivis biologiques (comme le suivi de l’ADN circulant) ou par imagerie fonctionnelle ou métabolique, doit être évaluée afin de compléter et optimiser la surveillance des patients. D’autres études portant sur des cancers différents et sur certaines pathologies chroniques symptomatiques sont en cours. L’évaluation clinique de ces outils est fondamentale. Mais une réflexion sur les méthodes d’évaluation nécessite d’être initiée afin d’accélérer le développement de ces outils, actuellement évalués comme médicaments bien qu’ils ne le soient pas…
Liens d’intérêt
F. Denis déclare avoir des liens durables avec l’entreprise Sivan Innovation et déclare participer à des interventions ponctuelles (conférences, congrès) pour les entreprises Takeda, Novartis, Merck, Chugai, Roche, Ipsen.
Les équations de prédation de Lotka-Volterra, désignées sous le terme de « modèle proie-prédateur », sont un couple d’équations différentielles non-linéaires du premier ordre, couramment utilisées pour décrire la dynamique de systèmes biologiques dans lesquels un prédateur et sa proie interagissent.
Références
- Letellier C, Denis F, Aguirre LA. What can be learned from a chaotic cancer model? J Theor Biol 2013 ; 322 : 7–16. [CrossRef] [PubMed] [Google Scholar]
- Viger L, Denis F, Rosalie M, Letellier C. A cancer model for the angiogenic switch. J Theor Biol 2014 ; 360 : 21–33. [CrossRef] [PubMed] [Google Scholar]
- Denis F, Letellier C. Chaos theory: a fascinating concept for oncologist. Cancer Radiother 2012 ; 16 : 230–6. [CrossRef] [PubMed] [Google Scholar]
- Merlo LM, Pepper JW, Reid BJ, Maley CC. Cancer as an evolutionary and ecological process. Nat Rev Cancer 2006 ; 6 : 924–35. [CrossRef] [PubMed] [Google Scholar]
- Chan KS, Koh CG. Mitosis-targeted anti-cancer therapies: where they stand. Cell Death Dis 2012 ; 3 : e411. [CrossRef] [PubMed] [Google Scholar]
- Letellier C, Aguirre LA, Maquet J. Relation between observability and differential embeddings for nonlinear dynamics. Phys Rev E Stat Nonlin Soft Matter Phys 2005 ; 71 : 066213. [CrossRef] [Google Scholar]
- Denis F, Viger L, Charron A, et al. Detecting lung cancer relapse using self-evaluation forms weekly filled at home: the sentinel follow-up. Support Care Cancer 2014 ; 22 : 79–85. [CrossRef] [PubMed] [Google Scholar]
- Denis F, Viger L, Charron A, et al. Detection of lung cancer relapse using self-reported symptoms transmitted via an Internet web-application: pilot study of the sentinel follow-up. Support Care Cancer 2014 ; 22 : 1467–73. [CrossRef] [PubMed] [Google Scholar]
- Denis F, Yossi S, Septans AL, et al. Improving survival in patient treated for a lung cancer using self-evaluated symptoms reported via a web-application. Am J Clin Oncol 2017 ; 40 : 464–9. [CrossRef] [Google Scholar]
- Denis F, Lethrosne C, Pourel N, et al. Randomized trial comparing a web-mediated follow-up to routine surveillance in lung cancer patients. J Natl Cancer Inst 2017 ; 1 : 109(9). doi: 10.1093/jnci/djx029. [Google Scholar]
- Detmar SB, Muller MJ, Schornagel JH, et al. Health-related quality-of-life assessments and patient-physician communication: a randomized controlled trial. JAMA 2002 ; 288 : 3027–34. [CrossRef] [PubMed] [Google Scholar]
- Berry DL, Hong F, Halpenny B, et al. Electronic self-report assessment for cancer and self-care support: Results of a multicenter randomized trial. J Clin Oncol 2014 ; 32 : 199–205. [CrossRef] [PubMed] [Google Scholar]
- Strasser F, Blum D, von Moos R, et al. The effect of real-time electronic monitoring of patient-reported symptoms and clinical syndromes in outpatient workflow of medical oncologists: E-MOSAIC, a multicenter cluster-randomized phase III study (SAKK 95/06). Ann Oncol 2016 ; 27 : 324–32 [CrossRef] [PubMed] [Google Scholar]
- Bakitas MA, Tosteson TD, Li Z, et al. Early versus delayed initiation of concurrent palliative oncology care: patient outcomes in the ENABLE III randomized controlled trial. J Clin Oncol 2015 ; 33 : 1438–45. [CrossRef] [PubMed] [Google Scholar]
- Basch E, Deal AM, Kris MG, et al. Symptom monitoring with patient-reported outcomes during routine cancer treatment: a randomized controlled trial. J Clin Oncol 2015 ; 34 : 557–65. [CrossRef] [PubMed] [Google Scholar]
- Temel JS, Greer JA, Muzikansky A, et al. Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med 2010 ; 363 : 733–42. [CrossRef] [PubMed] [Google Scholar]
Liste des tableaux
Études de surveillance intensive, avec ou sans applications de e-santé. QoL : qualité de vie.
Liste des figures
 |
Figure 1. Formulaire que remplit le patient chaque semaine sur la web-application MoovcareTM. Une fenêtre de texte libre permet au patient de transmettre des symptômes autres que ceux des menus du formulaire. |
| Dans le texte | |
 |
Figure 2. Écran du médecin montrant les résultats des symptômes du patient. Cas d’une récidive osseuse et sus-claviculaire confirmée par tomographie par émission de positons (TEP) s’étant manifestée par des douleurs, une asthénie et une anorexie débutante. |
| Dans le texte | |
 |
Figure 3. A. Survie globale des patients de l’étude pilote non-randomisée. B. Survie globale des patients de l’étude de phase 3 randomisée. Les 2 études retrouvent un bénéfice en survie globale en faveur du suivi par web-application. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




