| Issue |
Med Sci (Paris)
Volume 34, Number 2, Février 2018
|
|
|---|---|---|
| Page(s) | 117 - 120 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/20183402005 | |
| Published online | 16 February 2018 | |
Nouvelle
HTLV-1 et cellules dendritiques
Une relation en quête de maturation
HTLV-1 and dendritic cells: a relation-ship in search of maturation
Centre international de recherche en infectiologie, Équipe oncogenèse rétrovirale, Inserm U1111 - université Claude Bernard Lyon 1, CNRS, UMR5308, École Normale Supérieure de Lyon, Université Claude Bernard Lyon 1, 46, allée d’Italie, F-69007, Lyon, France
Les cellules dendritiques (CD) sont des cellules immunitaires qui jouent le rôle de sentinelles dans notre organisme. Présentes au niveau de la peau, des muqueuses et dans le sang, elles permettent la reconnaissance rapide des agents pathogènes lors d’une infection bactérienne ou virale. Elles entreprennent alors un processus de maturation et migrent vers les organes lymphoïdes secondaires afin d’activer une réponse lymphocytaire spécifique de l’agent microbien. Elles jouent de ce fait un rôle important dans la mise en place d’une réponse immunitaire.
Le virus HTLV-1 (human T-cell leukemia/ lymphoma virus type 1) est l’agent étiologique de la leucémie/lymphome des cellules T de l’adulte (ou adult T-cell leukemia/lymphoma, ATLL) et de la paraparésie spastique tropicale/myélopathie associée à ce virus (ou HTLV-1 associated myelopathy/tropical spastic paraparesis, HAM-TSP)1. Ce virus, qui infecte 5 à 10 millions de personnes dans le monde, est transmis par voie sanguine ou sexuelle et par l’allaitement prolongé du nourrisson [1]. Chez les individus infectés, le génome viral est majoritairement retrouvé in vivo dans les lymphocytes T CD4+. Pourtant, in vitro, les cellules dendritiques sont plus susceptibles à l’infection productive par HTLV-1 que les lymphocytes autologues [2]. Localisées in vivo dans les muqueuses génitales, intestinales ou dans le sang, les cellules dendritiques se retrouvent potentiellement en étroite interaction avec les cellules lymphocytaires infectées lors de la primo-infection. Il est par ailleurs intéressant de noter que ces cellules contribuent à la propagation du VIH-1 (virus de l’immunodéficience humaine de type 1), un rétrovirus proche d’HTLV-1, au sein de la population lymphocytaire [3]. Au vu de la diversité des cellules dendritiques dans l’organisme [4], de leur rôle dans l’établissement de la réponse immunitaire, et des différentes voies d’entrées d’HTLV-1 [1], nous avons examiné si tous les sous-types de cellules dendritiques étaient similairement sensibles à l’infection par l’HTLV-1, et si ces sous-types contribuaient de manière équivalente à la dissémination du virus dans l’organisme. Ces travaux ont fait l’objet d’une publication récente dans la revue PLOS Pathogens [5].
Certains sous-types de cellules dendritiques sont résistants à l’infection par HTLV-1
Les populations de cellules dendritiques humaines des muqueuses et du sang sont rares in vivo et difficiles à obtenir. Pour pallier ces difficultés, l’utilisation de cellules dendritiques dérivées de monocytes (les MDDC) constitue une alternative. L’utilisation de différents cocktails de cytokines permet ainsi de différencier, in vitro, les monocytes primaires en cellules dendritiques immatures (IL-4 [interleukin-4]-DC), cellules dendritiques tolérogènes (TGF-β [transforming growth factor-β]-DC) ou cellules dendritiques inflammatoires (IFN-α [interferon-α]-DC). Ces trois populations miment respectivement les cellules dendritiques myéloïdes du sang, les cellules dendritiques des muqueuses, et celles résidant au niveau des sites d’inflammation (Figure 1). Les IL-4-DC et TGF-β-DC présentent un phénotype immature, avec une faible expression des marqueurs de surface CD86 (ou B7-2), CD40 (deux protéines de costimulation exprimées par les cellules présentatrices d’antigènes) et HLA-DR (complexe majeur d’histocompatibilité de classe II), par opposition aux IFN-α-DC qui expriment fortement ces marqueurs. Pour évaluer leur susceptibilité à l’infection virale, les cellules dendritiques ainsi générées in vitro ont été mises en culture avec des cellules lymphocytaires infectées par HTLV-1. En effet, seul un contact étroit entre une cellule infectée et une cellule cible permet d’établir l’infection de la cellule cible, le virus libre étant très peu infectieux [6] ( ).
).
( )Voir la Synthèse de G Rizkallah, m/s n° 6-7, juin-juil-let 2015, page 629
)Voir la Synthèse de G Rizkallah, m/s n° 6-7, juin-juil-let 2015, page 629
L’infection des cellules dendritiques a été évaluée d’une part, par la présence de l’ADN proviral (ADN double brin intégré dans le génome cellulaire) et, d’autre part, en suivant au cours du temps l’accumulation de protéines virales dites structurales (comme la protéine de matrice p19) ou régulatrices (comme Tax, absente de la particule virale). Ces méthodes ont permis de mettre en évidence une infection effective des IL-4-DC, mais pas des cellules TGF-β-DC et IFN-α-DC, suggérant que ces deux dernières sont résistantes à l’infection. La résistance à l’infection des IFN-α-DC n’est pas liée à une diminution d’expression par les cellules des récepteurs du virus tels que NRP-1/ BDCA-4 (neuropilin-1) et DC-SIGN (dendritic cell-specific intercellular adhesion molecule-3 grabbing non-integrin). En effet, bien que ces récepteurs soient plus exprimés à la surface des IL-4-DC que sur les IFN-α-DC, la quantité de virus capturée par les IFN-α-DC est plus importante que celle capturée par les IL-4-DC. Une corrélation inverse entre la capture virale et l’infection productive est donc observée.
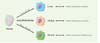 |
Figure 1 Schéma de différenciation des cellules dendritiques IL-4-DC, TGF-β-DC et IFN-α-DC à partir de monocytes isolés du sang. Les IL-4-DC (interleukin-4 dendritic cells), TGF-β-DC (transforming-growth factor-β dendritic cells) et IFN-α-DC (interferonà dendritic cells) miment respectivement les cellules dendritiques myéloïdes, mucosales et inflammatoires. |
L’état de maturation des cellules dendritiques contrôle leur susceptibilité à l’infection par HTLV-1
Les IFN-α-DC produisent naturellement l’interféron de type-I (IFN-I, famille d’interférons à laquelle appartient l’IFN-α), molécule antivirale limitant l’infection des lymphocytes T par l’HTLV-1 [7], et qui pourrait réduire l’infection des cellules dendritiques. Pourtant, l’ajout d’IFN-α recombinant ou de surnageant de culture d’IFN-α-DC au milieu de culture des IL-4-DC ne modifie pas leur infection par l’HTLV-1. La résistance des IFN-α-DC n’est donc pas liée à la production d’IFN-I par ces cellules. En revanche, le traitement d’IL-4-DC par des agents induisant leur maturation (évaluée par l’augmentation d’expression des marqueurs HLA-DR, CD40 et CD86) diminue leur susceptibilité à l’infection par l’HTLV-1, comme observé pour les IFN-α-DC.
Pour identifier le mécanisme responsable de la résistance des cellules dendritiques matures à l’infection par l’HTLV-1, nous avons comparé le trafic du virus dans des cellules dendritiques immatures et matures. L’utilisation de drogues qui ciblent les différents modes d’endocytose révèle que l’HTLV-1 utilise selon les cellules, des mécanismes d’entrée qui s’avèrent partiellement différents : la macropinocytose et l’endocytose dépendante de la clathrine pour l’entrée dans les IL-4-DC; uniquement l’endocytose dépendante de la clathrine pour l’entrée dans les IFN-α-DC. En revanche, dans les IL-4-DC, comme dans les cellules dendritiques matures, le virus se localise dans des vésicules riches en tétraspanines (ou corps multivésiculaires), à l’instar du VIH-1 [3]. La restriction observée dans les IFN-α-DC semble ainsi dépendre d’un mécanisme qui intervient après l’entrée et la compartimentation du virus.
Les cellules dendritiques matures présentent des vésicules plus acides que les cellules dendritiques immatures [8]. Aussi, pour déterminer l’influence du pH sur l’infection des cellules, les vésicules présentes dans les IL-4-DC ont été acidifiées par un traitement avec le chlorure de diphényliodonium. Dans ces conditions, les IL-4-DC deviennent alors résistantes à l’infection. L’infection productive des cellules dendritiques par l’HTLV-1 nécessite donc un passage du virus par des vésicules de pH neutre, une caractéristique de l’immaturité des cellules dendritiques. En revanche, la neutralisation du milieu vésiculaire par la chloroquine, qui inhibe l’acidification des vésicules d’endocytose, ne restaure pas totalement l’infection, ce qui suggère l’existence d’autres mécanismes de restriction dans les cellules dendritiques matures.
L’état de maturation des cellules dendritiques contrôle aussi la transmission d’HTLV-1 aux lymphocytes T
Nous avons examiné l’impact du sous-type de cellules dendritiques interagissant avec l’HTLV-1, sur la transmission du virus aux lymphocytes T. Pour le VIH-1, le principal moyen de transmission du virus aux lymphocytes T ne nécessite pas l’infection de la cellule dendritique, la cellule dendritique servant de cheval de Troie pour la transmission du virus aux cellules lymphocytaires [9]. Ce processus est qualifié de trans-infection. Les IFN-α-DC capturant plus de virus HTLV-1 que les IL-4-DC, nous avons donc émis l’hypothèse qu’une trans-infection des lymphocytes T par les IFN-α-DC pourrait représenter un moyen efficace de transmission d’HTLV-1 aux lymphocytes T sans que l’infection de la cellule dendritique soit nécessaire. Pour tester cette hypothèse, les IL-4-DC ou les IFN-α-DC ont été cocultivées avec des cellules lymphocytaires infectées par l’HTLV-1 pendant un temps court, permettant ainsi la capture du virus par ces cellules. Les IL-4-DC et les IFN-α-DC ont été isolées des cellules infectées et cultivées en présence de cellules Jurkat LTR-Luc2. De façon surprenante, les IFN-α-DC transmettent moins efficacement le virus aux cellules Jurkat LTR-Luc que les IL-4-DC. Cette différence n’est pas liée à une capacité réduite des IFN-α-DC d’interagir avec les cellules Jurkat LTR-Luc. En revanche, elle est une conséquence de l’acidité de leurs vésicules. En effet, lorsque le pH des vésicules est augmenté dans les IFN-α-DC, leur capacité à transmettre le virus s’accroît.
Conclusion
Les différentes populations de cellules dendritiques ne sont donc pas similairement susceptibles à l’infection par HTLV-1. Les cellules dendritiques immatures (IL-4-DC) sont plus susceptibles que les cellules dendritiques tolérogènes (TGF-ß-DC), elles-mêmes plus susceptibles que les cellules dendritiques inflammatoires (IFN-α-DC). La résistance à l’infection repose sur leur degré de maturation et, a fortiori, du niveau d’acidification de leurs vésicules, ce qui conditionne leur capacité à transmettre le virus aux lymphocytes T (Figure 2). Très récemment, il a été montré que les cellules dendritiques myéloïdes CD141+ (ou BDCA-3 Thrombomoduline) étaient résistantes à l’infection par de nombreux virus enveloppés, dont le VIH-1, alors que les cellules dendritiques myéloïdes CD1c+ (ou BDCA-1) y sont permissives [10]. Pour autant, ces deux populations dendritiques ont un rôle complémentaire lors de l’infection, puisque les cellules CD141+, restrictives à l’infection, organisent la réponse immunitaire après présentation croisée d’antigènes viraux portés par les cellules CD1c+ infectées. Savoir si ces cellules adoptent un comportement similaire à la suite de l’infection par l’HTLV-1 permettrait d’étudier les interactions entre virus et cellules dendritiques in vivo, et de comprendre si les cellules dendritiques tendent à favoriser la mise en place de la réponse immunitaire ou la propagation du virus dans l’organisme, ou les deux.
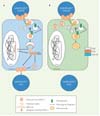 |
Figure 2 Modèle de l’infection ou de la restriction du virus HTLV1, dans les cellules dendritiques immatures ou matures. Le virus HTLV-1, transmis à la cellule dendritique par contact avec un lymphocyte T infecté, se lie à ses récepteurs d’entrée sur la membrane plasmique. Le virus est ensuite endocyté et se retrouve au sein de vésicules riches en tétraspanines. Dans les cellules dendritiques immatures (A), le pH des vésicules serait optimal pour assurer la fusion entre l’enveloppe virale et la membrane de l’endosome. La capside, contenant le génome viral, est alors véhiculée jusqu’au noyau. L’ARN viral est rétrotranscrit en ADN viral, qui s’intègre dans le génome de l’hôte. À partir de cet ADN proviral seront synthétisés les ARN viraux et les protéines virales, qui s’assemblent à la membrane plasmique de la cellule dendritique, permettant l’infection de lymphocytes T sains voisins. L’acidité des vésicules, accrue dans les cellules dendritiques matures (B), empêcherait la fusion de l’enveloppe virale avec la membrane de l’endosome, ce qui mettrait fin au cycle viral. |
Remerciements
Nicolas Futsch est financé par une bourse de thèse attribuée par la Ligue Contre le Cancer.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Ces cellules lymphocytaires, dites « rapporteuses », ont été transfectées par un plasmide dans lequel la séquence terminale longue répétée (LTR) du virus HTLV-1 est clonée en amont du gène codant la luciférase (Luc), une protéine bioluminescente permettant d’évaluer l’activité du LTR, et donc l’infection.
Références
- Gessain A, Cassar O. Epidemiological aspects and world distribution of HTLV-1 infection. Front Microbiol 2012; 3 : 388. [Google Scholar]
- Alais S, Mahieux R, Dutartre H. Viral sourceindependent high susceptibility of dendritic cells to human T-cell leukemia virus type 1 infection compared to that of T lymphocytes. J Virol 2015; 89 : 10580-90. [Google Scholar]
- Cavrois M, Neidleman J, Greene WC. The achilles heel of the trojan horse model of HIV-1 trans-Infection. PLoS Pathog 2008; 4 : e1000051. [Google Scholar]
- Collin M, McGovern N, Haniffa M. Human dendritic cell subsets. Immunology 2013; 140 : 22-30. [Google Scholar]
- Rizkallah G, Alais S, Futsch N, et al. Dendritic cell maturation, but not type I interferon exposure, restricts infection by HTLV-1, and viral transmission to T-cells. PLoS Pathog 2017; 13 : e1006353. [Google Scholar]
- Rizkallah G, Mahieux R, Dutartre H. Transmission intercellulaire de HTLV-1: des mécanismes loin d’être complétement élucidés. Med Sci (Paris) 2015; 31 : 629-37. [Google Scholar]
- Cachat A, Chevalier SA, Alais, et al. Alpha interferon restricts human T-lymphotropic virus type 1 and 2 de novo infection through PKR activation. J Virol 2013; 87 : 13386-96. [Google Scholar]
- Savina A, Jancic C, Hugues S, et al. NOX2 controls phagosomal pH to regulate antigen processing during crosspresentation by dendritic cells. Cell 2006; 126 : 205-18. [Google Scholar]
- Sewald X, Ladinsky MS, Uchil PD, et al. Retroviruses use CD169-mediated trans-infection of permissive lymphocytes to establish infection. Science 2015; 350 : 563-7. [Google Scholar]
- Silvin A, Yu CI, Lahaye X, et al. Constitutive resistance to viral infection in human CD141+ dendritic cells. Sci Immunol 2017; 2 : eaai8071. [Google Scholar]
© 2018 médecine/sciences – Inserm
Liste des figures
 |
Figure 1 Schéma de différenciation des cellules dendritiques IL-4-DC, TGF-β-DC et IFN-α-DC à partir de monocytes isolés du sang. Les IL-4-DC (interleukin-4 dendritic cells), TGF-β-DC (transforming-growth factor-β dendritic cells) et IFN-α-DC (interferonà dendritic cells) miment respectivement les cellules dendritiques myéloïdes, mucosales et inflammatoires. |
| Dans le texte | |
 |
Figure 2 Modèle de l’infection ou de la restriction du virus HTLV1, dans les cellules dendritiques immatures ou matures. Le virus HTLV-1, transmis à la cellule dendritique par contact avec un lymphocyte T infecté, se lie à ses récepteurs d’entrée sur la membrane plasmique. Le virus est ensuite endocyté et se retrouve au sein de vésicules riches en tétraspanines. Dans les cellules dendritiques immatures (A), le pH des vésicules serait optimal pour assurer la fusion entre l’enveloppe virale et la membrane de l’endosome. La capside, contenant le génome viral, est alors véhiculée jusqu’au noyau. L’ARN viral est rétrotranscrit en ADN viral, qui s’intègre dans le génome de l’hôte. À partir de cet ADN proviral seront synthétisés les ARN viraux et les protéines virales, qui s’assemblent à la membrane plasmique de la cellule dendritique, permettant l’infection de lymphocytes T sains voisins. L’acidité des vésicules, accrue dans les cellules dendritiques matures (B), empêcherait la fusion de l’enveloppe virale avec la membrane de l’endosome, ce qui mettrait fin au cycle viral. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




