| Issue |
Med Sci (Paris)
Volume 33, Number 8-9, Août–Septembre 2017
|
|
|---|---|---|
| Page(s) | 749 - 757 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20173308020 | |
| Published online | 18 September 2017 | |
La douleur oculaire chronique : mieux la comprendre pour mieux la traiter
Towards a better understanding of chronic ocular pain
1
Inserm, U968 ; Sorbonne Universités, UPMC Université Paris 06, UMR_S 968, Institut de la Vision ; CNRS, UMR_7210, 17, rue Moreau, F-75012 Paris, France
2
Départment d’ophtalmologie, hôpital Ambroise Paré, APHP, université de Versailles Saint-Quentin-en-Yvelines, Versailles, France
3
Département d’ophtalmologie III, centre hospitalier national d’ophtalmologie des Quinze-Vingts, 28, rue de Charenton, 75012 Paris, France
La sècheresse oculaire est un des premiers motifs de consultation en ophtalmologie. Sa prévalence varie de 5 à 35 % chez des sujets âgés de plus de 50 ans. Cette pathologie du segment antérieur de l’œil est caractérisée par des sensations de douleur variables dans leurs intensités, allant du simple inconfort à une douleur oculaire prononcée. Les douleurs oculaires sont très invalidantes et très difficiles à traiter, et leurs mécanismes physiopathologiques demeurent mal connus de nos jours. Ce constat impose un approfondissement de nos connaissances fondamentales sur l’anatomie du système nociceptif cornéen et sur les mécanismes cellulaires impliqués dans l’initiation et la chronicisation de la douleur oculaire. Cette revue présente, dans une première partie, l’anatomie de l’innervation cornéenne et les différentes classes de récepteurs sensitifs cornéens. La seconde partie fait un état des lieux des données précliniques et cliniques portant sur les mécanismes inflammatoires mis en jeu dans cette pathologie. Enfin la dernière partie de cette revue décrit les différents dispositifs actuellement utilisés pour évaluer la douleur et l’inflammation oculaire en clinique humaine.
Abstract
Dry eye symptoms are one of the leading complaints in ophthalmology. They include visual disturbance, various types of symptoms and variable intensity of pain and discomfort that may become chronic or permanent and thus affect significantly the quality of life of patients. Nevertheless, the pathophysiological mechanisms of ocular surface pain remain largely unknown. A better clinical characterization of chronic ocular pain and an understanding of the molecular and cellular mechanisms involved are crucial issues for developing effective management and therapeutic strategy to alleviate ocular pain. In this review, we first describe the nociceptive corneal nerve pathways and the classification of corneal sensitive receptors neurons. The second part of this review gives an update of the preclinical and clinical data related to the inflammatory processes linked to inflammatory ocular pain. The last section describes the various diagnostic tools used in the clinic to evaluate corneal sensitivity and corneal inflammation.
© 2017 médecine/sciences – Inserm
Douleur et nociception sont deux termes distincts souvent considérés à tort comme synonymes. Le terme « nociception », employé par Sherrington1 au début du XXe siècle, caractérise une réponse à un stimulus dont l’intensité entraîne des réactions de défense visant à sauvegarder l’intégrité de l’organisme. La définition de la « douleur » par l’Association internationale de l’étude de la douleur (en 1979) illustre bien son caractère pluridimensionnel : « La douleur est une expérience sensorielle et émotionnelle désagréable, associée à un dommage tissulaire présent ou potentiel, ou décrite en terme d’un tel dommage ».
Les pathologies de la surface oculaire représentent l’un des principaux motifs de consultation pour douleurs oculaires en ophtalmologie. La douleur oculaire est le plus important signe cardinal d’alerte en réaction à une inflammation ou à un traumatisme des structures du segment antérieur de l’œil comme la cornée, la conjonctive, la sclère2 et les structures uvéales. La douleur oculaire chronique est tout à fait remarquable par la variabilité de l’intensité qu’elle peut générer, allant du simple inconfort oculaire à une douleur intense voire insupportable. La douleur chronique consécutive à une pathologie de la surface oculaire affecte la qualité de la vie : près de 60 % des patients se déclarent gênés dans leurs activités quotidiennes [1]. En outre, 80 % des patients qui souffrent de douleur oculaire ne l’estiment pas suffisamment prise en considération tant par leur entourage que par leurs médecins. Les douleurs chroniques oculaires sont malheureusement parmi les plus difficiles à traiter et leurs mécanismes physiopathologiques, de nature neurogène et/ou inflammatoire, demeurent de nos jours très mal connus [2, 3].
Innervation cornéenne : anatomie et physiologie
La sensibilité somatique de la face, incluant les cavités buccale et nasales, et des méninges, est assurée par les trois branches du ganglion trigéminal : ophtalmique (V1), maxillaire (V2) et mandibulaire (V3). Le nerf ophtalmique V1 se divise en trois branches sensitives : les nerfs frontal, lacrymal et naso-ciliaire, ce dernier se ramifiant en nerfs ciliaires courts et longs, responsables de l’innervation du segment antérieur de l’œil [4]. L’innervation cornéenne des mammifères provient d’environ 70 troncs nerveux contenant chacun un millier d’axones qui forment un « plexus » nerveux. La forte densité des terminaisons nociceptives de la cornée (7 000 nocicepteurs par mm2) est une de ses caractéristiques [5]. L’épithélium cornéen compte 500 fois plus de terminaisons libres nerveuses que le derme et 30 fois plus que la pulpe dentaire [6]. L’innervation cornéenne joue un rôle trophique pour la cornée mais assure aussi la détection des stimulus extérieurs (comme la température, la pression mécanique, etc.) [5].
Somatotopie des neurones cornéens dans le ganglion trigéminal
Nous avons récemment décrit la somatotopie3 des neurones cornéens (identifiés à l’aide d’un traceur neuronal fluorescent couplé à la sous-unité B de la toxine cholérique) dans un ganglion trigéminal de souris préalablement rendu transparent grâce à la méthode 3DISCO (three-dimensional imaging of solvent-cleared organs). L’obtention d’images en haute résolution de la distribution tissulaire des neurones cornéens en microscopie à feuille de lumière (microscopie qui consiste à réaliser des coupes optiques d’un échantillon en l’illuminant par le côté avec une feuille de lumière) a permis de réaliser une reconstruction informatique en trois dimensions de leur somatotopie [7] (Figure 1). La population de neurones innervant la cornée représente seulement 1 à 5 % du nombre total de neurones présents dans le ganglion trigéminal [8, 9], soit entre 150 et 200 cellules chez le rat et la souris. Chez l’homme, les neurones de la branche ophtalmique sont 10 à 20 fois moins représentés que les neurones des branches mandibulaire et maxillaire.
 |
Figure 1. Somatotopie des neurones cornéens contenant un traceur rétrograde fluorescent dans un ganglion trigéminé de souris rendu transparent par la méthode 3DISCO. A. Reconstruction en 3D de la localisation des neurones cornéens. B-E. Détection automatique des neurones cornéens par le logiciel Imaris (logiciel d’analyse d’image et de reconstruction 3D/4D). F-G. Images en haute résolution obtenues en microscopie à feuille de lumière des neurones contenant le traceur rétrograde (d’après [7]). Échelle : 600 µm (© Elsevier). Dal : dorsal ; Val : ventral ; V3 : branche mandibulaire ; V2/V1 : branche ophtalmique, maxillaire. |
Classification fonctionnelle des fibres cornéennes
Comme pour le reste du corps, la cornée est innervée par des fibres nerveuses sensitives et autonomes. Les fibres nerveuses cornéennes ont été classées selon différents critères : morphologiques (diamètre, myélinisées ou non), fonctionnels (seuil d’activation) et expression de marqueurs biochimiques spécifiques. On distingue :
-
Les fibres Aδ, faiblement myélinisées et de petit diamètre (1-5 µm) ; elles conduisent l’influx nerveux à une vitesse moyenne, entre 4 et 30 m/s. Ces fibres sensitives représentent environ 20 % de la population totale des fibres afférentes cornéennes [9, 10]. Elles permettent la perception de la pression et de la température. Les fibres nociceptives Aδ transmettent plus rapidement la douleur dite aiguë. Environ 20 % de ces fibres expriment la substance P (SP) et le calcitonin gene-related peptide (CGRP).
-
Les fibres non myélinisées de type C, d’un diamètre compris entre 0,3 et 1,5 µm, conduisent l’influx nerveux à une vitesse moyenne comprise entre 0,4 et 2 m/s. Ces fibres sont les plus nombreuses dans la cornée (elles représentent environ 80 % des fibres cornéennes). La majorité d’entre elles sont des fibres nociceptives, mais environ 10 % constituent les fibres sympathiques ou parasympathiques post-ganglionnaires du système nerveux autonome.
Dans la cornée, deux sous-populations de fibres C ont été identifiées : les fibres peptidergiques et les fibres non peptidergiques. Chez le rongeur, les fibres peptidergiques présentent soit la SP (10-20 % d’entre-elles) soit le CGRP (40-60 %). D’autres médiateurs sont également présents dans ces fibres, comme la neurokinine A, la sécrétoneurine, la somatostatine, la cholecystokinine ou la gastrine. Chez l’homme, seuls la SP et le CGRP ont été, à ce jour, clairement identifiés dans les fibres cornéennes de type C. Les fibres C non peptidergiques n’expriment, quant à elles, ni le CGRP ni la SP. Elles se caractérisent par leur forte affinité pour l’isolectine B4 (IB4). La distinction entre populations peptidergique et non peptidergique n’est cependant pas si aisée : les neurones sensoriels du ganglion trigéminal qui lient IB4 contiennent également la SP ou le CGRP [11, 12]. Chez la souris, environ 20 % des neurones cornéens sont non peptidergiques (évalué par l’absence de marquage de SP ou de CGRP) [12].
Les fibres nerveuses autonomes d’origine sympathique (provenant du ganglion cervical supérieur) expriment la tyrosine hydroxylase, la noradrénaline et/ou le neuropeptide Y (NPY). Ces fibres joueraient un rôle dans les mécanismes de prolifération des cellules épithéliales cornéennes et dans des processus de cicatrisation de la cornée. Elles représenteraient, chez les rongeurs et le chat, environ 10 % des fibres innervant la cornée, mais leur densité serait très faible dans la cornée de primate, y compris celle de l’homme. Les fibres parasympathiques, provenant du ganglion ciliaire, expriment le vasoactive intestinal peptide (VIP), le NPY, la galanine et la Met-enképhaline [5, 13]. Par des techniques de traçage neuronal, il a été établi que ces fibres parasympathiques sont présentes dans la cornée de rat et de chat. Chez l’homme, leur présence reste incertaine.
Des études électrophysiologiques réalisées sur des terminaisons libres cornéennes ont permis de mettre en évidence l’existence de trois populations de récepteurs sensitifs cornéens [14] :
Les récepteurs au froid (cold sensitive receptors)
Ils sont présents sur les fibres de type Aδ. Ils représentent approximativement 10-15 % des terminaisons sensitives de la cornée. Ces récepteurs thermiques sont répartis en 2 sous-classes :
-
Les récepteurs à haut bruit de fond/faible seuil (qui représentent 72 % des récepteurs thermiques). Ils se dépolarisent spontanément au repos et augmentent rapidement leur activité électrique lorsque la température de la surface cornéenne (d’environ 34 °C) diminue faiblement, de l’ordre de 1 °C.
-
Les récepteurs au froid de faible bruit de fond/haut seuil (représentant 28 %) ont un faible taux d’activité spontanée à 34 °C. Ils augmentent fortement leur activité électrique dès lors que la température de la surface cornéenne chute fortement, de -6 °C.
Les fibres sensibles au froid expriment spécifiquement le canal ionique TRPM8 (transient receptor potential cation channel, subfamily M, member 8) activé par le menthol, qui semble indispensable au réflexe lacrymal [15]. Les récepteurs thermiques au froid sont également sensibles à la variation d’osmolarité du film lacrymal [16].
Les nocicepteurs polymodaux cornéens
Ils répondent à des stimulations de natures mécaniques, thermiques (pour des températures supérieures à 37 °C) ou chimiques (solutions acides [pH entre 5 et 6,5], CO2, agents chimiques exogènes). Ils représentent environ 70 % de la population totale des fibres cornéennes [14]. Ils peuvent être sensibilisés lors de stimulations nociceptives répétées, ou par des médiateurs inflammatoires. Ils augmentent leur fréquence de décharge proportionnellement à l’intensité de la stimulation.
Les nocicepteurs cornéens polymodaux expriment différents récepteurs-canaux sensibles à la température de la famille des TRP (transient receptor potential) comme TRPV1 et TRPA1. Les canaux ioniques de type ASIC (acid-sensing ion channel) activés à des pH compris entre 5,5 et 6 [17], et les canaux sodiques voltage-dépendants Na(v)1.8 et Na(v)1.9 tétrodotoxine-résistants, sont également exprimés par les fibres sensitives cornéennes [17]. Certaines chimiokines, qui participeraient aux mécanismes d’inflammation neurogène, sont produites par les neurones nociceptifs trigéminaux [8].
Les mécano-nocicepteurs
Ils représentent environ 20 % des fibres cornéennes et répondent uniquement à de brèves stimulations mécaniques. La force nécessaire pour leur activation est d’environ 0,6 mN soit 0,06 g (bien en dessous de l’activation des mécano-nocicepteurs de la peau). Le canal ionique mécanosensible Piezo2, a été récemment décrit comme un marqueur moléculaire de ces mécano-nocicepteurs cornéens (fibres Aδ). L’ARNm de Piezo2 est détecté dans environ 30 % des neurones du ganglion trigéminal qui sont dépourvus de CGRP, de TRPV1 et de TRPM8 [9].
Intégration centrale des messages nerveux cornéens dans le complexe sensitif trigéminal
Les projections centrales des neurones nociceptifs de la cornée sont distribuées dans le complexe sensitif trigéminal (CST) qui constitue le premier relais des informations somesthésiques (informations sensorielles) orofaciales [18] (Figure 2). Le CST est composé de plusieurs noyaux : le noyau principal et le noyau spinal qui se subdivise en sous-noyau oral (Vo), sous-noyau interpolaire (Vi) et sous-noyau caudal (Vc), dont la structure laminaire prolonge celle de la corne dorsale de la moelle épinière (C1). Les terminaisons centrales des neurones cornéens sont denses au niveau de la zone de transition du sous-noyau interpolaire au sous-noyau caudal (Vi/Vc) du noyau spinal, et beaucoup plus faibles au niveau de la transition du sous-noyau caudal à la première cervicale (Vc/C1). Une stimulation (mécanique, chimique ou thermique) des nocicepteurs cornéens active les neurones de « second ordre » (neurones localisés dans le CST et qui relaient l’information au thalamus) dans ces régions [19, 20]. Le caractère discontinu de ces projections dans le complexe sensitif trigéminal confère aux afférences cornéennes une organisation inédite, différente de celle « continue et dense » des branches maxillaire et mandibulaire [21]. L’hypothèse d’une réaction bimodale et dépendante de la nature de la stimulation a été émise : une stimulation cornéenne avec de l’huile de moutarde (ligand des canaux TRPA1) active majoritairement les neurones de second ordre dans la région Vc/C1, et de façon moindre ceux de la zone de transition Vi/Vc, alors qu’une stimulation thermique (air chaud à 52 °C) induit un processus inverse [20]. Le message nociceptif cornéen fait aussi l’objet de modulations facilitatrices ou inhibitrices. Une rupture de cet équilibre peut provenir d’une hyper-activation des fibres sensitives de petits calibres (induisant une douleur par excès de nociception), ou d’un défaut d’inhibition périphérique ou centrale.
 |
Figure 2. Les messages nociceptifs prennent naissance au niveau des nocicepteurs périphériques cornéens dont les corps cellulaires sont distribués dans le ganglion trigéminé. 1. Ces neurones projettent dans le complexe sensitif du trijumeau où ils font relais avec les neurones de second ordre. L’information nociceptive est alors transmise vers les centres supérieurs et peut être modulée par des voies descendantes (adapté de [3], © Surface Oculaire). 2. Lors d’une atteinte cornéenne, une inflammation neurogène se produit : les terminaisons nerveuses libèrent des neuromédiateurs capables d’influer sur le chimiotactisme des cellules leucocytaires et la réponse immunitaire. L’inflammation locale augmente l’excitabilité des terminaisons nerveuses (adapté de [47], © Surface Oculaire). 3. Lors d’une stimulation nociceptive, les récepteurs canaux de type TRP (transient receptor potential) sont activés, ce qui conduit à l’ouverture des canaux sodiques voltage-dépendants et génère des potentiels d’action qui se propagent le long de l’axone des neurones cornéens (adapté de [3], © Surface Oculaire). |
Neuroinflammation et sensibilisation périphérique et centrale
Il est désormais admis que les cellules non neuronales, comme les cellules immunitaires (macrophages et lymphocytes) et les cellules gliales des systèmes nerveux périphérique (cellules de Schwann et cellules satellites) et central (astrocytes et cellules microgliales), jouent un rôle essentiel dans les mécanismes de chronicisation de la douleur spinale et trigéminale [22–25]. Les douleurs d’origine neuropathique sont souvent caractérisées par une plasticité neuronale qui conduit à une sensibilisation périphérique (c’est-à-dire un abaissement du seuil d’excitation des nocicepteurs, les rendant plus sensibles) et centrale (c’est-à-dire une réponse adaptative du système nerveux central, conduisant à une augmentation de l’excitabilité neuronale et à la levée d’inhibition au sein des circuits nerveux nociceptifs), à l’origine de la persistance d’une douleur chronique. Ces phénomènes de sensibilisation centrale s’accompagnent également d’une activation des cellules microgliales et astrocytaires [23].
Sensibilisation périphérique des terminaisons cornéennes
Une atteinte cornéenne aboutit à une réponse inflammatoire qui s’accompagne d’une infiltration, dans le stroma et l’épithélium, de cellules immunitaires (neutrophiles, macrophages, cellules dendritiques et lymphocytes T) et de leur activation, à l’origine de la production de facteurs algogènes4 à proximité des terminaisons libres. Ces produits (comme les cytokines, les chimiokines, les prostaglandines, l’histamine, la sérotonine, la bradykinine et le facteur de croissance nerveuse [NGF]) augmentent la fréquence d’ouverture des canaux ioniques des terminaisons libres nociceptives et abaissent le seuil d’excitabilité des nocicepteurs, contribuant ainsi à un phénomène de plasticité dit de sensibilisation périphérique (Figure 2). Ces nocicepteurs activés sécrétent également la SP, le CGRP et des chimiokines qui participent à la réaction inflammatoire neurogène. Chez la souris, une sensibilisation des terminaisons nerveuses cornéennes peut être obtenue par l’injection intra-péritonéale d’ovalbumine et des instillations répétées sur l’œil [26]. Cette sensibilisation se caractérise par des modifications de l’activité nerveuse, accompagnée d’une réponse inflammatoire qui repose sur l’activation des récepteurs TRPV1 et, dans une moindre mesure, par l’activation des canaux TRPA1.
Sensibilisation périphérique dans le ganglion trigéminal
Peu de travaux se sont intéressés aux mécanismes neuroinflammatoires consécutifs à un dommage des nerfs cornéens. Dans les modèles murins, une brûlure chimique, une infection virale ou une stimulation nociceptive de la cornée, activent les neurones de premier ordre dans le ganglion trigéminal. Ceux-ci synthétisent des protéines inductibles, comme c-Jun, c-fos et, dans certains cas, des calbindines, qui participent à la modulation de l’information nociceptive [8]. Une réponse inflammatoire est également observée dans le ganglion [27, 28]. Elle se caractérise in situ par le recrutement de cellules immunitaire Iba1+ (ionized calcium-binding adapter molecule 1 ou allograft inflammatory factor 1 [AIF-1)], spécifique des cellules gliales) à proximité des neurones primaires activés dans la région ophtalmique du ganglion, et par une augmentation de l’expression, dans le ganglion, des cytokines pro-inflammatoires (TNFα [tumor necrosis factor-alpha] et IL[interleukine]-6), de la SP et de son récepteur NK1 (neurokinin 1) [27, 29]. Ainsi, cytokines et chimiokines sont des acteurs importants, non seulement de la sensibilisation périphérique et de l’hyperalgésie qui lui est associée, mais également du transfert de l’information nociceptive de la périphérie vers le système nerveux central [30].
Sensibilisation centrale dans le complexe sensitif trigéminal (CST)
Les mécanismes cellulaires et moléculaires participant à la sensibilisation centrale lors de douleurs oculaires restent mal connus. Des études récentes ont rapporté qu’une douleur oculaire prolongée était à l’origine d’une cascade de modifications cellulaires et moléculaires au sein du CST. Nos travaux ont montré qu’une douleur oculaire inflammatoire se caractérisait par une augmentation de l’expression, dans le CST, de marqueurs neuronaux d’activation (c-fos) et de souffrance (ATF3, activating transcription factor 3), et de médiateurs pro-inflammatoires comme CCL2 (chemokine ligand 2), l’IL-6 et le TNF-α [27]. Une activation des cellules microgliales est également observée dans le CST, à proximité des neurones secondaires activés, dans un modèle murin de douleur oculaire (Figure 3). Dans un autre modèle de sécheresse/douleur oculaire, une sensibilisation des ocular-responsive neurons est mise en évidence dans la zone de transition Vi/Vc [31, 32, 33]. Cette sensibilisation se caractérise par une activité électrique plus importante après stimulation chimique de la cornée, une augmentation de la taille des champs récepteurs périorbitaires, et une augmentation du nombre de clignements reflexes palpébraux5.
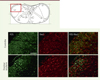 |
Figure 3. Activation neuronale et réorganisation de la microglie dans le sous-noyau caudal lors d’une douleur oculaire. Dans les modèles animaux souffrant d’une douleur oculaire induite par des instillations répétées de chlorure de benzalkonium (stimulation chimique par un conservateur neurotoxique), une augmentation de l’immunoréactivité FOS (marqueur d’activation neuronale, en vert) et Iba1 (marqueur microglial, en rouge) est observée au niveau de la jonction (Vc/C1), comparé aux animaux non traités (échelle : 100 µm) (adapté de [27], © Elsevier). |
Mesure de la nociception oculaire en recherche préclinique
Plusieurs tests permettent d’évaluer la nociception oculaire en recherche préclinique. Le wiping test consiste à instiller dans l’œil, une goutte de solution hypertonique (NaCl 1 à 10 M) et de déterminer, pendant 30 secondes, le nombre de fois où l’animal passe sa patte sur l’œil instillé [34]. Le clignement des paupières, ou blinking behaviour, représente un autre index de sensibilité cornéenne à la suite d’une instillation de différentes solutions (NaCl hypertonique, molécules d’intérêt, etc.) ou après une stimulation mécanique. Le temps de la fermeture de la fente palpébrale, après une instillation de capsaïcine diluée, permet également de déterminer la sensibilité oculaire à la stimulation des canaux TRPV1 présents sur les fibres C. Les filaments de von Frey6 peuvent être utilisés pour stimuler mécaniquement et de façon précise des structures comme la cornée, la conjonctive ou la paupière inférieure. Ces tests permettent de déterminer les seuils de sensibilité mécanique conduisant à un réflexe palpébral.
Évaluation de la douleur oculaire
La douleur oculaire est l’un des premiers motifs de consultation pour les symptômes liés à la sècheresse oculaire. La prévalence de la sècheresse oculaire varie de 5 à 35 % chez les sujets de plus de 50 ans. Cette pathologie peut aussi se déclarer chez des sujets plus jeunes, en cas de maladie auto-immune, d’agressions environnementales ou médicamenteuses répétées, ou après une chirurgie réfractive de la cornée [35]. Les symptômes de la sécheresse oculaire regroupent des troubles visuels et des douleurs d’intensité variable qui deviennent souvent chroniques, voire permanentes. Les patients souffrant de douleur oculaire se plaignent également d’une sensibilité accrue à la lumière (ou photoallodynie) [36]. Il est nécessaire de distinguer la douleur oculaire physiologique nociceptive de la douleur oculaire neuropathique [3, 37]. En effet, la prise en charge et la nature du traitement (local versus systémique) seront différentes selon le type de douleur. L’évaluation de la douleur est donc indispensable avant toute décision thérapeutique, et après la mise en œuvre d’un traitement antalgique, afin d’en évaluer l’efficacité.
Plusieurs outils permettent cette évaluation clinique de la sensibilité cornéenne.
L’esthésiométrie
L’esthésiomètre est un instrument qui permet une évaluation semi-quantitative du seuil de la sensibilité cornéenne par l’observation d’un clignement des paupières en réponse à une stimulation mécanique appliquée à la surface de la cornée. En clinique humaine, l’esthésiométrie permet d’établir un diagnostic précoce et un suivi thérapeutique de nombreuses affections de la surface oculaire.
Esthésiomètre de Cochet-Bonnet
L’esthésiomètre de Cochet-Bonnet se compose d’un filament en nylon (diamètre de 0,12 mm), dont la longueur peut varier entre 0 et 6 cm, faisant varier la pression exercée de 0,4 à 15,9 g/mm2.
Esthésiomètre de Belmonte
Belmonte et ses collaborateurs ont développé un esthésiomètre qui permet de stimuler les différentes catégories de récepteurs cornéens en faisant varier le flux de gaz, sa température et sa concentration en dioxyde de carbone.
Les questionnaires
Parmi les outils d’évaluation de la douleur, l’ophtalmologiste et l’orthoptiste peuvent utiliser plusieurs questionnaires qui permettent une mesure de l’intensité de la douleur par une échelle visuelle analogique (ligne droite de 100 mm sur laquelle est indiqué absence de douleur à l’une des extrémités et douleur insupportable à l’autre), numérique (le patient attribue une note de 0 à 10 pour exprimer l’intensité de la douleur, 0 étant l’absence de douleur et 10 la douleur insupportable) ou verbale simple (en utilisant une liste d’adjectifs qualifiant la douleur). Très récemment, un questionnaire nommé OPAS (ocular pain assessment survey) a été proposé par Qazi et al [38]. Il s’agit d’un outil psychométrique et diagnostique fiable et sensible par la quantification multidimensionnelle de l’intensité de la douleur superficielle cornéenne et oculaire, ainsi que de la qualité de vie. Ce questionnaire sera un outil de choix dans les essais cliniques futurs de nouveaux médicaments pour le traitement de la douleur oculaire.
Nerfs cornéens et inflammation
Depuis les années 1990, l’analyse morphologique de la surface oculaire est possible in vivo grâce à la microscopie confocale. Cette technique d’imagerie permet d’analyser les modifications de l’épithélium, le plexus nerveux sous-épithélial, les cellules inflammatoires dendritiques, les kératocytes et l’endothélium. Elle représente un outil non invasif très performant pour le suivi des pathologies de la surface oculaire. Des paramètres qui ont été déterminés [39] permettent une évaluation des atteintes des nerfs cornéens (Figure 4). Des modifications de l’innervation cornéenne ont ainsi été rapportées lors d’atteintes neuro-pathologiques de l’œil, après chirurgie réfractive, ou lors de neuropathies diabétiques, chez des patients souffrant de douleur oculaire neuropathique [39, 40]. Ce type de douleur oculaire s’accompagne également d’un infiltrat de cellules inflammatoires [41].
 |
Figure 4. Images obtenues en microscopie confocale in vivo montrant la présence plus ou moins importante de cellules hyperréflectives (cellules dendritiques inflammatoires, flèches jaunes) dans le plexus nerveux sous-épithéliaux humain. A. Les nerfs cornéens sont indiqués par les flèches rouges. Notons le changement morphologique des cellules dendritiques selon leur stade d’activation (flèches jaunes). B. Utilisation du logiciel d’analyse d’image ImageJ et du plugin NeuronJ® pour tracer les nerfs cornéens (avant et après traitement informatique) et permettant de calculer les différents paramètres étudiés (taille des images : 400 × 400 µm). |
 |
Figure 5. Schéma illustrant la transition d’une douleur oculaire aiguë en douleur chronique, consécutive à une sensibilisation périphérique et centrale. |
Empreintes conjonctivales
Il s’agit d’une méthode non invasive permettant de prélever les cellules conjonctivales superficielles chez des patients atteints de maladies de la surface oculaire [42, 43] (Figure 4). Ces empreintes, véritables biopsies a minima, permettent de déterminer les contenus cellulaires et membranaires et d’identifier les différentes populations cellulaires (épithéliales, cellules immunitaires) par immunohistologie, cytométrie en flux, ou qPCR (quantitative polymerase chain reaction). L’analyse des prélèvements réalisés sur des cohortes de patients souffrant de douleur oculaire sera d’un grand intérêt pour l’identification de nouvelles cibles thérapeutiques.
Prise en charge thérapeutique de la douleur oculaire chronique
L’éventail thérapeutique permettant de lutter contre la douleur oculaire reste, encore de nos jours, très limité. Il intègre la simple instillation de larmes artificielles, d’agents anti-inflammatoires ou immunomodulateurs locaux, et la prise, par voie générale, de médicaments à visée antalgique. Cependant, de nombreuses études cliniques portant sur certaines formes de douleurs oculaires chroniques démontrent une efficacité limitée de ces thérapies « anti-douleur ». Nous pouvons ainsi citer les collyres anti-inflammatoires non stéroïdiens, classiquement utilisés dans les cas de douleur oculaire de type inflammatoire, mais qui présentent, en utilisation prolongée, un risque d’exacerbation de kératites superficielles à l’origine, elles-mêmes, de douleurs oculaires [44]. Ces traitements, qui visent à réduire l’inflammation oculaire, sont très souvent peu efficaces pour diminuer les sensations d’irritation et de douleur lors d’une sécheresse oculaire [45]. L’instillation d’agents anesthésiques (proparacaïne ou oxybuprocaïne), qui induisent une anesthésie rapide et efficace de la cornée, est strictement contre-indiquée en utilisation prolongée, car délétère pour la cornée (à l’origine d’altérations de l’épithélium cornéen, de retards de cicatrisation et, dans certains cas extrêmes, d’une destruction irréversible [46]). Parmi les autres thérapies pouvant être proposées aux patients souffrant de douleur oculaire chronique, des agents immunomodulateurs (comme la cyclosporine ou le lifitegrast, un inhibiteur de LFA1 [lymphocyte function-associated antigen-1]), sont devenus, en quelques années, des traitements de référence pour réduire l’inflammation chronique associée à la kératoconjonctivite sèche. Dans le cas d’uvéites antérieures, liées à une forte inflammation oculaire, des agents cycloplégique7 peuvent être prescrits en association avec des corticoïdes, pour diminuer la douleur liée à l’inflammation.
Conclusion
Cette synthèse n’a pas prétention à l’exhaustivité. Les études que nous avons rapportées n’ont pour but que de mettre en exergue les circuits nerveux nociceptifs périphériques et centraux impliqués dans la douleur oculaire. La physiologie de la douleur oculaire chronique ne peut se limiter à la description d’un système ciblé spécifique unidirectionnel. La compréhension des mécanismes cellulaires et moléculaires participant à l’initiation et la chronicisation de la douleur oculaire est un préalable à l’amélioration des thérapeutiques actuelles. Nos connaissances sur ces mécanismes ont progressé ces dernières années, mais ces efforts nécessitent d’être poursuivis pour l’identification et la validation de nouvelles cibles thérapeutiques qui font actuellement cruellement défaut.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Les auteurs remercient Gwendal Uguen pour la réalisation du résumé graphique (figurant sur la version en ligne) de ce manuscrit.
Références
- Baudouin C, Creuzot-Garcher C, Hoang-Xuan T, et al. Severe impairment of health-related quality of life in patients suffering from ocular surface diseases. J Fr Ophtalmol 2008 ; 31 : 369–378. [CrossRef] [PubMed] [Google Scholar]
- Belmonte C, Acosta MC, Merayo-Lloves J, Gallar J. What causes eye pain?. Curr Ophthalmol Rep 2015 ; 3 : 111–121. [CrossRef] [PubMed] [Google Scholar]
- Rosenthal P, Borsook D. The corneal pain system. Part I: the missing piece of the dry eye puzzle. Ocul Surf 2012 ; 10 : 2–14. [CrossRef] [PubMed] [Google Scholar]
- May CA. Description and function of the ciliary nerves: some historical remarks on choroidal innervation. Exp Eye Res 1997 ; 65 : 1–5. [CrossRef] [PubMed] [Google Scholar]
- Muller LJ, Marfurt CF, Kruse F, Tervo TM. Corneal nerves: structure, contents and function. Exp Eye Res 2003 ; 76 : 521–542. [CrossRef] [PubMed] [Google Scholar]
- Belmonte C, Aracil A, Acosta MC, et al. Nerves and sensations from the eye surface. Ocul Surf 2004 ; 2 : 248–253. [CrossRef] [PubMed] [Google Scholar]
- Launay PS, Godefroy D, Khabou H, et al. Combined 3DISCO clearing method, retrograde tracer and ultramicroscopy to map corneal neurons in a whole adult mouse trigeminal ganglion. Exp Eye Res 2015 ; 139 : 136–143. [CrossRef] [PubMed] [Google Scholar]
- Felipe CD, Gonzalez GG, Gallar J, Belmonte C. Quantification and immunocytochemical characteristics of trigeminal ganglion neurons projecting to the cornea: effect of corneal wounding. Eur J Pain 1999 ; 3 : 31–39. [CrossRef] [PubMed] [Google Scholar]
- Bron R, Wood RJ, Brock JA, Ivanusic JJ. Piezo2 expression in corneal afferent neurons. J Comp Neurol 2014 ; 522 : 2967–2979. [CrossRef] [PubMed] [Google Scholar]
- De Felipe C, Belmonte C. c-Jun expression after axotomy of corneal trigeminal ganglion neurons is dependent on the site of injury. Eur J Neurosci 1999 ; 11 : 899–906. [CrossRef] [PubMed] [Google Scholar]
- Price TJ, Flores CM. Critical evaluation of the colocalization between calcitonin gene-related peptide, substance P, transient receptor potential vanilloid subfamily type 1 immunoreactivities, and isolectin B4 binding in primary afferent neurons of the rat and mouse. J Pain 2007 ; 8 : 263–272. [Google Scholar]
- Ivanusic JJ, Wood RJ, Brock JA. Sensory and sympathetic innervation of the mouse and guinea pig corneal epithelium. J Comp Neurol 2013 ; 521 : 877–893. [CrossRef] [PubMed] [Google Scholar]
- Jones MA, Marfurt CF. Peptidergic innervation of the rat cornea. Exp Eye Res 1998 ; 66 : 421–435. [CrossRef] [PubMed] [Google Scholar]
- Belmonte C, Acosta MC, Gallar J. Neural basis of sensation in intact and injured corneas. Exp Eye Res 2004 ; 78 : 513–525. [CrossRef] [PubMed] [Google Scholar]
- Belmonte C, Gallar J. Cold thermoreceptors, unexpected players in tear production and ocular dryness sensations. Invest Ophthalmol Vis Sci 2011 ; 52 : 3888–3892. [CrossRef] [PubMed] [Google Scholar]
- Hirata H, Rosenblatt MI. Hyperosmolar tears enhance cooling sensitivity of the corneal nerves in rats: possible neural basis for cold-induced dry eye pain. Invest Ophthalmol Vis Sci 2014 ; 55 : 5821–5833. [CrossRef] [PubMed] [Google Scholar]
- Callejo G, Castellanos A, Castany M, et al. Acid-sensing ion channels detect moderate acidifications to induce ocular pain. Pain 2015 ; 156 : 483–495. [CrossRef] [PubMed] [Google Scholar]
- Dallel R, Villanueva L, Woda A, Voisin D. Neurobiologie de la douleur trigéminale. Med Sci (Paris) 2003 ; 19 : 567–574. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Aicher SA, Hegarty DM, Hermes SM. Corneal pain activates a trigemino-parabrachial pathway in rats. Brain Res 2014 ; 1550 : 18–26. [CrossRef] [PubMed] [Google Scholar]
- Meng ID, Bereiter DA. Differential distribution of Fos-like immunoreactivity in the spinal trigeminal nucleus after noxious and innocuous thermal and chemical stimulation of rat cornea. Neuroscience 1996 ; 72 : 243–254. [Google Scholar]
- Panneton WM, Hsu H, Gan Q. Distinct central representations for sensory fibers innervating either the conjunctiva or cornea of the rat. Exp Eye Res 2010 ; 90 : 388–396. [CrossRef] [PubMed] [Google Scholar]
- Dauvergne C, Molet J, Reaux-Le Goazigo A, et al. Implication of the chemokine CCL2 in trigeminal nociception and traumatic neuropathic orofacial pain. Eur J Pain 2014 ; 18 : 360–315. [CrossRef] [PubMed] [Google Scholar]
- Scholz J, Woolf CJ. The neuropathic pain triad: neurons, immune cells and glia. Nat Neurosci 2007 ; 10 : 1361–1368. [CrossRef] [PubMed] [Google Scholar]
- Van Steenwinckel J, Auvynet C, Sapienza A, et al. Stromal cell-derived CCL2 drives neuropathic pain states through myeloid cell infiltration in injured nerve. Brain Behav Immun 2015 ; 45 : 198–210. [CrossRef] [PubMed] [Google Scholar]
- Grace PM, Hutchinson MR, Maier SF, Watkins LR. Pathological pain and the neuroimmune interface. Nat Rev Immunol 2014 ; 14 : 217–231. [CrossRef] [PubMed] [Google Scholar]
- Acosta MC, Luna C, Quirce S, et al. Changes in sensory activity of ocular surface sensory nerves during allergic keratoconjunctivitis. Pain 2013 ; 154 : 2353–2362. [CrossRef] [PubMed] [Google Scholar]
- Launay PS, Reboussin E, Liang H, et al. Ocular inflammation induces trigeminal pain, peripheral and central neuroinflammatory mechanisms. Neurobiol Dis 2016 ; 88 : 16–28. [CrossRef] [PubMed] [Google Scholar]
- Dosa S, Castellanos K, Bacsa S, et al. Chronic progressive deficits in neuron size, density and number in the trigeminal ganglia of mice latently infected with herpes simplex virus. Brain Pathol 2011 ; 21 : 583–593. [PubMed] [Google Scholar]
- Ferrari G, Bignami F, Giacomini C, et al. Ocular surface injury induces inflammation in the brain: in vivo and ex vivo evidence of a corneal-trigeminal axis. Invest Ophthalmol Vis Sci 2014 ; 55 : 6289–6300. [CrossRef] [PubMed] [Google Scholar]
- Melik Parsadaniantz S, Rivat C, Rostene W, Reaux-Le Goazigo A. Opioid and chemokine receptor crosstalk: a promising target for pain therapy? Nat Rev Neurosci 2015; 16 : 69–78. [CrossRef] [PubMed] [Google Scholar]
- Rahman M, Okamoto K, Thompson R, et al. Sensitization of trigeminal brainstem pathways in a model for tear deficient dry eye. Pain 2015 ; 156 : 942–950. [CrossRef] [PubMed] [Google Scholar]
- Katagiri A, Thompson R, Rahman M, et al. Evidence for TRPA1 involvement in central neural mechanisms in a rat model of dry eye. Neuroscience 2015 ; 290 : 204–213. [Google Scholar]
- Stapleton F, Marfurt C, Golebiowski B, et al. The TFOS international workshop on contact lens discomfort: report of the subcommittee on neurobiology. Invest Ophthalmol Vis Sci 2013; 54 : TFOS71–97. [CrossRef] [PubMed] [Google Scholar]
- Farazifard R, Safarpour F, Sheibani V, Javan M. Eye-wiping test: a sensitive animal model for acute trigeminal pain studies. Brain Res Brain Res Protoc 2005 ; 16 : 44–49. [CrossRef] [PubMed] [Google Scholar]
- Baudouin C, Labbe A, Liang H, et al. Preservatives in eyedrops: the good, the bad and the ugly. Prog Retin Eye Res 2010 ; 29 : 312–334. [CrossRef] [PubMed] [Google Scholar]
- Aggarwal S, Kheirkhah A, Cavalcanti BM, et al. Autologous serum tears for treatment of photoallodynia in patients with corneal neuropathy: efficacy and evaluation with in vivo confocal microscopy. Ocul Surf 2015 ; 13 : 250–262. [CrossRef] [PubMed] [Google Scholar]
- Rosenthal P, Borsook D. Ocular neuropathic pain. Br J Ophthalmol 2016 ; 100 : 128–134. [CrossRef] [PubMed] [Google Scholar]
- Qazi Y, Hurwitz S, Khan S, et al. Validity and reliability of a novel ocular pain assessment survey (OPAS) in quantifying and monitoring corneal and ocular surface pain. Ophthalmology 2016 ; 123 : 1458–1468. [Google Scholar]
- Labbe A, Liang Q, Wang Z, et al. Corneal nerve structure and function in patients with non-sjogren dry eye: clinical correlations. Invest Ophthalmol Vis Sci 2013 ; 54 : 5144–5150. [CrossRef] [PubMed] [Google Scholar]
- Hamrah P, Qazi Y, Shahatit B, et al. Corneal nerve and epithelial cell alterations in corneal allodynia: an in vivo confocal microscopy case series. Ocul Surf 2017 ; 15 : 139–151. [CrossRef] [PubMed] [Google Scholar]
- Goyal S, Hamrah P. Understanding neuropathic corneal pain-gaps and current therapeutic approaches. Semin Ophthalmol 2016 ; 31 : 59–70. [CrossRef] [PubMed] [Google Scholar]
- Brignole-Baudouin F, Ott AC, Warnet JM, Baudouin C. Flow cytometry in conjunctival impression cytology: a new tool for exploring ocular surface pathologies. Exp Eye Res 2004 ; 78 : 473–481. [CrossRef] [PubMed] [Google Scholar]
- Labbe A, Gheck L, Iordanidou V, et al. An in vivo confocal microscopy and impression cytology evaluation of pterygium activity. Cornea 2010 ; 29 : 392–399. [CrossRef] [PubMed] [Google Scholar]
- Gabison EE, Chastang P, Menashi S, et al. Late corneal perforation after photorefractive keratectomy associated with topical diclofenac: involvement of matrix metalloproteinases. Ophthalmology 2003 ; 110 : 1626–1631. [Google Scholar]
- Asbell PA, Spiegel S. Ophthalmologist perceptions regarding treatment of moderate-to-severe dry eye: results of a physician survey. Eye Contact Lens 2010 ; 36 : 33–38. [CrossRef] [PubMed] [Google Scholar]
- Patel M, Fraunfelder FW. Toxicity of topical ophthalmic anesthetics. Expert Opin Drug Metab Toxicol 2013 ; 9 : 983–988. [CrossRef] [PubMed] [Google Scholar]
- Chiu IM, von Hehn CA, Woolf CJ. Neurogenic inflammation and the peripheral nervous system in host defense and immunopathology. Nat Neurosci 2012 ; 15 : 1063–1067. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Somatotopie des neurones cornéens contenant un traceur rétrograde fluorescent dans un ganglion trigéminé de souris rendu transparent par la méthode 3DISCO. A. Reconstruction en 3D de la localisation des neurones cornéens. B-E. Détection automatique des neurones cornéens par le logiciel Imaris (logiciel d’analyse d’image et de reconstruction 3D/4D). F-G. Images en haute résolution obtenues en microscopie à feuille de lumière des neurones contenant le traceur rétrograde (d’après [7]). Échelle : 600 µm (© Elsevier). Dal : dorsal ; Val : ventral ; V3 : branche mandibulaire ; V2/V1 : branche ophtalmique, maxillaire. |
| Dans le texte | |
 |
Figure 2. Les messages nociceptifs prennent naissance au niveau des nocicepteurs périphériques cornéens dont les corps cellulaires sont distribués dans le ganglion trigéminé. 1. Ces neurones projettent dans le complexe sensitif du trijumeau où ils font relais avec les neurones de second ordre. L’information nociceptive est alors transmise vers les centres supérieurs et peut être modulée par des voies descendantes (adapté de [3], © Surface Oculaire). 2. Lors d’une atteinte cornéenne, une inflammation neurogène se produit : les terminaisons nerveuses libèrent des neuromédiateurs capables d’influer sur le chimiotactisme des cellules leucocytaires et la réponse immunitaire. L’inflammation locale augmente l’excitabilité des terminaisons nerveuses (adapté de [47], © Surface Oculaire). 3. Lors d’une stimulation nociceptive, les récepteurs canaux de type TRP (transient receptor potential) sont activés, ce qui conduit à l’ouverture des canaux sodiques voltage-dépendants et génère des potentiels d’action qui se propagent le long de l’axone des neurones cornéens (adapté de [3], © Surface Oculaire). |
| Dans le texte | |
 |
Figure 3. Activation neuronale et réorganisation de la microglie dans le sous-noyau caudal lors d’une douleur oculaire. Dans les modèles animaux souffrant d’une douleur oculaire induite par des instillations répétées de chlorure de benzalkonium (stimulation chimique par un conservateur neurotoxique), une augmentation de l’immunoréactivité FOS (marqueur d’activation neuronale, en vert) et Iba1 (marqueur microglial, en rouge) est observée au niveau de la jonction (Vc/C1), comparé aux animaux non traités (échelle : 100 µm) (adapté de [27], © Elsevier). |
| Dans le texte | |
 |
Figure 4. Images obtenues en microscopie confocale in vivo montrant la présence plus ou moins importante de cellules hyperréflectives (cellules dendritiques inflammatoires, flèches jaunes) dans le plexus nerveux sous-épithéliaux humain. A. Les nerfs cornéens sont indiqués par les flèches rouges. Notons le changement morphologique des cellules dendritiques selon leur stade d’activation (flèches jaunes). B. Utilisation du logiciel d’analyse d’image ImageJ et du plugin NeuronJ® pour tracer les nerfs cornéens (avant et après traitement informatique) et permettant de calculer les différents paramètres étudiés (taille des images : 400 × 400 µm). |
| Dans le texte | |
 |
Figure 5. Schéma illustrant la transition d’une douleur oculaire aiguë en douleur chronique, consécutive à une sensibilisation périphérique et centrale. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




