| Issue |
Med Sci (Paris)
Volume 33, Number 1, Janvier 2017
Matériaux pour la médecine de demain
|
|
|---|---|---|
| Page(s) | 52 - 59 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20173301009 | |
| Published online | 25 January 2017 | |
Impression 3D en médecine régénératrice et ingénierie tissulaire
3D bioprinting in regenerative medicine and tissue engineering
Inserm U1026, université de Bordeaux, 146, rue Léo Saignat, 33076 Bordeaux Cedex, France
*
jean-christophe.fricain@inserm.fr
La fabrication additive recouvre un certain nombre de technologies en vogue qui suscitent l’intérêt des chercheurs en biomatériaux et en ingénierie tissulaire. La fabrication additive appliquée à la médecine régénératrice recouvre deux champs principaux : l’impression 3D de matière inerte ou bioactive et la biofabrication. Si l’impression 3D a pénétré le monde de la médecine réparatrice, les techniques de bio-assemblage et de bio-impression en sont encore à leur début. L’objectif de cet article est de faire un point non exhaustif sur ces différents aspects complémentaires de la fabrication additive au service de la médecine réparatrice, régénératrice et de l’ingénierie tissulaire.
Abstract
Additive manufacturing covers a number of fashionable technologies that attract the interest of researchers in biomaterials and tissue engineering. Additive manufacturing applied to regenerative medicine covers two main areas: 3D printing and biofabrication. If 3D printing has penetrated the world of regenerative medicine, bioassembly and bioimprinting are still in their infancy. The objective of this paper is to make a non-exhaustive review of these different complementary aspects of additive manufacturing in restorative and regenerative medicine or for tissue engineering.
© 2017 médecine/sciences – Inserm

L’impression 3D
Reconstruire un tissu humain à la manière de la salamandre qui régénère un membre amputé est un mythe ancien déjà évoqué dans la mythologie grecque à propos d’Héraclès et l’Hydre de Lerne. Ce serpent régénérait ses têtes à mesure qu’Hercule les tranchait. Faute de pouvoir régénérer les tissus humains, la solution la plus communément admise est le remplacement des structures lésées par une prothèse, une greffe ou une transplantation. Les premières prothèses de doigts ont été découvertes sur des momies égyptiennes datant de 900 à 700 avant Jésus Christ [1]. Classiquement, les prothèses antiques ou modernes sont fabriquées par usinage ou moulage. Cependant, depuis un peu plus de 20 ans un nouveau procédé de fabrication par empilement de couches successives a été développé : la fabrication additive qui est aujourd’hui assimilée à l’impression en trois dimensions (3D). Autrefois cantonnée à des industries de pointe comme l’aéronautique, l’impression 3D se développe et gagne le monde médical. Elle présente plusieurs avantages : faible coût de production pour des séries limitées ou la réalisation de prototypes, optimisation de la matière première qui n’est déposée que là où elle est nécessaire, fabrication d’objets complexes, personnalisation, etc. Une des applications de l’impression 3D est la réalisation de substituts osseux [36] (→) sur mesure qui s’adaptent mieux aux défauts que les substituts ou greffes sculptés par le chirurgien (Figure 1). Les technologies d’impression 3D pénètrent le monde de la prothèse médicale. Récemment, un réseau de volontaires passionnés a créé un site en « open source » (libre d’accès) e-NABLE’S (http://enablingthefuture.org/) afin de créer des kits de prothèse de doigts et de mains sur mesure. Le principe est la mise à disposition gratuite de fichiers numériques pour « imprimer » les différentes pièces de la prothèse. Des tutoriels de montage y sont associés. Le coût des prothèses réalisées par ce type d’impression est d’environ 100 à 150 dollars contre 4 000 à 6 000 dollars pour une prothèse commerciale. Environ 1 500 de ces prothèses ont été créées [2]. Des médecins américains ont réalisé des implants trachéaux (attelles) sur mesure par impression 3D de polyester biorésorbable pour le traitement d’enfants présentant une bronchotrachéomalacie1 sévère. Le premier enfant qui a été implanté a aujourd’hui 3 ans et son attelle est en cours de résorption sans qu’il n’y ait d’effet indésirable [3]. Les imprimantes 3D sont de plus en plus fréquentes au bloc opératoire. Elles permettent au chirurgien de préparer les interventions complexes en réalisant une réplique des tissus à opérer [4] et au chirurgien non expérimenté de préparer une intervention mais aussi de modifier l’indication de traitement grâce à une réalité qui est augmentée par rapport aux examens d’imagerie classique. Récemment, un fœtus présentant une masse susceptible de comprimer ses voies aériennes n’a pas été traité par chirurgie d’urgence, qui présentait un fort risque iatrogène pour la mère et l’enfant, mais a reçu un implant facial réalisé grâce à l’impression 3D [5].
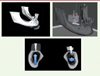 |
Figure 1. Réalisation d’un substitut osseux sur mesure par fabrication additive en PLA de grade médical à partir d’un fichier d’imagerie tridimentionnelle. L’adaptation du substitut créé par fabrication additive est parfaite (flèche) alors que l’autogreffe (étoile) est située à distance de l’os receveur ce qui peut compromettre sa stabilité et sa bio-intégration. PLA de grade médical : matériau plastique utilisable en clinique. |
(→) Voir la Synthèse de F. Jordana et al., page 60 de ce numéro
Il existe aujourd’hui de nombreuses méthodes de prototypage rapide, disponibles commercialement, pour des applications en ingénierie tissulaire : impression, extrusion, polymérisation laser.
• Les méthodes par impression utilisent l’impression d’une « colle » qui vient assembler des particules de poudre, placées dans un bac receveur. Chaque couche est assemblée progressivement pour former une structure 3D. Il persiste souvent des résidus de poudre au sein des matériaux finis, ce qui constitue une limite importante à l’utilisation de cette technique en ingénierie tissulaire [6].
• Les méthodes fondées sur l’interaction de lasers avec la matière fonctionnent sur le principe de la photopolymérisation de matériaux photosensibles. Des matériaux sous forme liquide ou solide (poudres) sont disponibles pour ces applications. Le frittage sélectif par laser utilise un laser CO2 pour lier la poudre couche par couche. Les matériaux obtenus ont une architecture interne et externe contrôlée [7]. La stéréo-lithographie est l’une des premières méthodes de prototypage rapide utilisant cette méthode. Elle implique des résines liquides qui sont polymérisées par un laser UV, couche par couche. À la fin de la fabrication, l’objet est cuit dans un four afin de finaliser la polymérisation. La résolution obtenue est relativement faible mais cette méthode est déjà largement utilisée pour fabriquer des modèles de planification ou des guides chirurgicaux [8].
• Les méthodes par extrusion de matériaux polymères utilisent des têtes d’impression montées sur des axes mobiles dans les trois plans de l’espace. Selon le matériau, celui-ci est déposé à température ambiante ou en fusion. Après dépôt, il se solidifie par évaporation d’un solvant ou par diminution de la température. En modifiant le diamètre de la buse d’extrusion et le parcours de la tête d’impression, il est possible d’obtenir une grande variété de morphologies. Les matériaux utilisés sont principalement des polymères synthétiques [7].
En dehors des prothèses, peu de cas d’implantation de biomatériaux produits par prototypage rapide ont été décrits chez l’homme. Dans un modèle préclinique de défaut osseux alvéolaire réalisé chez le porc, Yeo et al. ont utilisé une greffe osseuse à base de PCL-TCP (polycaprolactone/tricalcium phosphate) fabriquée par un procédé d’extrusion à chaud et l’ont comparée à une autogreffe. Ils ont pu montrer que le biomatériau était très bien adapté [9] illustrant ainsi le fait que le prototypage rapide peut apporter un bénéfice en termes d’adaptation du matériau dans un défaut osseux. En revanche, ce biomatériau est peu efficace pour la régénération osseuse en l’absence de facteurs de croissance ou de cellules. Les méthodes de prototypage rapide, utilisées pour fabriquer des biomatériaux macroporeux, ont une résolution adaptée pour des applications cliniques macroscopiques. Cependant, cette résolution n’est pas adaptée pour contrôler le microenvironnement au niveau cellulaire. Il est probablement nécessaire de combiner plusieurs technologies pour satisfaire ces deux objectifs contradictoires : une macrostructure poreuse avec une microstructure contrôlée [10].
La biofabrication
Si l’on revient sur le graal de la régénération tissulaire évoqué au début de cette revue, la fabrication de prothèse n’est que palliative et ne restitue jamais la fonctionnalité du tissu ad integrum. C’est dans ce contexte que s’est développée l’ingénierie tissulaire, définie en 1993 par Langer et Vacanti comme « l’ensemble des techniques et des méthodes s’inspirant des principes de l’ingénierie et des sciences de la vie, utilisées pour développer des substituts biologiques pouvant restaurer, maintenir ou améliorer les fonctions des tissus » [11]. Dans l’ingénierie tissulaire classique, une matrice biologique, ou artificielle, que l’on ensemence avec des cellules et/ou des facteurs de croissance est habituellement utilisée. Ce produit d’ingénierie tissulaire peut ensuite être implanté, ou, avant son implantation, subir une maturation dans un bioréacteur. L’objectif de ce produit est d’être intégré dans le tissu afin de restaurer ou d’améliorer une fonction. Aujourd’hui, le concept d’ingénierie tissulaire dépasse le simple fait de la médecine régénératrice. Il tend à couvrir le champ des modèles biologiques de tissus physiologiques ou pathologiques afin de réduire le recours à l’expérimentation animale et ainsi développer des modèles pathologiques personnalisés permettant de tester différentes molécules avant de les utiliser chez un patient lui-même. L’un des verrous majeurs à l’utilisation de ces produits reste le manque de contrôle et de reproductibilité : de la matrice (géométrie, porosité, etc.), de la répartition des éléments biologiques dans cette matrice (cellules ou facteurs de croissance), de la vascularisation in vitro des tissus ou des organoïdes, et de la complexité des tissus à reproduire.
Une des réponses à ces verrous technologiques pourrait être la biofabrication. Cette technologie a pris depuis quelques années une place majeure. Le terme de biofabrication a été introduit en 1994, à propos de la fabrication de perles plates [12]. Au-delà des phénomènes naturels de biominéralisation, le terme de biofabrication est utilisé dans de nombreuses disciplines technologiques comme les biotechnologies ou la biologie de synthèse. La définition la plus large de la biofabrication est l’utilisation d’un procédé pour engendrer un produit présentant une fonction biologique. Dans le domaine de l’ingénierie tissulaire, la biofabrication recouvre la bio-impression et le bio-assemblage [13]. Ces deux techniques découlent d’une approche « bottom-up », contrairement à l’ingénierie tissulaire classique qui est d’inspiration « top-down ». L’approche bottom-up consiste à réaliser des éléments tridimensionnels couche par couche alors que l’approche top-down utilise des matrices 3D qui sont secondairement colonisées par des cellules ou des facteurs de croissance. La bio-impression et le bio-assemblage se différencient néanmoins par les unités assemblées et les technologies de fabrication utilisées.
Le bio-assemblage consiste à générer des unités multicellulaires sous la forme de fibres, d’agrégats ou de feuillets, ou présentant des structures complexes (organoïdes, micro-tissus) à l’aide de matrice extracellulaire (MEC). Le bio-assemblage consiste donc à fabriquer des structures hiérarchisées qui sont modulaires et possèdent une organisation en 2D ou 3D grâce à un assemblage automatisé d’éléments cellularisés. Ces éléments peuvent être fabriqués par auto-assemblages cellulaires ou en utilisant des briques élémentaires qui sont composées de cellules associées à des biomatériaux (Figure 2). Ces unités sont générées essentiellement à partir de techniques de micro-fluidique ou de moulage qui peuvent être couplées à l’impression 3D de matériaux [13].
 |
Figure 2. Procédé de biofabrication par la « technique sandwich ». Impression 3D de grilles de PLA (matériau plastique) (A) de porosités croissantes (a1, a2, a3) . Ces grilles peuvent être superposées et maintenues par des clips (B) ce qui permet une cellularisation des différentes couches (b1, b2, b3) avant assemblage pour favoriser la colonisation cellulaire de la matrice imprimée selon une approche bottom-up. |
La bio-impression
En 2010, Guillemot et al. ont défini la bio-impression comme « l’utilisation de technologies d’impression assistées par ordinateur permettant l’arrangement et l’assemblage de structures vivantes ou non, avec une organisation en deux ou trois dimensions, afin de produire des structures composites qui pourront être utilisées pour des applications en médecine régénératrice, pour des études pharmacocinétiques ou bien pour des travaux fondamentaux de biologie cellulaire » [14].
Principe général
La bio-impression est l’impression en deux dimensions (2D) ou trois dimensions (3D) de tissus biologiques vivants. C’est ce qui la distingue de ce que l’on nomme communément impression 3D où l’on imprime des matériaux. La bio-impression consiste donc à déposer, couche par couche, ou point par point, des cellules, des composants de la matrice extracellulaire (MEC), des facteurs de croissance et des biomatériaux grâce à une technologie d’impression pilotée par un ordinateur à partir d’un ficher numérique. Il s’agit donc d’un procédé de conception (CAO) et de fabrication (FAO) assisté par ordinateur, selon un mode de fabrication additif grâce au couplage de l’ordinateur et d’une imprimante.
Une différence notable entre l’impression 3D qui imprime de la matière « inerte » et la bio-impression qui imprime de la matière vivante, est l’évolution du motif biologique. Il va subir des processus de fusion et de maturation qui vont évoluer en fonction du temps, de l’environnement et du motif imprimé. Cette évolution du produit biologique bio-imprimé a introduit la notion de bio-impression 4D où le temps représente la quatrième dimension [15]. Plus récemment, la notion de quatrième dimension a aussi été appliquée aux matériaux déformables qui évoluent dans le temps [16]. Si cette notion d’évolution est essentielle, il faut préciser qu’elle n’est pas spécifique de la bio-impression. Elle concerne également les produits d’ingénierie tissulaire, quel que soit le procédé d’élaboration.
Indépendamment de la technique utilisée, la bio-impression d’un tissu est réalisée en trois étapes : (1) conception du patron à imprimer assistée par ordinateur, (2) impression et (3) caractérisation.
Les imprimantes
Plusieurs bio-imprimantes ont été développées : imprimantes à jet d’encre, imprimantes par extrusion (les têtes d’impression sont constituées de micro-seringues) et imprimantes assistées par laser (Figure 3A). Les technologies d’impression seront plus ou moins efficaces selon le volume à imprimer et la résolution souhaitée (Figure 3B).
 |
Figure 3. A. Principales technologies utilisées dans les bio-imprimantes. B. Le choix de la technologie dépend des impératifs de résolution et du volume à imprimer en fonction de l’application visée. |
La première micro-impression d’éléments biologiques (à base de fibronectine) a été réalisée par Klebe en 1988 par impression jet d’encre [16]. En 2006, Boland et al. ont utilisé des imprimantes de bureau modifiées afin de réaliser la micro-impression de cellules [17]. Aujourd’hui, des imprimantes thermiques (ou piézo-électriques) sont utilisées. L’impression jet d’encre thermique repose sur une cellule thermique qui produit une bulle de vapeur dont la pression génère une gouttelette au travers d’un pertuis de 30 à 200 μm de diamètre. Les imprimantes jet d’encre piézo-électriques utilisent une impulsion de tension qui génère une modification de forme d’un cristal qui contracte le réservoir d’encre. La détente du cristal piézo-électrique entraîne l’éjection de la goutte. Ces imprimantes permettent d’imprimer des cellules vivantes selon des motifs prédéfinis. Le principal inconvénient de ces imprimantes est la faible densité cellulaire utilisable (inférieure à 5 millions de cellules/mL), limite nécessaire pour prévenir l’obstruction des têtes d’impression. En ingénierie tissulaire, les imprimantes jet d’encre ont été utilisées in situ pour régénérer de la peau et du cartilage, ou in vitro pour réaliser des produits d’ingénierie tissulaire osseuse.
Des micro-seringues ont été développées pour imprimer des éléments biologiques par extrusion. Les biomatériaux (alginate, agarose, matrigel) sont extrudés de façon continue au travers de buses de quelques centaines de micromètres de diamètre. L’avantage de ces techniques est de réaliser l’impression dans le même temps des échafaudages (scaffolds) et des cellules. Les micro-seringues ont ainsi été utilisées pour réaliser des valves aortiques, des vaisseaux, ou des modèles tumoraux ou pharmacologiques.
Les techniques de bio-impression assistées par laser (laser assisted bioprinting, LAB) reposent sur une source laser pulsée, une lame donneuse (cible) recouverte d’une fine couche de bio-encre à imprimer, et une lame receveuse disposée à quelques micromètres ou millimètres de la première qui reçoit les éléments imprimés. Des lasers pulsés nano ou femto-seconde2 avec une longueur d’onde pouvant se situer dans l’infrarouge (1 064 nm) ou dans l’ultra-violet (193, 248, 266 et 355 nm) ont été utilisés. L’énergie laser peut être directement absorbée par l’encre (technique MAPLE-DW [matrix assisted pulsed laser evaporation direct write]), ce qui génère la formation d’un jet résultant de la vaporisation des premières couches moléculaires de la bio-encre au point de focalisation. Quand l’énergie laser n’est pas absorbée par la bio-encre, une couche transductrice/absorbante, qui permet de convertir l’énergie lumineuse en énergie thermique (dans le cas des BioLP, biological laser printer) et/ou mécanique (BA[blister-actuated]- et AFA[absorbing film assisted]-LIFT[laser induced forward transfer]), doit être utilisée. La couche absorbante est constituée de métal (or, titane, argent) de quelques dizaines de nm pour le BioLP, alors qu’elle est en polyimide pour le BA-LIFT. Le principe de l’éjection des gouttes par LAB dépend de la formation d’une poche de gaz secondaire à l’interaction de l’énergie laser avec la couche absorbante. En 2002, Ringeisen et al. ont mis en évidence la possibilité d’imprimer des protéines par MAPLE-DW sans que soient endommagés les épitopes qu’elles présentent, un double brin d’ADN, ou une phosphatase alcaline fonctionnelle [18]. Le procédé a été amélioré par l’impression de bio-encres complexes composées d’hydroxyapatite, de cellules et de matrice extracellulaire [19–28]. Comparée à l’ensemencement d’un même nombre de feuillets par simple dépôt (approche top-down), l’impression de motifs cellulaires, couche par couche, sur des feuillets de polycaprolactone (approche bottom-up), augmente la prolifération des cellules in vitro et in vivo [21]. Les recherches actuelles s’orientent vers la bio-impression in situ assistée par laser qui consiste à imprimer directement, sur le patient, les composants cellulaires et matriciels selon une organisation définie pour favoriser la régénération tissulaire.
Les applications de la bio-impression 3D
La bio-impression de tissus vise deux types d’applications : la création de modèles cellulaires et tissulaires, et la fabrication de produits d’ingénierie tissulaire pour la médecine régénératrice et réparatrice.
Des modèles d’organe ou de tissu
Les modèles d’organe ou de tissu sont des outils permettant de tester, de façon reproductible et répétée, l’action pharmacologique de drogues. Ils représentent un enjeu important dans la sélection de molécules en fonction de leur efficacité et leur toxicité. Le développement de modèles tridimensionnels complexes est un enjeu important pour la recherche en pharmacologie du XXIe siècle. Aujourd’hui, la plupart des modèles disponibles ne reproduisent que très partiellement la situation in vivo car leur architecture ne prend pas en compte la complexité des interfaces tissulaires et la perfusion vasculaire. Les puces de microfluidique permettent de résoudre partiellement l’exposition des tissus aux stimulations mécaniques des fluides et à la perfusion, mais elles ne reproduisent pas, en trois dimensions, la complexité des tissus. Dans ce contexte, des recherches sont développées pour bio-imprimer en 3D de façon reproductible des organoïdes complexes qui soient perfusables. Un autre espoir concerne l’impression d’organoïdes de tissus différents pour étudier leurs interactions. Peu de résultats sont actuellement disponibles. En 2008, R. Chang [29] a publié un modèle associant la microfluidique à l’impression 3D. La société Organovo, aux États-Unis, a commercialisé, en 2014, son premier modèle de foie qui intègre des hépatocytes, des cellules stellaires et des cellules endothéliales, imprimés dans une matrice. Ce modèle serait, selon la société, plus discriminant que les cultures 2D. La principale limite est le faible volume des structures hépatiques qui ne dépasse pas quelques centaines de microns. Elles sont donc loin du modèle réel. Les modèles tumoraux en trois dimensions sont actuellement le plus souvent réalisés avec des techniques de sphéroïdes en suspension dans des gels (collagène, alginate, matrigel), reproduisant l’environnement extracellulaire, dans des structures de support (chitosane, polycaprolactone). Elles présentent comme limite l’absence d’interaction avec l’immunité et l’angiogenèse ainsi qu’un apport en nutriments insuffisant, ce qui a été partiellement résolu par les systèmes de microfluidique. Xu et al. ont imprimé des cellules d’ovaire cancéreuses et des fibroblastes dans du matrigel mais ils n’ont pas pu montrer la supériorité de leur modèle [30]. Un modèle de cancer du sein a été réalisé par impression 3D de cellules cancéreuses et de fibroblastes. Ce modèle a été validé en termes de réponse au traitement [31]. Plus récemment, des cellules HeLa (lignée cancéreuse) ont été imprimées avec de la gélatine, du fibrinogène et de l’alginate, mimant ainsi l’environnement 3D. Après assemblage, 90 % des cellules étaient vivantes et avaient tendance à former des sphéroïdes alors que les cellules cultivées en 2D restaient en monocouches. Par comparaison aux cellules cultivées en 2D, ces cellules exprimaient plus de métallo-protéases et présentaient une plus grande résistance à la chimiothérapie, les rapprochant de la situation clinique [32]. Les recherches actuelles tentent de modéliser le comportement des cellules tumorales dans leur environnement. Le développement de ces modèles 3D de tumeur par bio-impression représente donc un grand espoir pour la recherche pharmaceutique et le développement de traitements personnalisés.
La médecine régénératrice et réparatrice
Le deuxième domaine d’application concerne la médecine régénératrice et réparatrice. Dans ce domaine, on distingue la bio-impression ex vivo et la bio-impression in situ.
La bio-impression ex vivo consiste à créer des produits d’ingénierie tissulaire à l’aide de bio-imprimantes. Plusieurs tissus, de complexité variable, ont pu être reconstruits en utilisant cette technologie. Elle nécessite le recours à des bio-imprimantes complexes multi-têtes pour imprimer différentes encres biologiques afin de satisfaire à la complexité des tissus. La réalisation d’organes complexes comme le rein est une réalité qui reste lointaine, mais plusieurs groupes sont actuellement capables de produire de la peau. À moyen terme, les vaisseaux pourront partiellement être bio-imprimés. Un des défis actuels de l’ingénierie tissulaire est la production d’un réseau veineux, artériel et capillaire associé aux organes imprimés. Des vaisseaux ont pu être créés par impression 3D en imprimant des cellules endothéliales, des fibroblastes et de la fibrine dans un gel de collagène tunnellisé, à l’aide d’une encre thermolabile. Un réseau capillaire s’est développé entre les vaisseaux endothélialisés. La deuxième approche consiste à imprimer directement un réseau vasculaire de forme tubulaire autour d’un tube ou sur un matériau support (l’agarose) [33]. La maturation et la fusion des agrégats cellulaires en quelques jours forment les vaisseaux. Récemment, Atala et al. ont fait la démonstration qu’il était possible d’imprimer des tissus humains de taille compatible avec une utilisation clinique. Cela a été rendu possible grâce à la combinaison de plusieurs techniques : imagerie du défaut anatomique et conception assistée par ordinateur du tissu à reconstruire, réalisation d’un moule acellulaire dégradable pour donner la forme au tissu, impression d’hydrogels cellularisés réticulés après impression, et création d’un réseau de microtunnels pour favoriser le passage des nutriments [34]. Ils ont ainsi pu démontrer, par des techniques combinées, intégrées dans une seule bio-imprimante, qu’il était possible de reconstruire : (1) une portion de mandibule de morphologie adaptée à la perte de substance (3,6 × 3, 2 × 1,6 cm), et la fabrication d’un os de calvaria3 qui permet la régénération osseuse chez le rat ; (2) un muscle strié squelettique (15 × 1 × 5 mm) innervé et répondant à des stimulations électriques après implantation in vivo chez le rat ; (3) le cartilage de l’oreille (3,2 × 0,9 × 1,6 cm), qui présente une forme complexe, qui a été maintenue deux mois après implantation pour maturation en site sous-cutané chez des rats athymiques [34].
La bio-impression in situ consiste à bio-imprimer des cellules, de la matrice, des facteurs de croissance directement au niveau de la perte tissulaire pour favoriser la régénération du tissu lésé. L’arrivée des bio-imprimantes pour imprimer le tissu ou l’organe manquant in situ au bloc opératoire est évidemment une perspective à long terme qui nécessitera de coupler les imprimantes à des systèmes d’imagerie afin de visualiser le défaut tissulaire. L’avantage de cette approche est cependant de se dispenser des étapes de maturations in vitro qui sont longues, coûteuses et favorisent les risques de contamination. La limite actuelle de la bio-impression in situ est qu’elle ne peut être utilisée que pour des pertes tissulaires localisées en superficie comme la peau ou la calvaria. Cette approche a été utilisée avec des imprimantes jet d’encre pour imprimer des cellules souches issues du liquide amniotique pour le traitement de brûlures [35]. Notre groupe a utilisé une imprimante laser pour imprimer de l’hydroxyapatite dans des défauts de calvaria [25]. Plus récemment, nous avons pu imprimer du collagène, de l’hydroxyapatite et des cellules souches mésenchymateuses et nous avons observé que le motif cellulaire imprimé pouvait guider la cicatrisation (Figure 4).
 |
Figure 4. De la conception à la caractérisation du processus de bio-impression. Exemple de la bio-impression in situ de cellules souches D1 de souris, d’une matrice d’hydroxyapatite et de collagène. L’impression des cellules sous forme de disque favorise la cicatrisation du défaut critique de la calvaria (voûte crânienne) sur la totalité de la surface alors que la cicatrisation est limitée à la périphérie pour les impressions en anneau. iPS : cellules souches pluripotentes induites. |
Liens d’intérêt
J.C. Fricain déclare être membre du conseil d’administration de la société SILTIS.
H. De Olivera, R. Devillard, J. Kalisky, M. Remy, V. Kériquel, D. Le Nihounen, A. Grémare, V. Guduric, A. Plaud, N. L’Heureux, J. Amédée, S. Catros déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Finch J. The ancient origins of prosthetic medicine. Lancet 2011 ; 377 : 548–549. [CrossRef] [PubMed] [Google Scholar]
- Kuehn BM Clinicians embrace 3D printers to solve unique clinical challenges. JAMA 2016 ; 315 : 333–335. [CrossRef] [PubMed] [Google Scholar]
- Zopf DA, Hollister SJ, Nelson ME, et al. Bioresorbable airway splint created with a three-dimensional printer. N Engl J Med 2013 ; 368 : 2043–2045. [Google Scholar]
- Malik HH, Darwood AR, Shaunak S, et al. Three-dimensional printing in surgery: a review of current surgical applications. J Surg Res 2015 ; 199 : 512–522. [CrossRef] [PubMed] [Google Scholar]
- VanKoevering KK, Morrison RJ, Prabhu SP, et al. Antenatal three-dimensional printing of aberrant facial anatomy. Pediatrics 2015 ; 136 : e1382–e1385. [CrossRef] [PubMed] [Google Scholar]
- Billiet T, Vandenhaute M, Schelfhout J, et al. A review of trends and limitations in hydrogel-rapid prototyping for tissue engineering. Biomaterials 2012 ; 33 : 6020–6041. [CrossRef] [PubMed] [Google Scholar]
- Leong KF, Cheah CM, Chua CK Solid freeform fabrication of three-dimensional scaffolds for engineering replacement tissues and organs. Biomaterials 2003 ; 24 : 2363–2378. [CrossRef] [PubMed] [Google Scholar]
- Bai S, Bo B, Bi Y, et al. CAD/CAM surface templates as an alternative to the intermediate wafer in orthognathic surgery. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2010 ; 110 : e1–e7. [Google Scholar]
- Yeo A, Cheok C, Teoh SH, et al. Lateral ridge augmentation using a PCL-TCP scaffold in a clinically relevant but challenging micropig model. Clin Oral Implants Res 2012 ; 23 : 1322–1332. [CrossRef] [PubMed] [Google Scholar]
- Ovsianikov A, Mironov V, Stampf J, Liska R Engineering 3D cell-culture matrices: multiphoton processing technologies for biological and tissue engineering applications. Expert Rev Med Devices 2012 ; 9 : 613–633. [CrossRef] [PubMed] [Google Scholar]
- Langer R, Vacanti JP Tissue engineering. Science 1993 ; 260 : 920–926. [Google Scholar]
- Fritz M, Belcher AM, Radmacher M, et al. Flat pearls from biofabrication of organized composites on inorganic substrates. Nature 1994 ; 371 : 49–51. [Google Scholar]
- Groll J, Boland T, Blunk T, et al. Biofabrication: reappraising the definition of an evolving field. Biofabrication 2016 ; 8 : 013001. [CrossRef] [PubMed] [Google Scholar]
- Guillemot F, Mironov V, Nakamura M. Bioprinting is coming of age: report from the International Conference on bioprinting and biofabrication in Bordeaux (3B’09). Biofabrication 2010 ; 2 : 010201. [CrossRef] [PubMed] [Google Scholar]
- Gao B, Yang Q, Zhao X, et al. 4D bioprinting for biomedical applications. Trends Biotechnol 2016 ; 34 : 746–756. [CrossRef] [PubMed] [Google Scholar]
- Cytoscribing Klebe RJ a method for micropositioning cells and the construction of two- and three-dimensional synthetic tissues. Exp Cell Res 1988 ; 179 : 362–373. [CrossRef] [PubMed] [Google Scholar]
- Boland T, Xu T, Damon B, Cui X. Application of inkjet printing to tissue engineering. Biotechnol J 2006 ; 1 : 910–917. [Google Scholar]
- Ringeisen BR, Chrisey DB, Piqué A, et al. Generation of mesoscopic patterns of viable Escherichia coli by ambient laser transfer. Biomaterials 2002 ; 23 : 161–166. [CrossRef] [PubMed] [Google Scholar]
- Ali M, Pages E, Ducom A, et al. Controlling laser-induced jet formation for bioprinting mesenchymal stem cells with high viability and high resolution. Biofabrication 2014 ; 6 : 045001. [CrossRef] [PubMed] [Google Scholar]
- Devillard R, Pagès E, Correa MM, et al. Cell patterning by laser-assisted bioprinting. Methods Cell Biol 2014 ; 119 : 159–174. [Google Scholar]
- Catros S, Guillemot F, Nandakumar A, et al. Layer-by-layer tissue microfabrication supports cell proliferation in vitro and in vivo. Tissue Eng Part C Methods 2012 ; 18 : 62–70. [Google Scholar]
- Guillotin B, Guillemot F Cell patterning technologies for organotypic tissue fabrication. Trends Biotechnol 2011 ; 29 : 183–190. [CrossRef] [PubMed] [Google Scholar]
- Mézel C, Souquet A, Hallo L, Guillemot F Bioprinting by laser-induced forward transfer for tissue engineering applications: jet formation modeling. Biofabrication 2010 ; 2 : 014103. [CrossRef] [PubMed] [Google Scholar]
- Keriquel V, Guillemot F, Arnault I, et al. In vivo bioprinting for computer- and robotic-assisted medical intervention: preliminary study in mice. Biofabrication 2010 ; 2 : 014101. [CrossRef] [PubMed] [Google Scholar]
- Guillotin B, Souquet A, Catros S, et al. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization. Biomaterials 2010 ; 31 : 7250–7256. [CrossRef] [PubMed] [Google Scholar]
- Guillemot F, Souquet A, Catros S, et al. High-throughput laser printing of cells and biomaterials for tissue engineering. Acta Biomater 2010 ; 6 : 2494–2500. [CrossRef] [PubMed] [Google Scholar]
- Chang R, Nam J, Sun W Direct cell writing of 3D microorgan for in vitro pharmacokinetic model. Tissue Eng Part C Methods 2008 ; 14 : 157–166. [Google Scholar]
- Xu F, Celli J, Rizvi I, et al. A three-dimensional in vitro ovarian cancer coculture model using a high-throughput cell patterning platform. Biotechnol J 2011 ; 6 : 204–212. [Google Scholar]
- Wang C, Tang Z, Zhao Y, et al. Three-dimensional in vitro cancer models: a short review. Biofabrication 2014 ; 6 : 022001. [CrossRef] [PubMed] [Google Scholar]
- Zhao Y, Yao R, Ouyang L, et al. Three-dimensional printing of Hela cells for cervical tumor model in vitro. Biofabrication 2014 ; 6 : 035001. [CrossRef] [PubMed] [Google Scholar]
- Ozbolat IT Bioprinting scale-up tissue and organ constructs for transplantation. Trends Biotechnol 2015 ; 33 : 395–400. [CrossRef] [PubMed] [Google Scholar]
- Kang HW, Lee SJ, Ko IK, et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nat Biotechnol 2016 ; 34 : 312–319. [Google Scholar]
- Skardal A, Mack D, Kapetanovic E, et al. Bioprinted amniotic fluid-derived stem cells accelerate healing of large skin wounds. Stem Cells Transl Med 2012 ; 1 : 792–802. [CrossRef] [PubMed] [Google Scholar]
- Jordana F, Le Visage C, Weiss P Substituts osseux. Med Sci (Paris) 2017 ; 33 : 60–65. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Réalisation d’un substitut osseux sur mesure par fabrication additive en PLA de grade médical à partir d’un fichier d’imagerie tridimentionnelle. L’adaptation du substitut créé par fabrication additive est parfaite (flèche) alors que l’autogreffe (étoile) est située à distance de l’os receveur ce qui peut compromettre sa stabilité et sa bio-intégration. PLA de grade médical : matériau plastique utilisable en clinique. |
| Dans le texte | |
 |
Figure 2. Procédé de biofabrication par la « technique sandwich ». Impression 3D de grilles de PLA (matériau plastique) (A) de porosités croissantes (a1, a2, a3) . Ces grilles peuvent être superposées et maintenues par des clips (B) ce qui permet une cellularisation des différentes couches (b1, b2, b3) avant assemblage pour favoriser la colonisation cellulaire de la matrice imprimée selon une approche bottom-up. |
| Dans le texte | |
 |
Figure 3. A. Principales technologies utilisées dans les bio-imprimantes. B. Le choix de la technologie dépend des impératifs de résolution et du volume à imprimer en fonction de l’application visée. |
| Dans le texte | |
 |
Figure 4. De la conception à la caractérisation du processus de bio-impression. Exemple de la bio-impression in situ de cellules souches D1 de souris, d’une matrice d’hydroxyapatite et de collagène. L’impression des cellules sous forme de disque favorise la cicatrisation du défaut critique de la calvaria (voûte crânienne) sur la totalité de la surface alors que la cicatrisation est limitée à la périphérie pour les impressions en anneau. iPS : cellules souches pluripotentes induites. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




