| Issue |
Med Sci (Paris)
Volume 32, Number 5, Mai 2016
|
|
|---|---|---|
| Page(s) | 470 - 477 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20163205013 | |
| Published online | 25 May 2016 | |
Pathologies et vieillissement cardiaque
Les leçons d’un tout petit cœur
Cardiac pathologies and aging: lessons from a tiny heart
1
Inserm UMR_S 1090, Technological advances for genomics and clinics (TAGC), parc scientifique de Luminy, case 908, 13288
Marseille Cedex 9, France
2
CNRS, Marseille, France
3
Aix-Marseille université, UMR_S 1090, TAGC, parc scientifique de Luminy, 13288
Marseille, France
*
laurent.perrin@univ-amu.fr
**
laurence.roder@univ-amu.fr
Le haut niveau de conservation du réseau de gènes régulateurs de la cardiogenèse, ainsi que des caractéristiques cellulaires et physiologiques des cardiomyocytes entre la mouche et l’homme, font du petit cœur de cet invertébré le système génétique le plus simple et le plus flexible pour disséquer les mécanismes moléculaires fondamentaux mis en jeu au cours du développement, de l’établissement et du maintien de la fonction cardiaque. Les avancées récentes dans les techniques de mesure de la fonction cardiaque ont permis de valider la drosophile comme modèle des cardiomyopathies et arythmies d’origine génétique, métabolique ou liées au vieillissement de l’organe. Le cœur de la mouche représente donc un modèle de choix pour identifier les gènes, et leurs interactions, impliqués dans les pathologies cardiaques.
Abstract
The high level of conservation of the cardiogenic gene regulatory network as well as of the cellular and physiological characteristics of the cardiomyocytes between fly and human, makes the small heart of this invertebrate the simplest and most flexible genetic system to dissect the fundamental molecular mechanisms that are brought into play during the development, the establishment and the maintenance of the cardiac function. The recent improvements in techniques of measurements of cardiac function made it possible to validate Drosophila as a model of cardiomyopathies and arrhythmias of genetic and metabolic origin or dependent of ageing. The heart of the fly thus represents a model of choice to identify genes and their interactions implicated in cardiac pathologies.
© 2016 médecine/sciences – Inserm
Vignette (Photo © Angelo Parini).
Bien que des progrès notables dans la compréhension de l’insuffisance cardiaque aient été réalisés ces dernières décennies, les causes génétiques de cette pathologie restent encore largement inconnues. En particulier, les interactions complexes entre susceptibilités génétiques, style de vie, environnement et vieillissement rendent extrêmement difficile la compréhension des bases physiopathologiques sous-jacentes. De ce point de vue, la dissection génétique du système cardiaque dans des organismes moins complexes que les vertébrés, doit permettre une meilleure compréhension des éléments fondamentaux du contrôle de la physiologie cardiaque et des mécanismes pathologiques associés. Toute une série d’études valident la mouche du vinaigre (Drosophila melanogaster) comme modèle in vivo pour l’analyse des gènes impliqués dans la fonction cardiaque. En effet des gènes homologues contrôlent, chez la drosophile et les vertébrés, le développement précoce mais aussi les éléments fonctionnels essentiels du cœur. La mouche est ainsi le modèle génétique le plus simple qui soit doté d’un muscle cardiaque. Il est de plus en plus utilisé pour identifier les gènes impliqués dans les pathologies cardiaques.
Le système circulatoire de la drosophile
Chez la drosophile, le muscle cardiaque est spécifié dans le mésoderme dorsal par l’action concertée de ligands sécrétés par l’ectoderme. Les précurseurs cardiaques, qui expriment une combinatoire de facteurs de transcription spécifiques, dont Tinman, l’homologue de Nkx2.5 (NK2 homeobox 5), migrent en position dorsale pour former le tube cardiaque à la fin de l’embryogenèse. Celui-ci est divisé en deux territoires, l’aorte et le cœur proprement dit, qui sont spécifiés sous l’action respective des gènes Hox Ultrabithorax et abdominal A [1] (Figure 1A). De manière remarquable, l’essentiel des signaux temporels et spatiaux requis pour la formation du tube cardiaque est conservé au cours de l’évolution et retrouvé chez les mammifères. Il en est de même des interactions que ces signaux partagent au sein du réseau régulateur de la cardiogenèse [2]. Ainsi, chez la drosophile, des mutants de tinman présentent des défauts cardiaques sévères [3] et, chez l’homme, des mutations de Nkx2.5 sont associées à des maladies cardiaques congénitales [4].
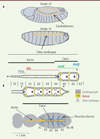 |
Figure 1. Formation du cœur de la drosophile. A. Durant les stades 13 à 16 de l’embryogenèse, les deux lignes de cardioblastes se rejoignent dorsalement pour former le tube cardiaque. Le schéma détaille la morphologie du tube cardiaque embryonnaire et larvaire et la localisation des profils d’expression des gènes homéotiques Antennapedia (Antp), Ultrabithorax (Ubx), abdominal A (abdA) et Abdominal B (AbdB) ainsi que ceux de tinman (tin) et seven-up (svp). Le tube cardiaque larvaire est remodelé pendant la métamorphose pour donner le cœur adulte. B. Les segments abdominaux 6 et 7 (A6-A7) sont éliminés par apoptose ; dans la région A1 à A4, les cardiomyocytes larvaires accroissent leur taille et trois paires d’ostioles se forment à partir des cellules de l’aorte exprimant Svp. Le cœur adulte acquiert ses activités myogéniques et pacemaker (position approximative indiquée par un astérisque), est connecté au système nerveux, contrairement au cœur embryonnaire et larvaire (non montré), et comporte trois paires de valves. Le cœur, localisé en position dorsale juste sous la cuticule abdominale de l’adulte, est maintenu par les muscles alaires qui le connectent à l’épiderme. |
L’organe mature en fin d’embryogenèse est constitué de 52 paires de cellules organisées de manière segmentée : 4 paires par segment expriment Tinman et forment les cardiomyocytes contractiles. Ils sont séparés par des paires de myocytes exprimant la protéine Seven-up qui, dans la partie cœur, forment les ostioles permettant l’entrée de l’hémolymphe dans la cavité cardiaque (Figure 1A). La direction du flux de l’hémolymphe vers la partie antérieure est potentiellement assurée par une paire de valves qui se différencie à la jonction entre l’aorte et le cœur.
Le tube cardiaque conserve sa morphologie générale au cours des stades larvaires. Il subit de profondes transformations morphologiques pendant la métamorphose qui conduit à l’adulte (Figure 1B). La partie la plus caudale est éliminée par apoptose et, dans l’aorte postérieure, les cardiomyocytes larvaires engagent un nouveau programme de différenciation conduisant au cœur adulte [5]. Ces évènements morphogénétiques sont sous le contrôle de différentes voies de signalisation dont certaines, à l’image de la voie PVF (pour PDGF [platelet-derived growth factor]/VEGF [vascular endothelial growth factor]) qui est impliquée dans la différenciation des valves au nombre de trois dans l’organe adulte [6], ont un rôle similaire chez les mammifères.
Tout comme chez l’embryon et la larve, le muscle cardiaque adulte est constitué d’une simple couche de myocytes dont les fibres sont orientées de manière transverse par rapport à l’axe du tube.
Un autre type cellulaire, non musculaire mais d’origine embryonnaire proche des cardiomyocytes, les cellules péricardiaques, fait partie intégrante du tube cardiaque. Les fonctions de ces cellules sont mal connues, mais des études montrent qu’elles jouent un rôle dans la régulation de la composition de l’hémolymphe par leur activité de filtration [7], et de la fonction cardiaque par une activité paracrine médiée par les dérivés réactifs de l’oxygène (ROS) [8]. Enfin, sur sa face ventrale, le cœur est étroitement juxtaposé à un muscle strié longitudinal ; il est suspendu à l’exosquelette par les muscles alaires, appelés parfois « ailes du cœur » en raison de leur forme (Figure 1B).
Au niveau fonctionnel, contrairement au cœur de l’embryon et de la larve, l’organe adulte est ciblé par des neurones glutamatergiques qui modulent son activité. Deux pacemakers 1, l’un antérieur et l’autre postérieur, génèrent un flux d’hémolymphe alterné qui assure le transport des nutriments, des cellules et peptides immunitaires ainsi que des hormones, mais pas de l’oxygène. Le transport de ce dernier est en effet assuré par un réseau de trachées qui connectent directement les organes avec le milieu extérieur. Cette séparation des fonctions représente un avantage décisif pour l’étude de la formation et de la fonction cardiaque, puisqu’il est possible d’étudier, chez la drosophile, l’effet de mutations qui affectent la fonction cardiaque sans qu’il n’y ait d’effet direct sur la survie.
Analyse de la fonction cardiaque chez la drosophile
De nombreuses protéines qui assurent la fonction cardiaque – notamment les canaux ioniques et les protéines contractiles – sont très conservées de la mouche aux mammifères. Les acteurs du couplage excitation/contraction régulé par le calcium, comme le filament épais de myosine, les composants du filament fin (actine, tropomyosine, troponines) mais également le récepteur à la ryanodine (RyR), la pompe calcique dépendante de l’ATP du réticulum sarcoplasmique (SERCA), les canaux ioniques possiblement impliqués dans l’activité pacemaker comme Ih/HCN (hyperpolarization-activated cyclic nucleotide modulated cation non-selective channel) [5], sont tous exprimés par les cardiomyocytes. Au niveau cellulaire, les cardiomyocytes de la mouche, comme ceux des mammifères, présentent des invaginations de la membrane plasmique formant des tubules T [9]. Ils sont mononucléés et sont connectés électriquement par des jonctions de type gap (jonctions communicantes). Ces parallèles aux niveaux moléculaire, cellulaire et physiologique suggèrent que le muscle cardiaque a évolué à partir d’une ébauche qui était présente avant la scission entre vertébrés et invertébrés. Il est donc possible de modéliser certains aspects de la physiopathologie cardiaque chez la drosophile. La mise au point cette dernière décennie de différentes techniques permettant d’évaluer la fonction cardiaque [10] a permis de valider la drosophile comme modèle des maladies cardiaques. Une méthode non invasive, la tomographie par cohérence optique, utilise une technique d’échographie sans contact afin de visualiser les contractions du cœur au travers de la cuticule abdominale [11]. Sa résolution est particulièrement adaptée à la mesure de la fréquence cardiaque et à la variation de la taille du cœur que l’on observe, notamment dans des modèles de drosophile de cardiomyopathies dilatées [11]. Pour l’analyse du rythme et de la contractilité, une meilleure précision est obtenue avec des préparations semi-intactes dans lesquelles le cœur de la mouche nettoyé du corps gras, baigne dans une solution physiologique oxygénée. À partir de films réalisés à haute vitesse et à haute résolution [12], est créée une image globale, similaire aux M-modes2 qui sont générés en échographie cardiaque, qui décrit les mouvements des bords du tube cardiaque au cours du temps (Figure 2).
 |
Figure 2. Représentation par M-Modes des mouvements du cœur au cours du temps. A. Sur une préparation semi-intacte de cœur un film est réalisé dans la région A3-A4. Sur chaque image du film une bande de 1 pixel est extraite digitalement en une position donnée ; la juxtaposition de chacune des bandes donne l’image M-Mode montrant les mouvements des bords du cœur en fonction du temps. À partir de cette image les paramètres caractéristiques de la morphologie et de la fonction du cœur sont quantifiés. Intervalle systolique (SI) : durée entre le début et la fin d’une contraction ; intervalle diastolique (DI) : temps de pause entre deux contractions consécutives ; période cardiaque (HP) : période de temps comprise entre le début d’une contraction et le début de la contraction suivante ; diamètre diastolique (DD) : diamètre maximum dans la phase de relaxation ; diamètre systolique (DS) : diamètre minimum dans la phase de contraction. B. Trois exemples de tracé M-Mode. De haut en bas. Cœurs normaux âgés de 1 et 4 semaines montrant les altérations observées au cours du vieillissement : la période cardiaque est modifiée avec l’allongement des intervalles diastoliques, le rythme devient irrégulier et le diamètre diastolique diminue. En bas : cœur d’une lignée porteuse d’une mutation en cours de caractérisation (non publié), âgé de 1 semaine présentant des paramètres anormaux : allongement des intervalles diastoliques, périodes de contraction soutenues interrompues par de très courts temps de relaxation et augmentation du diamètre diastolique. Noter que dans les préparations semi-intactes, seule l’activité myogénique du cœur est analysée, car il est déconnecté du système nerveux. |
Ainsi, le cœur de la mouche est-il devenu un modèle génétique non seulement des cardiomyopathies congénitales – résultant de défauts survenus au cours du développement – mais aussi pour comprendre des anomalies structurelles et fonctionnelles telles que les cardiomyopathies et les arythmies dont certains aspects seront décrits plus en détail dans cette synthèse.
Modèle de cardiomyopathies
Plus d’une cinquantaine de gènes ont été identifiés comme causals dans les cardiomyopathies chez l’homme [13]. Ces pathologies, qui se développent progressivement et apparaissent en général tardivement chez l’adulte, sont caractérisées par une atteinte de la fonction et de la structure du muscle cardiaque. On distingue notamment les cardiomyopathies dilatées (CMD), hypertrophiques (CMH) et restrictives (CMR). La majorité des mutations à l’origine des cardiomyopathies affectent des composants très conservés du cardiomyocyte. Cependant, la physiopathologie des cardiomyopathies est très complexe. Des variants d’un même gène peuvent ainsi conduire à différents types de cardiomyopathies et leur sévérité peut varier en fonction de la présence de mutations touchant d’autres gènes. Dans ce cadre, le cœur de la drosophile est un système précieux pour modéliser l’effet des mutations et comprendre les mécanismes fondamentaux qui conduisent au cœur pathologique. Il répond en effet de façon comparable à l’organe humain aux altérations des propriétés mécaniques et fonctionnelles des composants du cardiomyocyte [14, 15] (Tableau I). Par exemple, une myosine hypoactive conduit chez la mouche adulte, comme chez l’homme, à une augmentation de la taille du cœur, une altération de sa fonction de contraction et une augmentation des arythmies avec l’âge caractéristiques d’une CMD. Une étude originale menée chez la drosophile a montré par ailleurs qu’une myosine hyperactive conduit en revanche à une diminution de la lumière cardiaque et une relaxation incomplète entre les contractions typiques d’une CMR, suggérant que chez l’homme, une augmentation de l’activité motrice de la myosine est à l’origine des formes rares de CMR [16].
Exemples de cardiomyopathies modélisées chez la drosophile. Les mutations entraînent des cardiomyopathies chez l’homme et affectent des gènes conservés codant des protéines du sarcomère. CMH : cardiomyopathie hypertrophique ; CMD : cardiomyopathie dilatée ; CMR : cardiomyopathie restrictive.
Un avantage incontournable du modèle drosophile est la possibilité de réaliser des cribles afin d’identifier des gènes et des interactions génétiques jouant un rôle dans le maintien de la structure et de la fonction cardiaque, ou de sélectionner des drogues susceptibles de moduler la sévérité des cardiomyopathies. Récemment, par exemple, un crible d’inhibiteurs d’histones déacétylases (HDAC)3 a été réalisé dans un modèle de fibrillation atriale développé chez la drosophile permettant de mettre en évidence l’effet protecteur de l’inhibiteur spécifique de l’HDAC6 contre la perte graduelle de la structure des sarcomères et les défauts de contraction cardiaque. Ces résultats ont été reproduits dans un modèle de cardiomyocyte de souris [23, 24]. Cette enzyme qui cible in vivo la tubuline alpha est ainsi une cible thérapeutique prometteuse pour traiter des patients atteints de certaines formes de fibrillation atriale.
Parmi les cribles réalisés sur la base de variations de la taille et de la fonction du cœur, l’inactivation de plus de 7 000 gènes de drosophile homologues à des gènes humains, spécifiquement dans le cœur [25], a été à l’origine de l’établissement d’une carte globale des gènes et des voies conservés qui jouent un rôle dans la fonction cardiaque. Ce crible a en particulier permis de révéler le rôle du complexe multifonctionnel Ccr4-Not, porteur des activités enzymatiques déadénylase et ubiquitine ligase et connu pour son rôle central dans la régulation de l’expression génique. En effet, chez la mouche, l’inhibition de la sous-unité Not3 conduit à des défauts d’organisation des myofibrilles et une détérioration de la contractilité du cœur. Des phénotypes similaires sont retrouvés dans les souris dont le gène codant Not3 a été inactivé, et un polymorphisme dans ce gène a été associé chez l’homme à une modification du rythme cardiaque. Cette étude souligne qu’un crible fonctionnel mené chez la drosophile permet d’identifier des candidats qui peuvent être directement transférés chez les mammifères et permet de proposer de nouveaux régulateurs de la fonction et de la défaillance cardiaques. Un autre crible fondé sur la dilatation de la chambre cardiaque d’une collection de mouches porteuses de délétions génomiques [26] a permis d’identifier le gène Rhomboid3. Ce gène code une protéase conservée qui hydrolyse la protéine Spitz, homologue du facteur de croissance EGF (epidermal growth factor). L’inactivation du récepteur à l’EGF (EGFR), spécifiquement dans le cœur de la drosophile, conduit à la dilatation progressive de l’organe adulte. De même, des souris dont le gène codant Erb2, un membre de la famille des récepteurs de l’EGF, a été inactivé et des patients soumis à une chimiothérapie ciblant Erb2, développent une cardiomyopathie dilatée. Cette étude suggère un rôle nouveau de la voie de signalisation EGFR dans le maintien de la fonction cardiaque. Elle fournit également des indications sur les mécanismes contribuant à l’apparition de cardiomyopathies induites par cette chimiothérapie.
L’altération de la fonction cardiaque peut aussi être associée, chez l’homme, à des défauts congénitaux touchant le cœur, comme c’est le cas de patients atteints du syndrome de Down, chez lesquels une duplication d’une petite partie du chromosome 21 a été mise en cause. Afin d’identifier des gènes, conservés entre homme et drosophile, dont l’interaction contribuerait à l’apparition d’une atteinte cardiaque chez ces personnes, une stratégie originale a été élaborée [27] : six gènes humains et leurs homologues chez la drosophile, appartenant à la région dupliquée et codant des protéines extracellulaires ou des protéines susceptibles d’interagir avec elles, ont été surexprimés dans le cœur de la mouche, indépendamment ou en combinaison. L’analyse des perturbations de la fréquence cardiaque, de la contraction et de la récupération du rythme après un stress a permis de mettre en évidence une interaction entre la protéine d’adhésion transmembranaire DSCAM (Down syndrome cell adhesion molecule) et un composant de la matrice extracellulaire, COL6A2 (la sous-unité alpha 2 du collagène de type VI). Cette coopération, qui est observée également chez la souris et dans des cellules cardiaques humaines, est associée, par ailleurs, à la surexpression de gènes impliqués dans l’adhésion cellulaire. L’altération des capacités d’adhérence et de migration des cellules pourrait expliquer les défauts de développement et/ou de fonctionnement du cœur de ces patients. L’identification de composés permettant de moduler l’expression de ces gènes est donc un enjeu de thérapie prometteur.
Cardiopathies et métabolisme
Les cardiomyopathies peuvent aussi trouver leur origine dans des perturbations métaboliques comme dans le cas des cardiomyopathies lipotoxiques [28] qui sont associées à l’obésité et au diabète. De manière remarquable, des mouches alimentées avec un régime riche en lipides développent des phénotypes caractéristiques de l’obésité – niveaux élevés de triglycérides, altération de la voie de l’insuline et de l’homéostasie du glucose – qui sont similaires aux réponses que l’on observe chez les mammifères [29]. Chez la drosophile, les lipides s’accumulent aussi au niveau du cœur conduisant à une réduction de sa contractilité et à des défauts structuraux symptomatiques de la lipotoxicité cardiaque qui rappellent les cardiomyopathies associées au diabète. Ces phénotypes sont prévenus lorsque la voie insuline-TOR (target of rapamycin) est bloquée, ou lorsque la lipolyse des triglycérides est induite spécifiquement dans le cœur, indiquant que la dérégulation de la voie insuline-TOR au sein même de l’organe est responsable des effets délétères observés. Ces observations suggèrent donc que l’inhibition de la voie TOR, ou de la biogenèse des lipides ciblée dans le cœur, peut représenter une voie thérapeutique dans l’obésité et ses effets sur la fonction cardiaque. L’activation du régulateur de la transcription SREBP (sterol-regulatory element-binding protein), un facteur de transcription des gènes qui participent à la régulation du taux de cholestérol de la cellule, par la voie TOR [30], ou de ses cibles lipogéniques [31], conduit, au niveau cardiaque, à des effets similaires à ceux observés dans les mouches « obèses ». Une étude récente permet d’apporter une vision encore plus intégrée des mécanismes régulateurs mis en jeu à la suite d’un régime riche en lipides et de leur relation avec la fonction cardiaque. Chez les mammifères, le co-activateur de transcription PGC-1 (peroxisome proliferator-activated receptor-gamma coactivator 1) est impliqué dans l’oxydation des acides gras mitochondriaux dans les muscles et différentes études suggèrent qu’il aurait un rôle dans le contrôle du métabolisme et de la fonction cardiaques [32]. Or, chez la drosophile, dPGC-1, son homologue, est capable de compenser l’obésité et la lipotoxicité cardiaque induite par un régime riche en lipides [33]. La réduction de l’activité de PGC-1 entraîne une accumulation excessive de lipides et des défauts de fonction cardiaque très similaires à ceux observés dans des mouches de type sauvage ayant été exposées à un régime riche en lipides. De plus, les effets délétères d’un tel régime alimentaire sont supprimés par la surexpression systémique, ou restreinte au muscle cardiaque, de PGC-1. Par ailleurs, en étudiant les interactions génétiques potentielles entre les différents acteurs, il a été montré que dPGC-1 agit comme un régulateur négatif en aval de la voie TOR et de la lipase ATGL (adipose triglyceride lipase) mais indépendamment du facteur de transcription SREBP et de FAS (fatty acid synthase) [33]. La versatilité des approches génétiques a donc permis de dresser, chez la drosophile, une carte intégrée des réseaux moléculaires impliqués dans les dysfonctions cardiaques liées à certaines perturbations métaboliques (Figure 3). Étant donné le niveau de conservation élevé des acteurs impliqués, cette connaissance fondamentale permet de mieux appréhender les mécanismes mis en œuvre dans les cardiopathies métaboliques chez l’homme.
 |
Figure 3. Réseau génétique impliqué dans la lipotoxicité cardiaque induite par une alimentation riche en graisses. L’activation de la voie TOR (target of rapamycin) module deux voies impliquées dans le métabolisme des lipides. La lipolyse est réduite par la diminution de l’expression de l’adipose triglycéride lipase (ATGL) et de PGC-1 (peroxisome-proliferator-activated receptor co-activator-1), respectivement brummer (bmm) et spargel (srl) chez la drosophile. La lipogenèse est accentuée par l’augmentation de l’expression du facteur lipogénique SREBP (sterol-regulatory element-binding protein) et de l’acide gras synthase (FAS). Ce mécanisme conduit à l’accumulation toxique de lipides dans le cœur induisant le dysfonctionnement de l’organe (adapté de [33]). |
Vieillissement cardiaque
Au cours du vieillissement, l’altération de la structure et de la fonction cardiaque contribue à l’augmentation du risque de maladies cardiovasculaires et l’augmentation de la durée de vie rend de plus en plus pressante la nécessité de comprendre les mécanismes moléculaires du vieillissement cardiaque [44] (→).
(→) Voir la synthèse de J. Mialet-Perez et al., m/s n° 11, novembre 2015, page 1006
Ce processus complexe, caractérisé notamment par une diminution de la capacité de cardio-accélération et par une augmentation de l’incidence des arythmies [34], est influencé par des interactions entre l’âge, le mode de vie, diverses pathologies et des composants génétiques. L’analyse des fondements génétiques du vieillissement cardiaque chez les modèles mammifères est difficile du fait de leur durée de vie relativement longue, de leur complexité génétique (en particulier, de la redondance génétique) et de la difficulté à contrôler les interactions entre l’âge, les maladies et l’environnement. Les modèles invertébrés tels que la drosophile et le nématode ont été essentiels pour comprendre la régulation génétique de la durée de vie et plusieurs mécanismes centraux de ce processus ont été ensuite identifiés comme conservés chez les vertébrés, en particulier la modulation des voies insuline et TOR et la restriction calorique [35]. La mise au point récente de méthodes pour analyser la physiologie cardiaque chez la mouche adulte (voir ci-dessus) permet désormais d’étudier le vieillissement de la fonction cardiaque chez la drosophile et ce champ de recherche est devenu particulièrement fertile. La durée de vie courte (50 à 70 jours à 25 °C), la possibilité d’élever de larges cohortes d’individus dans un environnement très contrôlé, la versatilité des outils génétiques à disposition sont en effet autant d’avantages clefs de la drosophile pour l’étude du vieillissement fonctionnel du muscle cardiaque. Une étude pionnière [36] a mis en évidence, que chez la mouche, le vieillissement s’accompagne d’une diminution de la réserve cardiaque4 et d’une augmentation des arythmies, deux caractéristiques centrales du vieillissement qui sont partagées avec les mammifères. D’autres études [37–39] ont depuis largement confirmé ces observations. Elles ont montré que le vieillissement s’accompagne également d’une diminution du débit cardiaque [39, 40] et de défauts structuraux au niveau des cardiomyocytes, qui sont liés à une désorganisation progressive du réseau de myofibrilles [20].
Au niveau génétique et moléculaire, les études réalisées par Wessels et ses collaborateurs [37] ont établi que l’inhibition de la voie de l’insuline au niveau du cœur est suffisante pour ralentir les effets du vieillissement sur la performance cardiaque. Cet effet, localisé au niveau du muscle cardiaque, n’a cependant pas de conséquence sur la longévité, sans doute en raison de la détérioration liée à l’âge d’autres organes essentiels. Cette observation souligne l’intérêt particulier de la mouche pour l’analyse du vieillissement cardiaque puisqu’elle permet d’étudier des modifications de la fonction cardiaque liées à l’âge indépendamment de la longévité. Cette approche est impossible dans les systèmes vertébrés pour lesquels le transport d’oxygène est directement dépendant du muscle cardiaque et la fonction cardiaque intrinsèquement liée à la longévité. En outre, l’inhibition restreinte au niveau du myocarde de la voie TOR, qui partage de nombreuses interactions avec la voie de l’insuline, permet, elle aussi, de ralentir les effets de l’âge sur la fonction cardiaque [30, 41]. Ainsi deux voies majeures de détection de nutriments interviennent dans la régulation de la détérioration de la fonction cardiaque au cours du vieillissement.
D’autres études ont permis de caractériser une poignée de gènes dont l’activité est impliquée au cours du vieillissement cardiaque (pour revue voir [42]). Cependant, malgré ces études pionnières, les voies moléculaires participant à la détérioration progressive de la fonction cardiaque sont restées, pour l’essentiel, longtemps mal identifiées. Afin d’acquérir une vision plus globale du contrôle génétique du vieillissement cardiaque, nous en avons récemment identifié les signatures moléculaires [39]. Une comparaison des transcriptomes cardiaques de mouches jeunes et vieillissantes, couplée à une prédiction in silico des réseaux de gènes régulateurs impliqués, a permis de mettre en évidence le rôle possible du stress oxydatif, de la voie de signalisation JNK (c-Jun N-terminal protein kinases) et du facteur de transcription Vri/NFIL3 (vrille/nuclear factor interleukin 3 regulated) dans le contrôle de la sénescence de la fonction cardiaque liée à l’âge. L’ensemble de ces prédictions ont pu être validées in vivo par des manipulations génétiques ou pharmacologiques. Le stress oxydatif joue un rôle central dans le vieillissement cardiaque et la perte de fonction partielle ciblée dans le cœur de dJun (l’effecteur transcriptionel de la voie JNK) et de Vri/NFIL3 ralentit les effets de l’âge sur la fonction cardiaque. Ces composants sont ainsi des régulateurs centraux du vieillissement du cœur dont l’activité augmente la sénescence de la fonction cardiaque. Cette étude montre l’intérêt des approches globales et sans a priori pour étudier un processus complexe tel que le vieillissement cardiaque. Elle suggère que les membres du réseau de gènes régulateurs identifiés chez la drosophile, puissent être également impliqués dans le vieillissement cardiaque chez les vertébrés.
Perspectives
La drosophile, qui est l’organisme modèle le plus simple doté d’un muscle cardiaque, a un immense potentiel pour l’identification des gènes et des réseaux géniques de première importance impliqués dans le développement cardiaque et dans sa physiologie. La conservation évolutive du développement et de la fonction du cœur de la mouche, associée aux outils génétiques disponibles pour l’étude des processus dépendants de la fonction des gènes et des interactions multigéniques sont autant d’avantages qu’aucun autre système modèle ne propose. La morphologie du cœur, et certains détails de sa physiologie, chez la drosophile, sont clairement différents de ceux du cœur des mammifères. Le tube cardiaque de la mouche n’est ainsi pas adapté à l’analyse de certains processus morphogénétiques complexes qui sont spécifiques des mammifères (la formation de la boucle et la septation en particulier). De même, les mécanismes d’ischémie/reperfusion ou encore la coordination des contractions entre les différentes chambres cardiaques ne peuvent être modélisés chez la mouche. Mais, tout en gardant en tête ces limitations, il apparaît aujourd’hui que les acteurs génétiques centraux du développement et de la fonction cardiaque, de même que leurs interactions, sont conservés. Dans la mesure où la nature multigénique des pathologies cardiaques humaines représente une difficulté majeure, le cœur de la mouche apparaît être un modèle de choix, simple et rapide, permettant d’identifier les gènes et leurs interactions impliqués dans les pathologies cardiaques. À cette fin, des approches globales et intégratives apparaissent particulièrement prometteuses [25, 39]. Le développement de nouvelles ressources et outils (approches « omiques », lignées consanguines séquencées qui permettent d’effectuer des analyses d’association génétique à l’échelle du génome [43] avec la connaissance de l’ensemble des variations génétiques, développement d’approches bio-informatiques pour l’analyse de réseaux) ouvre de nouvelles perspectives pour appréhender ces questions par des approches de biologie des systèmes, qui permettront d’aborder ces questions dans leur complexité.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Perrin L, Monier B, Ponzielli R, et al. Drosophila cardiac tube organogenesis requires multiple phases of Hox activity. Dev Biol 2004 ; 272 : 419–431. [CrossRef] [PubMed] [Google Scholar]
- Cripps RM, Olson EN. Control of cardiac development by an evolutionarily conserved transcriptional network. Dev Biol 2002 ; 246 : 14–28. [CrossRef] [PubMed] [Google Scholar]
- Zaffran S, Reim I, Qian L, et al. Cardioblast-intrinsic Tinman activity controls proper diversification and differentiation of myocardial cells in Drosophila. Development 2006 ; 133 : 4073–4083. [CrossRef] [PubMed] [Google Scholar]
- McCulley DJ, Black BL. Transcription factor pathways and congenital heart disease. Curr Top Dev Biol 2012 ; 100 : 253–277. [CrossRef] [PubMed] [Google Scholar]
- Monier B, Astier M, Sémériva M, et al. Steroid-dependent modification of Hox function drives myocyte reprogramming in the Drosophila heart. Development 2005 ; 132 : 5283–5293. [CrossRef] [PubMed] [Google Scholar]
- Zeitouni B, Sénatore S, Séverac D, et al. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet 2007 ; 3 : 1907–1921. [CrossRef] [PubMed] [Google Scholar]
- Denholm B, Skaer H. Bringing together components of the fly renal system. Curr Opin Genet Dev 2009 ; 19 : 526–532. [CrossRef] [PubMed] [Google Scholar]
- Lim HY, Wang W, Chen J, et al. ROS regulate cardiac function via a distinct paracrine mechanism. Cell Rep 2014 ; 7 : 35–44. [CrossRef] [PubMed] [Google Scholar]
- Lehmacher C, Abeln B, Paululat A. The ultrastructure of Drosophila heart cells. Arthropod Struct Dev 2012 ; 41 : 459–474. [CrossRef] [PubMed] [Google Scholar]
- Ocorr K, Vogler G, Bodmer R. Methods to assess Drosophila heart development, function and aging. Methods 2014 ; 68 : 265–272. [CrossRef] [PubMed] [Google Scholar]
- Wolf MJ, Amrein H, Izatt JA, et al. Drosophila as a model for the identification of genes causing adult human heart disease. Proc Natl Acad Sci USA 2006 ; 103 : 1394–1399. [CrossRef] [Google Scholar]
- Fink M, Callol-Massot C, Chu A, et al. A new method for detection and quantification of heartbeat parameters in Drosophila, zebrafish, and embryonic mouse hearts. Biotechniques 2009 ; 46 : 101–113. [CrossRef] [PubMed] [Google Scholar]
- McNally EM, Barefield DY, Puckelwartz MJ. The genetic landscape of cardiomyopathy and its role in heart failure. Cell Metab 2015 ; 21 : 174–182. [CrossRef] [PubMed] [Google Scholar]
- Taghli-Lamallem O, Bodmer R, Chamberlain JS, et al. Genetics and pathogenic mechanisms of cardiomyopathies in the Drosophila model. Drug Discov Today Dis Model 2008 ; 5 : 125–134. [CrossRef] [Google Scholar]
- Wolf MJ. Modeling dilated cardiomyopathies in Drosophila. Trends Cardiovasc Med 2012 ; 22 : 55–61. [CrossRef] [PubMed] [Google Scholar]
- Cammarato A, Dambacher CM, Knowles AF, et al. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell 2008 ; 19 : 553–562. [CrossRef] [PubMed] [Google Scholar]
- Viswanathan MC, Kaushik G, Engler AJ, et al. A Drosophila melanogaster model of diastolic dysfunction and cardiomyopathy based on impaired troponin-T function. Circ Res 2014 ; 114 : 6–17. [CrossRef] [Google Scholar]
- Allikian MJ, Bhabha G, Dospoy P, et al. Reduced life span with heart and muscle dysfunction in Drosophila sarcoglycan mutants. Hum Mol Genet 2007 ; 16 : 2933–2943. [CrossRef] [PubMed] [Google Scholar]
- Goldstein JA, Kelly SM, LoPresti PP, et al. SMAD signaling drives heart and muscle dysfunction in a Drosophila model of muscular dystrophy. Hum Mol Genet 2011 ; 20 : 894–904. [CrossRef] [PubMed] [Google Scholar]
- Taghli-Lamallem O, Akasaka T, Hogg G, et al. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell 2008 ; 7 : 237–249. [CrossRef] [PubMed] [Google Scholar]
- Taghli-Lamallem O, Jagla K, Chamberlain JS, et al. Mechanical and non-mechanical functions of dystrophin can prevent cardiac abnormalities in Drosophila. Exp Gerontol 2014 ; 49 : 26–34. [CrossRef] [PubMed] [Google Scholar]
- Xie HB, Cammarato A, Rajasekaran NS, et al. The NADPH metabolic network regulates human αB-crystallin cardiomyopathy and reductive stress in Drosophila melanogaster. PLoS Genet 2013 ; 9 : e1003544. [CrossRef] [PubMed] [Google Scholar]
- Zhang D, Ke L, Mackovicova K, et al. Effects of different small HSPB members on contractile dysfunction and structural changes in a Drosophila melanogaster model for atrial fibrillation. J Mol Cell Cardiol 2011 ; 51 : 381–389. [CrossRef] [PubMed] [Google Scholar]
- Zhang D, Wu CT, Qi XY, et al. Activation of histone deacetylase-6 induces contractile dysfunction through derailment of α-tubulin proteostasis in experimental and human atrial fibrillation. Circulation 2014 ; 129 : 346–358. [CrossRef] [PubMed] [Google Scholar]
- Neely GG, Kuba K, Cammarato A, et al. A global in vivo Drosophila RNAi screen identifies NOT3 as a conserved regulator of heart function. Cell 2010 ; 141 : 142–153. [CrossRef] [PubMed] [Google Scholar]
- Yu L, Lee T, Lin N, et al. Affecting Rhomboid-3 function causes a dilated heart in adult Drosophila. PLoS Genet 2010 ; 6 : e1000969. [CrossRef] [PubMed] [Google Scholar]
- Grossman TR, Gamliel A, Wessells RJ, et al. Over-expression of DSCAM and COL6A2 cooperatively generates congenital heart defects. PLoS Genet 2011 ; 7 : e1002344. [CrossRef] [PubMed] [Google Scholar]
- Borradaile NM, Schaffer JE. Lipotoxicity in the heart. Curr Hypertens Rep 2005 ; 7 : 412–417. [CrossRef] [PubMed] [Google Scholar]
- Birse RT, Choi J, Reardon K, et al. High-fat-diet-induced obesity and heart dysfunction are regulated by the TOR pathway in Drosophila. Cell Metab 2010 ; 12 : 533–544. [CrossRef] [PubMed] [Google Scholar]
- Lee JH, Budanov A V, Park EJ, et al. Sestrin as a feedback inhibitor of TOR that prevents age-related pathologies. Science 2010 ; 327 : 1223–1228. [CrossRef] [PubMed] [Google Scholar]
- Lim HY, Bodmer R. Phospholipid homeostasis and lipotoxic cardiomyopathy: a matter of balance. Fly (Austin) 2011 ; 5 : 234–236. [CrossRef] [PubMed] [Google Scholar]
- Patten IS, Arany Z. PGC-1 coactivators in the cardiovascular system. Trends Endocrinol Metab 2012 ; 23 : 90–97. [CrossRef] [PubMed] [Google Scholar]
- Diop SB, Bisharat-Kernizan J, Birse RT, et al. PGC-1/spargel counteracts high-fat-diet-induced obesity and cardiac lipotoxicity downstream of TOR and brummer ATGL lipase. Cell Rep 2015 ; 10 : 1572–1584. [CrossRef] [PubMed] [Google Scholar]
- Lakatta EG. Heart aging: a fly in the ointment?. Circ Res 2001 ; 88 : 984–986. [CrossRef] [PubMed] [Google Scholar]
- Fadini GP, Ceolotto G, Pagnin E, et al. At the crossroads of longevity and metabolism: the metabolic syndrome and lifespan determinant pathways. Aging Cell 2011 ; 10 : 10–17. [CrossRef] [PubMed] [Google Scholar]
- Paternostro G, Vignola C, Bartsch DU, et al. Age-associated cardiac dysfunction in Drosophila melanogaster. Circ Res 2001 ; 88 : 1053–1058. [CrossRef] [PubMed] [Google Scholar]
- Wessells RJ, Fitzgerald E, Cypser JR, et al. Insulin regulation of heart function in aging fruit flies. Nat Genet 2004 ; 36 : 1275–1281. [CrossRef] [PubMed] [Google Scholar]
- Ocorr K, Perrin L, Lim H-Y, et al. Genetic control of heart function and aging in Drosophila. Trends Cardiovasc Med 2007 ; 17 : 177–182. [CrossRef] [PubMed] [Google Scholar]
- Monnier V, Iché-Torres M, Rera M, et al. dJun and Vri/dNFIL3 are major regulators of cardiac aging in Drosophila. PLoS Genet 2012 ; 8 : e1003081. [CrossRef] [PubMed] [Google Scholar]
- Gill S, Le HD, Melkani GC, et al. Time-restricted feeding attenuates age-related cardiac decline in Drosophila. Science 2015 ; 347 : 1265–1269. [CrossRef] [PubMed] [Google Scholar]
- Luong N, Davies CR, Wessells RJ, et al. Activated FOXO-mediated insulin resistance is blocked by reduction of TOR activity. Cell Metab 2006 ; 4 : 133–142. [CrossRef] [PubMed] [Google Scholar]
- Nishimura M, Ocorr K, Bodmer R, et al. Drosophila as a model to study cardiac aging. Exp Gerontol 2011 ; 46 : 326–330. [CrossRef] [PubMed] [Google Scholar]
- Mackay TFC, Richards S, Stone EA, et al. The Drosophila melanogaster genetic reference panel. Nature 2012 ; 482 : 173–178. [CrossRef] [PubMed] [Google Scholar]
- Mialet-Perez J, Douin-Echinard V, Cussac F. Vieillissement. Med Sci (Paris) 2015 ; 31 : 1006–1013. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des tableaux
Exemples de cardiomyopathies modélisées chez la drosophile. Les mutations entraînent des cardiomyopathies chez l’homme et affectent des gènes conservés codant des protéines du sarcomère. CMH : cardiomyopathie hypertrophique ; CMD : cardiomyopathie dilatée ; CMR : cardiomyopathie restrictive.
Liste des figures
 |
Figure 1. Formation du cœur de la drosophile. A. Durant les stades 13 à 16 de l’embryogenèse, les deux lignes de cardioblastes se rejoignent dorsalement pour former le tube cardiaque. Le schéma détaille la morphologie du tube cardiaque embryonnaire et larvaire et la localisation des profils d’expression des gènes homéotiques Antennapedia (Antp), Ultrabithorax (Ubx), abdominal A (abdA) et Abdominal B (AbdB) ainsi que ceux de tinman (tin) et seven-up (svp). Le tube cardiaque larvaire est remodelé pendant la métamorphose pour donner le cœur adulte. B. Les segments abdominaux 6 et 7 (A6-A7) sont éliminés par apoptose ; dans la région A1 à A4, les cardiomyocytes larvaires accroissent leur taille et trois paires d’ostioles se forment à partir des cellules de l’aorte exprimant Svp. Le cœur adulte acquiert ses activités myogéniques et pacemaker (position approximative indiquée par un astérisque), est connecté au système nerveux, contrairement au cœur embryonnaire et larvaire (non montré), et comporte trois paires de valves. Le cœur, localisé en position dorsale juste sous la cuticule abdominale de l’adulte, est maintenu par les muscles alaires qui le connectent à l’épiderme. |
| Dans le texte | |
 |
Figure 2. Représentation par M-Modes des mouvements du cœur au cours du temps. A. Sur une préparation semi-intacte de cœur un film est réalisé dans la région A3-A4. Sur chaque image du film une bande de 1 pixel est extraite digitalement en une position donnée ; la juxtaposition de chacune des bandes donne l’image M-Mode montrant les mouvements des bords du cœur en fonction du temps. À partir de cette image les paramètres caractéristiques de la morphologie et de la fonction du cœur sont quantifiés. Intervalle systolique (SI) : durée entre le début et la fin d’une contraction ; intervalle diastolique (DI) : temps de pause entre deux contractions consécutives ; période cardiaque (HP) : période de temps comprise entre le début d’une contraction et le début de la contraction suivante ; diamètre diastolique (DD) : diamètre maximum dans la phase de relaxation ; diamètre systolique (DS) : diamètre minimum dans la phase de contraction. B. Trois exemples de tracé M-Mode. De haut en bas. Cœurs normaux âgés de 1 et 4 semaines montrant les altérations observées au cours du vieillissement : la période cardiaque est modifiée avec l’allongement des intervalles diastoliques, le rythme devient irrégulier et le diamètre diastolique diminue. En bas : cœur d’une lignée porteuse d’une mutation en cours de caractérisation (non publié), âgé de 1 semaine présentant des paramètres anormaux : allongement des intervalles diastoliques, périodes de contraction soutenues interrompues par de très courts temps de relaxation et augmentation du diamètre diastolique. Noter que dans les préparations semi-intactes, seule l’activité myogénique du cœur est analysée, car il est déconnecté du système nerveux. |
| Dans le texte | |
 |
Figure 3. Réseau génétique impliqué dans la lipotoxicité cardiaque induite par une alimentation riche en graisses. L’activation de la voie TOR (target of rapamycin) module deux voies impliquées dans le métabolisme des lipides. La lipolyse est réduite par la diminution de l’expression de l’adipose triglycéride lipase (ATGL) et de PGC-1 (peroxisome-proliferator-activated receptor co-activator-1), respectivement brummer (bmm) et spargel (srl) chez la drosophile. La lipogenèse est accentuée par l’augmentation de l’expression du facteur lipogénique SREBP (sterol-regulatory element-binding protein) et de l’acide gras synthase (FAS). Ce mécanisme conduit à l’accumulation toxique de lipides dans le cœur induisant le dysfonctionnement de l’organe (adapté de [33]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




