| Issue |
Med Sci (Paris)
Volume 30, Number 4, Avril 2014
|
|
|---|---|---|
| Page(s) | 372 - 377 | |
| Section | Microenvironnements tumoraux : conflictuels et complémentaires | |
| DOI | https://doi.org/10.1051/medsci/20143004009 | |
| Published online | 05 May 2014 | |
Microenvironnement tumoral
La vision du pathologiste
Tumor microenvironment and the pathologist: looking at what we just see
Département de biologie et de pathologie, Institut Claudius Regaud, 20-24, rue du pont Saint-Pierre, 31052
Toulouse Cedex, France
*
leguellec.sophie@claudiusregaud.fr
**
duprez-paumier.raphaelle@claudiusregaud.fr
***
lacroix.magali@claudiusregaud.fr
Grâce aux avancées des technologies de biologie moléculaire, des progrès majeurs ont été accomplis ces dernières années dans la compréhension de la biologie tumorale. Si la cible première reste la cellule cancéreuse, le microenvironnement est clairement indissociable de cette dernière et joue un rôle primordial dans la prise en charge diagnostique, à toutes les étapes du parcours clinique et histopathologique. L’analyse du microenvironnement fait en effet partie intégrante non seulement du diagnostic histologique de tumeur (élément essentiel permettant la classification histologique des tumeurs), mais aussi de l’évaluation pronostique de la maladie, et même de la stratégie thérapeutique. Au cours des prochaines années, de nouveaux biomarqueurs pronostiques et/ou prédictifs, représentatifs du stroma tumoral, seront certainement proposés et passeront les phases de validation clinique.
Abstract
Owing to the phenomenal advances in molecular technology, the past few years have seen drastic improvements in the knowledge of tumor biology. Whilst efforts are still focused on the cancer cell, it is now clear that analysis of the tumor microenvironment plays a major role in the management of cancer. Known for years as the “stroma reaction”, tumor microenvironment was commonly used by pathologists as helpful criteria to establish the diagnostic of histological subtypes. More recently however, research on tumor microenvironment (and immune response in particular) has provided numerous evidences to support a leading role in the assessment of cancer prognosis, and open new avenues in treatment of cancer patients. Prognostic and/or predictive biomarkers issued from this research will have to get through the validation process required by international consensus conferences before any implementation in clinical practice.
© 2014 médecine/sciences – Inserm
Vu par le pathologiste, le microenvironnement « normal », spécifique du tissu et de l’organe qui le contiennent, correspond, d’une part, à des éléments de la matrice extracellulaire (fibres, substance fondamentale, macromolécules et glycoprotéines), et, d’autre part, à des types cellulaires éminemment variables, identifiés et classés assez aisément dans deux grandes composantes du tissu conjonctif : le compartiment mésenchymateux (fibroblastes, myofibroblastes, adipocytes, cellules endothéliales et péricytes) et le compartiment immunitaire (lymphocytes, plasmocytes, macrophages, cellules dendritiques, mastocytes, polynucléaires). Lorsqu’une tumeur se développe, tous ces différents éléments du microenvironnement sont capables d’interagir à des degrés divers avec les cellules tumorales [1]. Cette interaction est bidirectionnelle, puisque, d’une part, des perturbations au sein du microenvironnement peuvent avoir des effets pro-oncogéniques favorisant la tumorigenèse ou la croissance tumorale, et, d’autre part, le processus tumoral est également capable d’entraîner en retour des modifications du microenvironnement [2–5, 40] (→).
(→ Voir la Synthèse de W.H. Fridman et C. Sautès-Fridman, page 359 de ce numéro
Lors du diagnostic histopathologique, le microenvironnement est décrit quotidiennement dans ce que le pathologiste nomme « stroma réaction » selon le terme consacré, et que nous désignerons par réaction stromale dans la suite de cette revue. C’est ainsi qu’en matière de pathologie tumorale sont décrits deux types principaux de réaction stromale, fibreuse ou scléro-hyaline, et inflammatoire. À ces deux éléments principaux s’ajoutent d’autres caractéristiques histologiques prises en compte par le pathologiste, telles que la présence de nécrose ou le type et l’intensité de la néovascularisation. L’exemple du cancer du sein est principalement choisi dans cette revue pour illustrer le rôle du microenvironnement tumoral dans la prise en charge diagnostique et thérapeutique.
Microenvironnement et diagnostic : comment voir
Le microenvironnement tumoral joue en fait un rôle dès les premières étapes du diagnostic de tumeur. C’est notamment le cas pour les organes superficiels (tels que le sein) où la tumeur peut être palpée par le clinicien. La sensation de dureté, qui permet d’identifier un syndrome de masse, est en effet due non pas aux cellules tumorales elles-mêmes, mais à la réaction stromale fibreuse collagénique qui les accompagne. En matière de cancer du sein, loin d’être anecdotique, il s’agit là d’un élément important dans la prise en charge puisque cette réaction stromale fibreuse révélatrice va guider successivement le clinicien, le radiologue, le chirurgien et le pathologiste. À l’opposé, certains types de réactions stromales tumorales, telles que l’intense infiltrat lymphocytaire sans fibrose des carcinomes médullaires ou l’abondant mucus sans fibrose des tumeurs mucineuses, peuvent être responsables d’un retard de diagnostic. La tumeur, de consistance plus molle et dont les limites sont arrondies, peut en effet en imposer pour une lésion bénigne qui n’est pas cliniquement suspecte. Enfin, d’autres types de tumeurs, tels que le cancer du sein de type lobulaire, produisent peu de réaction stromale, les cellules carcinomateuses invasives s’insinuant de manière isolée dans le parenchyme mammaire, ce qui explique la difficulté de l’identification de ce type de lésion. La description de l’aspect macroscopique d’une tumeur (consistance, dureté, limites, estimation de la taille), qui est étroitement lié au microenvironnement tumoral, est ainsi l’un des premiers temps diagnostiques pour le pathologiste.
Par la suite, lors de l’examen microscopique, l’analyse du microenvironnement tumoral est également largement prise en compte parmi les arguments permettant d’aboutir au diagnostic du type histologique de tumeur. Si l’on prend l’exemple des cancers du sein, il existe de nombreux types histologiques différents, associés pour certains à un pronostic évolutif distinct [6, 41]. La reconnaissance de ces différents types histologiques se fait non seulement sur l’aspect morphologique et l’architecture des cellules tumorales, mais aussi sur le type de réaction stromale qui les accompagne (Figure 1). Par exemple, les carcinomes tubuleux du sein, d’excellent pronostic (même meilleur que celui des carcinomes canalaires infiltrants sans autre spécification de bas grade), sont associés d’une part à une réaction stromale fibroblastique desmoplastique caractéristique, et, d’autre part, à une interaction étroite avec les adipocytes adjacents, éléments qui aident à l’établissement du diagnostic positif (Figure 1) [6, 42] (→).
(→) Voir la Synthèse de V. Laurent et al., page 398 de ce numéro
 |
Figure 1. Exemples de réaction stromale dans les cancers du sein. A. Carcinome infiltrant sans autre spécification, montrant une réaction stromale fibreuse au centre et lymphocytaire en périphérie (hémalun-éosine, grossissement Gx10). B. Même tumeur montrant un microenvironnement fibreux et fibroblastique (hémalun-éosine, Gx40). C et D. Périphérie d’un carcinome infiltrant de type tubuleux ( C , hémalun-éosine, Gx10), montrant un contact étroit caractéristique entre glandes tumorales et adipocytes ( D , hémalun-éosine, Gx40). E et F. Carcinome infiltrant sans autre spécification, de haut grade, montrant une réaction stromale lymphocytaire marquée, intratumorale (hémalun-éosine, E , Gx10 et F , Gx40). |
Les carcinomes de type médullaire ou avec faits médullaires, de pronostic intermédiaire, sont, eux, associés à un infiltrat inflammatoire lymphocytaire dense, étroitement mêlé aux cellules tumorales [6]. Les carcinomes micropapillaires infiltrants du sein, excessivement lymphophiles et de mauvais pronostic, sont dépourvus de la réaction stromale fibreuse classique, les cellules tumorales étant entourées de fentes de rétraction caractéristiques, liées à une polarité inversée des cellules tumorales1 [6]. Certains de ces types histologiques spéciaux de cancer du sein, tels que le carcinome infiltrant à cellules géantes ostéoclastiques, sont même exclusivement définis par la présence d’un type particulier de cellules (ici, cellules de nature macrophagique, non tumorales) dans le microenvironnement tumoral [6].
S’il est vrai que le pathologiste avait ainsi l’habitude de voir le microenvironnement tumoral et de l’intégrer de manière presque « invisible » - en tout cas automatique - dans sa démarche diagnostique, ce n’est que de façon beaucoup plus récente qu’il a été amené à le regarder directement en tant que paramètre pronostique, ou même prédictif de la réponse thérapeutique.
Microenvironnement et pronostic : comment regarder
La littérature récente fournit de multiples preuves du rôle pronostique du microenvironnement tumoral, notamment dans le cancer du sein. Dans les années 2000, de nombreuses signatures moléculaires pronostiques des cancers du sein ont été proposées, mais peu portaient spécifiquement sur le microenvironnement. Cependant, de multiples publications suggèrent le rôle pronostique individuel de différents composants du microenvironnement (CD44 [récepteur de l’acide hyaluronique], E-cadhérine, SPARC [secreted protein acidic and rich in cysteine ou ostéonectine], cathepsine), ce qui conduit finalement au développement de signatures multigéniques liées au stroma [7]. En 2008, Bergamaschi et al. ont développé une signature moléculaire pronostique basée sur l’expression de 278 gènes impliqués dans la biologie de la matrice extracellulaire (ECM pour extracellular matrix) [8]. Selon cette signature, les cancers du sein peuvent être classés en quatre groupes principaux. L’un de ces groupes, nommé ECM4, est de bon pronostic et caractérisé par la surexpression d’un groupe d’inhibiteurs de protéases de la famille des serpines [8]. À l’opposé, le groupe ECM1, de mauvais pronostic, est caractérisé par l’association d’une expression élevée d’intégrines et de métallopeptidases, et d’une expression faible de plusieurs chaînes de laminine. De façon intéressante, les tumeurs à réaction stromale fibreuse dense avec infiltrat lymphoïde auraient plutôt tendance à appartenir au groupe ECM1, tandis que les tumeurs à stroma lâche appartiendraient plutôt à la catégorie ECM4 [8]. En accord avec la taxonomie moléculaire des cancers du sein [9], on trouve plus de tumeurs de phénotype basal-like ou triple négatif (sans expression des récepteurs hormonaux ni de HER2 [human epidermal growth factor receptor 2]) dans le groupe ECM1, alors que le groupe ECM4 est enrichi en tumeurs de type luminal A (exprimant fortement le récepteur des œstrogènes [RE]) [8].
La même année, à partir d’échantillons tissulaires microdisséqués, Finak et al. décrivent une signature pronostique basée sur 26 gènes intervenant dans la biologie du stroma [10]. Cette signature stromale permet de classer les cancers du sein en catégories de bon ou de mauvais pronostic, indépendamment des facteurs pronostiques classiques tels que le grade histologique, la taille tumorale, le statut ganglionnaire ou l’expression des récepteurs hormonaux et de HER2 [10]. Le groupe de mauvais pronostic est caractérisé par une altération de l’expression de gènes impliqués dans l’angiogenèse, la réponse à l’hypoxie, l’activation des macrophages, ou la transition épithélio-mésenchymateuse. Le groupe de bon pronostic se caractérise, quant à lui, par la surexpression de marqueurs d’une réponse immunitaire lymphocytaire T de type Th1 (notamment le CD8). La valeur pronostique de cette signature stromale est particulièrement puissante pour les tumeurs HER2+ [10].
Parallèlement à ces signatures issues des analyses transcriptomiques à haut débit, de multiples études se sont focalisées sur le rôle pronostique des différents compartiments cellulaires du microenvironnement tumoral (adipocytes, fibroblastes et macrophages activés, lymphocytes, cellules endothéliales) [11–18]. Mais, c’est sans aucun doute la caractérisation de la réponse immunitaire qui occupe actuellement le devant de la scène [19, 43] (→).
(→) Voir la Synthèse de J. Galon et al., page 439 de ce numéro
L’alliance exemplaire entre pathologistes et immunologistes a en effet permis de considérables avancées dans la compréhension du rôle pronostique de la réponse immunitaire, basées notamment sur la technique d’immunohistochimie (IHC), technique de choix pour l’étude du microenvironnement tumoral. Le rôle central tenu par les lymphocytes infiltrant la tumeur (ou TIL pour tumor infiltrating lymphocytes) a été ainsi clairement démontré. Dans les cancers du sein, les TIL ont été caractérisés de façon extensive, en fonction de leur localisation (périphérique et/ou intratumorale) et de leur phénotype (B, CD20+; T CD3+, CD4+ ou CD8+ ; NK [natural killer]) [20], notamment selon les différents types histologiques (carcinome médullaire, micropapillaire) [21] ou moléculaires (basal-like, HER2, luminal B) [22–24]. Les TIL sont ainsi plus fréquemment observés dans les tumeurs RE-, de haut grade, de type médullaire, basal-like ou HER2+, ou chez les patientes présentant une mutation du gène de prédisposition BRCA1 [21, 23, 25–27]. Sur le plan phénotypique, les TIL associés aux cancers du sein sont majoritairement de phénotype T, les lymphocytes T cytotoxiques CD8+ activés (exprimant la perforine, le granzyme B, le ligand de Fas) attaquant principalement les cellules tumorales [21, 25–27]. De façon intéressante, l’impact pronostique des TIL (et, plus spécifiquement, la richesse en T cytotoxiques CD8+ [CD8high] et la pauvreté en lymphocytes T régulateurs FOXP3+ [FOXP3low]) varieraient selon le type de cancer du sein, notamment selon qu’il s’agisse d’une tumeur RE+ (rôle faible ou plutôt défavorable des TIL) ou RE- (rôle favorable des TIL) [23–26, 28]. Le rôle bénéfique de la réponse immunitaire dans les tumeurs RE- a été également démontré par des approches non morphologiques (transcriptomique sur broyats tumoraux) [29].
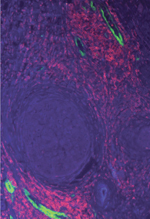
Parallèlement à la caractérisation des TIL, des études ont porté sur la vascularisation associée à la réponse immunitaire. Les HEV (high endothelial venules) sont des veinules post-capillaires spécifiquement localisées dans les zones T des organes lymphoïdes secondaires. Elles permettent le recrutement des lymphocytes naïfs et des lymphocytes T de mémoire centrale2 à partir du sang et jouent un rôle essentiel dans la mise en place de la réponse immunitaire adaptative [30, 31]. Les HEV sont caractérisées par un endothélium cuboïdal et l’expression abondante de molécules d’adhésion telles que les PNad (peripheral node adressins). Ces motifs de type acide sialyl-lewisx sont impliqués dans le roulement (rolling) et l’attachement des lymphocytes à l’endothélium vasculaire via le récepteur CD62L (ou sélectine L) [30, 31]. Des travaux récents ont pu détecter la présence de vaisseaux de type HEV en nombre variable dans le stroma de diverses tumeurs solides humaines (mélanomes, carcinomes mammaires, ovariens, coliques et pulmonaires) par IHC à l’aide de l’anticorps MECA79 qui reconnaît spécifiquement ces vaisseaux [32, 33] (Figure 2). Dans le cancer du sein, les vaisseaux HEV sont observés au sein de zones tumorales riches en lymphocytes (Figure 2D). Il existe une forte corrélation entre l’infiltration lymphocytaire T et B et la présence d’une forte densité de HEV dans la zone tumorale [32]. Les HEV pourraient donc jouer un rôle bénéfique dans les cancers en augmentant le recrutement de lymphocytes au sein de la tumeur.
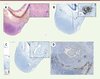 |
Figure 2. Étude des HEV (high endothelial venules) en pathologie tumorale - Apport des lames numériques. A. Mélanome malin du pavillon de l’oreille (hémalun-éosine, lame digitalisée). B. Immunomarquage anti-CD3, mettant en évidence un infiltrat lymphocytaire T (encart) en périphérie de la tumeur, qui peut être quantifié par analyse d’image à partir de la lame digitalisée. C. La lame d’immunomarquage MECA-79 montre la présence de vaisseaux de type HEV (encart) en périphérie de la tumeur. La lame est digitalisée et la zone tumorale cerclée afin d’obtenir une surface précise en mm². Les vaisseaux HEV sont ensuite comptés sur cette surface tumorale. D. Immunomarquage MECA-79 dans un carcinome in situ du sein, montrant la présence de vaisseaux HEV au sein de la réaction stromale lymphocytaire. |
Microenvironnement et traitement : comment espérer
Ce n’est que récemment que la littérature s’est intéressée au lien entre microenvironnement et réponse au traitement [44] (→).
(→) Voir la Synthèse de L. Borriello et Y.A. DeClerck, page 445 de ce numéro
Le modèle néoadjuvant (selon la séquence biopsie tumorale initiale, suivie d’une chimiothérapie, puis d’une exérèse chirurgicale de la tumeur) est particulièrement adapté pour étudier cette question. Dans le cancer du sein, le pourcentage de TIL est un facteur prédictif de réponse à la chimiothérapie néoadjuvante par anthracyclines/taxanes [22, 34]. Dans une métaanalyse transcriptomique de près de 1000 cas, Ignatiadis et al. ont montré qu’un score immunitaire élevé était prédictif de réponse à la chimiothérapie néoadjuvante [35]. Une signature stromale, basée sur l’expression de 50 gènes (c’est-à-dire sur un profil d’expression génique spécifique ou métagène, dont le gène représentatif est celui qui code pour la décorine) et corrélée à la présence d’une réaction stromale fibroblastique active dans les cancers du sein RE-, est prédictive de résistance à une chimiothérapie néoadjuvante à base d’anthracyclines [36].
Toutes ces données suggèrent que le microenvironnement tumoral pourrait également jouer un rôle dans la prise en charge thérapeutique [37]. Les traitements anti-angiogéniques, dont la plupart ciblent le VEGF, se sont largement développés ces dernières années, en association à la chimiothérapie, dans les tumeurs solides, avec une efficacité variable selon le type de tumeur (rein, côlon, poumon, ovaire, sein), [2, 37]. La voie du FGF (fibroblast growth factor), également impliquée dans l’angiogenèse, est ciblée par de petites molécules inhibitrices du récepteur du FGF (FGFR), et plusieurs essais cliniques sont en cours dans les tumeurs solides que caractérise une altération de cette voie [37]. Le développement d’anticorps monoclonaux, par exemple contre des protéines de la matrice extracellulaire (tenascine, fibronectine), est envisagé dans différentes localisations [2, 37]. Enfin, l’immunothérapie est également activement explorée, et offre une vaste palette de molécules et d’approches différentes. On peut citer par exemple les très anciens anti-inflammatoires non stéroïdiens (inhibiteurs de COX2 [cyclo-oxygénase 2], testés notamment dans les cancers du sein), les inhibiteurs du TNFα (tumor necrosis factor), de la voie NF-κB (inhibiteur de IKKβ), de cytokines diverses et variées, ou les vaccins MUC1 qui induisent des réponses immunitaires cellulaire et humorale spécifiques de MUC1 [2, 19, 37]. La compréhension des effets secondaires, des mécanismes d’action et de résistance, et l’identification de biomarqueurs prédictifs restent des points clés du développement de ces thérapies.
Perspectives pour le pathologiste
Le matériel de choix pour l’évaluation du microenvironnement tumoral reste la coupe entière de tumeur, la technique de tissu microarray n’étant pas adaptée pour analyser l’ensemble des interactions tumeur-hôte. Les techniques d’étude les plus utilisées, telles que la simple coloration standard ou l’IHC, sont pratiquées de façon courante en anatomopathologie et permettent un contrôle morphologique indispensable. En effet, certains marqueurs tels que FOXP3 sont de bon pronostic lorsqu’ils sont peu représentés au niveau du contingent lymphocytaire, mais exprimés au niveau des cellules tumorales [38]. Par ailleurs, le développement des outils d’analyse d’images devrait assurer la reproductibilité et la robustesse des techniques morphologiques [20]. En complément de l’interprétation histopathologique, les outils de biologie moléculaire, qu’ils soient ou non à haut débit (RT-PCR, transcriptomique, séquençage nouvelle génération) pourraient permettre de s’affranchir des biais de l’analyse semi-quantitative.
Le pathologiste tiendra sans nul doute un rôle primordial dans l’harmonisation et la standardisation des techniques utilisées (qu’elles soient morphologiques comme l’IHC ou moléculaires à haut débit) afin de développer des biomarqueurs rigoureux et validés, utilisables en pratique clinique. Les quantifications, localisation et caractérisation phénotypique de l’infiltrat lymphocytaire seront vraisemblablement amenées à tenir une place importante dans l’analyse des tumeurs solides, et nécessiteront l’expertise morphologique du pathologiste afin d’identifier précisément les TIL ayant un impact clinique. Enfin, il est important de rappeler que tous ces biomarqueurs potentiels, qu’ils soient pronostiques ou prédictifs, doivent passer les phases de validation selon les recommandations internationales telles que les critères EGAPP (evaluation of genomic applications in practice and prevention)3 [39], avant toute mise en place clinique.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Dans ce sous-type histologique, les cellules tumorales présentent en effet leur pôle apical (pôle sécrétoire) tourné vers l’extérieur des massifs tumoraux, le pôle basal se retrouvant, lui, au centre des micropapilles. L’absence de jonction cellulematrice extracellulaire au niveau du pôle apical entraîne alors une fente de rétraction, espace clair optiquement vide entre les massifs tumoraux micropapillaires et le stroma adjacent.
Ces cellules mémoire, CCR7+ (récepteur de chimiokines), expriment majoritairement le ligand CD62L et constituent une réserve pour la génération rapide de nouveaux lymphocytes T effecteurs en cas de réexposition à l’antigène. On les distingue des cellules T mémoire effectrices, qui, elles, n’expriment ni CCR7 ni CD62L.
Références
- Hanahan D, Coussens LM. Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell 2012 ; 21 : 309–322. [CrossRef] [PubMed] [Google Scholar]
- Allen M, Louise Jones J. Jekyll and Hyde: the role of the microenvironment on the progression of cancer. J Pathol 2011 ; 223 : 162–176. [PubMed] [Google Scholar]
- Boudreau A, van’t Veer LJ, Bissell MJ. An elite hacker: breast tumors exploit the normal microenvironment program to instruct their progression and biological diversity. Cell Adh Migr 2012 ; 6 : 236–248. [CrossRef] [PubMed] [Google Scholar]
- Goetz JG. Tumor microenvironment indoctrination: an emerging hallmark of cancer. Cell Adh Migr 2012 ; 6 : 190–192. [CrossRef] [PubMed] [Google Scholar]
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011 ; 144 : 646–674. [CrossRef] [PubMed] [Google Scholar]
- Lakhani SR, Ellis IO, Schnitt SJ, Tan PH, van de Vijver MJ. WHO classification of tumours of the breast, 4th ed. Lyon : IARC, 2012. [Google Scholar]
- Chang HY, Sneddon JB, Alizadeh AA, et al. Gene expression signature of fibroblast serum response predicts human cancer progression: similarities between tumors, wounds. PLoS Biol 2004 ; 2 : E7. [CrossRef] [PubMed] [Google Scholar]
- Bergamaschi A, Tagliabue E, Sorlie T, et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol 2008 ; 214 : 357–367. [CrossRef] [PubMed] [Google Scholar]
- Perou CM, Sorlie T, Eisen MB, et al. Molecular portraits of human breast tumours. Nature 2000 ; 406 : 747–752. [CrossRef] [PubMed] [Google Scholar]
- Finak G, Bertos N, Pepin F, et al. Stromal gene expression predicts clinical outcome in breast cancer. Nat Med 2008 ; 14 : 518–527. [CrossRef] [PubMed] [Google Scholar]
- Tang X. Tumor-associated macrophages as potential diagnostic and prognostic biomarkers in breast cancer. Cancer Lett 2013 ; 332 : 3–10. [CrossRef] [PubMed] [Google Scholar]
- Campbell MJ, Tonlaar NY, Garwood ER, et al. Proliferating macrophages associated with high grade, hormone receptor negative breast cancer and poor clinical outcome. Breast Cancer Res Treat 2011 ; 128 : 703–711. [CrossRef] [PubMed] [Google Scholar]
- Van den Eynden GG, Colpaert CG, Couvelard A, et al. A fibrotic focus is a prognostic factor and a surrogate marker for hypoxia and (lymph)angiogenesis in breast cancer: review of the literature and proposal on the criteria of evaluation. Histopathology 2007 ; 51 : 440–451. [CrossRef] [PubMed] [Google Scholar]
- Servais C, Erez N. From sentinel cells to inflammatory culprits: cancer-associated fibroblasts in tumour-related inflammation. J Pathol 2013 ; 229 : 198–207. [CrossRef] [PubMed] [Google Scholar]
- Sharma S, Sharma MC, Sarkar C. Morphology of angiogenesis in human cancer: a conceptual overview, histoprognostic perspective and significance of neoangiogenesis. Histopathology 2005 ; 46 : 481–489. [CrossRef] [PubMed] [Google Scholar]
- Hansen S, Grabau DA, Sorensen FB, et al. The prognostic value of angiogenesis by Chalkley counting in a confirmatory study design on 836 breast cancer patients. Clin Cancer Res 2000 ; 6 : 139–146. [PubMed] [Google Scholar]
- Rau KM, Huang CC, Chiu TJ, et al. Neovascularization evaluated by CD105 correlates well with prognostic factors in breast cancers. Exp Ther Med 2012 ; 4 : 231–236. [PubMed] [Google Scholar]
- Wang YY, Lehuede C, Laurent V, et al. Adipose tissue and breast epithelial cells: a dangerous dynamic duo in breast cancer. Cancer Lett 2012 ; 324 : 142–151. [CrossRef] [PubMed] [Google Scholar]
- Finn OJ. Host response in tumor diagnosis and prognosis: importance of immunologists and pathologists alliance. Exp Mol Pathol 2012 ; 93 : 315–318. [CrossRef] [PubMed] [Google Scholar]
- Kruger JM, Wemmert C, Sternberger L, et al. Combat or surveillance? Evaluation of the heterogeneous inflammatory breast cancer microenvironment. J Pathol 2013 ; 229 : 569–578. [CrossRef] [PubMed] [Google Scholar]
- Guo X, Fan Y, Lang R, et al. Tumor infiltrating lymphocytes differ in invasive micropapillary carcinoma and medullary carcinoma of breast. Mod Pathol 2008 ; 21 : 1101–1107. [CrossRef] [PubMed] [Google Scholar]
- Denkert C, Loibl S, Noske A, et al. Tumor-associated lymphocytes as an independent predictor of response to neoadjuvant chemotherapy in breast cancer. J Clin Oncol 2010 ; 28 : 105–113. [CrossRef] [PubMed] [Google Scholar]
- Loi S, Sirtaine N, Piette F, et al. Prognostic and predictive value of tumor-infiltrating lymphocytes in a phase III randomized adjuvant breast cancer trial in node-positive breast cancer comparing the addition of docetaxel to doxorubicin with doxorubicin-based chemotherapy: BIG 02–98. J Clin Oncol 2013 ; 31 : 860–867. [CrossRef] [PubMed] [Google Scholar]
- Mahmoud SM, Paish EC, Powe DG, et al. Tumor-infiltrating CD8+ lymphocytes predict clinical outcome in breast cancer. J Clin Oncol 2011 ; 29 : 1949–1955. [CrossRef] [PubMed] [Google Scholar]
- Baker K, Lachapelle J, Zlobec I, et al. Prognostic significance of CD8+ T lymphocytes in breast cancer depends upon both oestrogen receptor status and histological grade. Histopathology 2011 ; 58 : 1107–1116. [PubMed] [Google Scholar]
- Bates GJ, Fox SB, Han C, et al. Quantification of regulatory T cells enables the identification of high-risk breast cancer patients and those at risk of late relapse. J Clin Oncol 2006 ; 24 : 5373–5380. [CrossRef] [PubMed] [Google Scholar]
- Leong PP, Mohammad R, Ibrahim N, et al. Phenotyping of lymphocytes expressing regulatory and effector markers in infiltrating ductal carcinoma of the breast. Immunol Lett 2006 ; 102 : 229–236. [CrossRef] [PubMed] [Google Scholar]
- Ladoire S, Mignot G, Dabakuyo S, et al. In situ immune response after neoadjuvant chemotherapy for breast cancer predicts survival. J Pathol 2011 ; 224 : 389–400. [CrossRef] [PubMed] [Google Scholar]
- Teschendorff AE, Miremadi A, Pinder SE, et al. An immune response gene expression module identifies a good prognosis subtype in estrogen receptor negative breast cancer. Genome Biol 2007 ; 8 : R157. [CrossRef] [PubMed] [Google Scholar]
- Girard JP, Springer TA. High endothelial venules (HEVs): specialized endothelium for lymphocyte migration. Immunol Today 1995 ; 16 : 449–457. [CrossRef] [PubMed] [Google Scholar]
- Miyasaka M, Tanaka T. Lymphocyte trafficking across high endothelial venules: dogmas and enigmas. Nat Rev Immunol 2004 ; 4 : 360–370. [CrossRef] [PubMed] [Google Scholar]
- Martinet L, Garrido I, Filleron T, et al. Human solid tumors contain high endothelial venules: association with T- and B-lymphocyte infiltration and favorable prognosis in breast cancer. Cancer Res 2011 ; 71 : 5678–5687. [CrossRef] [PubMed] [Google Scholar]
- Michie SA, Streeter PR, Bolt PA, et al. The human peripheral lymph node vascular addressin. An inducible endothelial antigen involved in lymphocyte homing. Am J Pathol 1993 ; 143 : 1688–1698. [PubMed] [Google Scholar]
- Issa-Nummer Y, Darb-Esfahani S, Loibl S, et al. Prospective validation of immunological infiltrate for prediction of response to neoadjuvant chemotherapy in HER2-negative breast cancer: a substudy of the neoadjuvant GeparQuinto trial. PLoS One 2013 ; 8 : e79775. [CrossRef] [PubMed] [Google Scholar]
- Ignatiadis M, Singhal SK, Desmedt C, et al. Gene modules and response to neoadjuvant chemotherapy in breast cancer subtypes: a pooled analysis. J Clin Oncol 2012 ; 30 : 1996–2004. [CrossRef] [PubMed] [Google Scholar]
- Farmer P, Bonnefoi H, Anderle P, et al. A stroma-related gene signature predicts resistance to neoadjuvant chemotherapy in breast cancer. Nat Med 2009 ; 15 : 68–74. [CrossRef] [PubMed] [Google Scholar]
- Fang H, Declerck YA. Targeting the tumor microenvironment: from understanding pathways to effective clinical trials. Cancer Res 2013 ; 73 : 4965–4977. [CrossRef] [PubMed] [Google Scholar]
- Ladoire S, Mignot G, Dalban C, et al. FOXP3 expression in cancer cells and anthracyclines efficacy in patients with primary breast cancer treated with adjuvant chemotherapy in the phase III UNICANCER-PACS 01 trial. Ann Oncol 2012 ; 23 : 2552–2561. [CrossRef] [PubMed] [Google Scholar]
- Teutsch SM, Bradley LA, Palomaki GE, et al. The evaluation of genomic applications in practice and prevention (EGAPP) initiative: methods of the EGAPP working group. Genet Med 2009 ; 11 : 3–14. [CrossRef] [PubMed] [Google Scholar]
- Fridman WH, Sautès-Fridman C. Le microenvironnement tumoral : matrice nourricière, champ de bataille et cible thérapeutique des cancers. Med Sci (Paris) 2014 ; 30 : 359–365. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Bertucci F, Pascal Finetti P, Cervera N, Birnbaum D. Classification pronostique du cancer du sein et profils d’expression génique sur puces à ADN. Med Sci (Paris) 2008 ; 24 : 599–606. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Laurent V, Nieto L, Valet P, Muller C. Tissu adipeux et cancer : une association à haut risque. Med Sci (Paris) 2014 ; 30 : 398–404. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Galon J, Bindea G, Mlecnik B, et al. Microenvironnement immunitaire et cancer : intérêt de l’Immunoscore pour prédire l’évolution clinique. Med Sci (Paris) 2014 ; 30 : 439–444. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Borriello L, DeClerck YA. Le microenvironnement tumoral et la résistance thérapeutique. Med Sci (Paris) 2014 ; 30 : 445–451. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Exemples de réaction stromale dans les cancers du sein. A. Carcinome infiltrant sans autre spécification, montrant une réaction stromale fibreuse au centre et lymphocytaire en périphérie (hémalun-éosine, grossissement Gx10). B. Même tumeur montrant un microenvironnement fibreux et fibroblastique (hémalun-éosine, Gx40). C et D. Périphérie d’un carcinome infiltrant de type tubuleux ( C , hémalun-éosine, Gx10), montrant un contact étroit caractéristique entre glandes tumorales et adipocytes ( D , hémalun-éosine, Gx40). E et F. Carcinome infiltrant sans autre spécification, de haut grade, montrant une réaction stromale lymphocytaire marquée, intratumorale (hémalun-éosine, E , Gx10 et F , Gx40). |
| Dans le texte | |
 |
Figure 2. Étude des HEV (high endothelial venules) en pathologie tumorale - Apport des lames numériques. A. Mélanome malin du pavillon de l’oreille (hémalun-éosine, lame digitalisée). B. Immunomarquage anti-CD3, mettant en évidence un infiltrat lymphocytaire T (encart) en périphérie de la tumeur, qui peut être quantifié par analyse d’image à partir de la lame digitalisée. C. La lame d’immunomarquage MECA-79 montre la présence de vaisseaux de type HEV (encart) en périphérie de la tumeur. La lame est digitalisée et la zone tumorale cerclée afin d’obtenir une surface précise en mm². Les vaisseaux HEV sont ensuite comptés sur cette surface tumorale. D. Immunomarquage MECA-79 dans un carcinome in situ du sein, montrant la présence de vaisseaux HEV au sein de la réaction stromale lymphocytaire. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




