| Issue |
Med Sci (Paris)
Volume 29, Number 6-7, Juin–Juillet 2013
|
|
|---|---|---|
| Page(s) | 572 - 574 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2013296006 | |
| Published online | 12 July 2013 | |
Le TGFβ, un trouble-fête dans la niche des cellules souches neurales adultes
TGFβ, a troublemaker in the adult neural stem cell niche
Direction des sciences du vivant du CEA, institut de radiobiologie cellulaire et moléculaire, service cellules souches et radiation, Inserm UMR967, université Paris-Diderot, université Paris-Sud, laboratoire de radiopathologie, 18, route du Panorama, BP n° 6, F-92265 Fontenay-aux-Roses Cedex, France
Altérations des fonctions cognitives par la radiothérapie
Une dégradation progressive des fonctions cognitives est fréquemment observée à long terme après une radiothérapie crânienne, un traitement largement utilisé pour lutter contre les tumeurs cérébrales primaires et les métastases cérébrales. Il s’agit notamment de déficits fonctionnels de la mémoire, de l’attention et des fonctions exécutives qui altèrent gravement la qualité de la vie des patients [1]. Ces effets indésirables de la radiothérapie seraient associés, au moins en partie, à une diminution de la production de nouveaux neurones, processus appelé neurogenèse [1]. La neurogenèse persiste au cours de la vie adulte chez les mammifères dans deux régions précises du cerveau : la zone sous-granulaire du gyrus dentelé de l’hippocampe et la zone sous-ventriculaire (ZSV) [2]. Les fonctions de ces neurones produits à l’âge adulte commencent peu à peu à être élucidées, notamment chez les rongeurs. On sait désormais qu’ils sont nécessaires au maintien des facultés cognitives [2, 3]. Ainsi, une irradiation à forte dose bloquant de façon persistante la production de nouveaux neurones entraîne une perturbation des fonctions associées à l’hippocampe (apprentissage, mémoire spatiale), de la restitution de la mémoire des odeurs et des comportements sociaux chez la souris [3–5].
L’irradiation altère la niche des cellules souches neurales
La neurogenèse adulte est assurée par des cellules souches neurales situées dans un microenvironnement spécialisé, appelé niche, comportant notamment des microvaisseaux (Figure 1) [6]. Ces niches jouent un rôle majeur dans le maintien à long terme du stock de cellules souches neurales et dans la régulation de leur prolifération et de leur différenciation en neurones. Ainsi, les cellules endothéliales des microvaisseaux sécrètent des facteurs, comme le pigment epithelium-derived factor (PEDF), capables de moduler l’autorenouvellement des cellules souches neurales [7, 8].
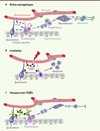 |
Figure 1. Le TGFb bloque la neurogenèse dans la niche des cellules souches. Les cellules souches neurales de la zone sous-ventriculaire (ZSV) prolifèrent et se différencient donnant naissance successivement à des progéniteurs et des neuroblastes qui migrent dans le bulbe olfactif et, finalement, évoluent en neurones. A. Les cellules souches de la ZSV sont au contact du ventricule latéral ainsi que des microvaisseaux dans des zones dépourvues de péricyte. Les microvaisseaux jouent un rôle majeur dans la neurogenèse car les cellules endothéliales synthétisent des facteurs, comme le PEDF, qui stimulent l’autorenouvellement des cellules souches et servent également « d’échafaudage » pour la migration des neuroblastes [7]. B. Une élévation du TGFβ1 associé aux microvaisseaux est observée après une irradiation ou au cours du vieillissement. Cette augmentation de TGFβ1 altère la neurogenèse en provoquant la quiescence et l’apoptose des cellules souches et des progéniteurs. C. Le blocage pharmacologique du TGFβ1 permet de restaurer la neurogenèse chez des souris irradiées ou âgées [9]. |
L’irradiation entraîne la mort par apoptose des cellules souches et des progéniteurs neuraux en phase proliférative qui sont particulièrement radiosensibles. Nous avons montré que les cellules souches quiescentes sont bien plus résistantes et persistent dans la ZSV plusieurs mois après une irradiation, même à forte dose, mais cependant sans pouvoir continuer à assurer la neurogenèse chez les souris irradiées [9]. Différentes altérations de la niche des cellules souches neurales ont été proposées pour expliquer les perturbations de la neurogenèse induites par l’irradiation, notamment la persistance d’une réponse inflammatoire dans l’hippocampe, liée au recrutement de cellules microgliales, qui est observée après une irradiation de 10 Gy délivrée en une dose unique [10]. L’implication d’une réponse inflammatoire dans la diminution de la neurogenèse pourrait dépendre cependant du protocole d’irradiation et/ou de la niche neurogénique étudiée. En effet, nous avons montré qu’une irradiation crânienne de 15 Gy délivrée en trois fractions de 5 Gy durant une semaine chez la souris entraîne aussi une diminution chronique de la neurogenèse, et résulte de modifications de la niche des cellules souches, mais n’implique pas un recrutement de cellules microgliales dans la ZSV [9]. De plus, des expériences de transplantation nous ont permis d’observer que des cellules souches neurales provenant d’animaux non irradiés cessent de proliférer et de se différencier en neurones chez des souris irradiées. L’ensemble de ces données révèle que l’atteinte radio-induite de la neurogenèse résulte essentiellement d’une altération de la niche des cellules souches neurales plutôt que d’une atteinte directe de ces dernières par l’irradiation.
Le blocage du TGFb1 permet de rétablir la neurogenèse dans le cerveau irradié
Le TGFβ1 (transforming growth factor β1) a des rôles multiples dans le système nerveux central au cours du développement et chez l’adulte. Son expression augmente dans le cerveau en réponse à une variété de stress. Une augmentation chronique de l’expression du TGFβ1 par les cellules endothéliales est observée dans les microvaisseaux de la ZSV chez la souris après une irradiation à forte dose [9]. Outre son rôle neuroprotecteur et dans la plasticité et la transmission synaptiques, le TGFβ1 est connu pour inhiber la neurogenèse dans l’hippocampe et la ZSV [11]. Nous avons donc bloqué la signalisation du TGFβ chez les animaux irradiés par l’administration systémique d’un anticorps neutralisant ou l’administration intranasale d’un inhibiteur sélectif du récepteur I du TGFβ. Nous avons pu ainsi montrer que ces traitements restauraient la prolifération des cellules souches dans la ZSV et la production de nouveaux neurones dans le bulbe olfactif [9]. Au plan mécanistique, nous avons prouvé que l’activation de la voie TGFβ/Smad3 (mothers against decapentaplegic homolog 3) maintenait la quiescence des cellules souches neurales et augmentait la susceptibilité à l’apoptose radio-induite des cellules souches et des progéniteurs en prolifération [9].
Le TGFb, un perturbateur de la niche au cours du vieillissement
Nous avons retrouvé une augmentation de la signalisation TGFβ/Smad3 dans les niches de cellules souches neurales de la ZSV de souris âgées dont la neurogenèse est significativement diminuée [9]. Nous avons donc testé l’effet de son blocage chez des animaux âgés et observé une augmentation très significative de la prolifération des cellules souches et de la neurogenèse chez les souris traitées [9]. Ainsi, l’élévation du TGFβ est également responsable d’une diminution de la neurogenèse au cours du vieillissement et pourrait être impliquée dans la dégradation des fonctions cognitives observée chez les individus âgés.
Conclusion
Outre leur fonction dans l’homéostasie du cerveau, les cellules souches neurales adultes représentent un énorme potentiel thérapeutique pour les traumatismes cérébraux ou les maladies neurodégénératives [2]. De futures recherches devraient donc déterminer si ces résultats peuvent être étendus à la neurogenèse hippocampique et si la restauration de la neurogenèse induite par l’inhibition du TGFβ permet aussi le rétablissement des facultés cognitives des animaux irradiés ou âgés. Néanmoins, ces résultats encouragent la recherche de stratégies thérapeutiques visant à bloquer la voie du TGFβ afin de stimuler les cellules souches endogènes et limiter le déclin cognitif causé par la radiothérapie ou survenant au cours du vieillissement.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Ce travail a reçu le soutien de l’ANR-SEST (Neurorad), du Dim STEM-Pôle, de l’Inca (Tetratips) et d’Électricité de France (EDF).
Références
- Greene-Schloesser D, Moore E, Robbins ME. Molecular pathways: Radiation-induced cognitive impairment. Clin Cancer Res 2013 ; 19 : 2294–2300. [CrossRef] [PubMed] [Google Scholar]
- de Chevigny A, Lledo PM. La neurogenèse bulbaire et son impact neurologique. Med Sci (Paris) 2006 ; 22 : 607–613. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Kheirbek MA, Klemenhagen KC, Sahay A, Hen R. Neurogenesis and generalization: a new approach to stratify and treat anxiety disorders. Nat Neurosci 2012 ; 15 : 1613–1620. [CrossRef] [PubMed] [Google Scholar]
- Lazarini F, Mouthon MA, Gheusi G, et al. Cellular, behavioral effects of cranial irradiation of the subventricular zone in adult mice. PLoS One 2009 ; 4 : e7017. [CrossRef] [PubMed] [Google Scholar]
- Feierstein CE, Lazarini F, Wagner S, et al. Disruption of adult neurogenesis in the olfactory bulb affects social interaction but not maternal behavior. Front Behav Neurosci 2010 ; 4 : 176. [CrossRef] [PubMed] [Google Scholar]
- Spassky N, Caille I. La niche neurogénique adulte entre dans la troisième dimension. Med Sci (Paris) 2009 ; 25 : 17–18. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Goldman SA, Chen Z. Perivascular instruction of cell genesis and fate in the adult brain. Nat Neurosci 2011 ; 14 : 1382–1389. [CrossRef] [PubMed] [Google Scholar]
- Andreu-Agullo C, Morante-Redolat JM, Delgado AC, Farinas I. Vascular niche factor PEDF modulates Notch-dependent stemness in the adult subependymal zone. Nat Neurosci 2009 ; 12 : 1514–1523. [CrossRef] [PubMed] [Google Scholar]
- Pineda JR, Daynac M, Chicheportiche A, et al. Vascular-derived TGF-β increases in stem cell niche and perturbs neurogenesis during aging and irradiation in the adult mouse brain. EMBO Mol Med 2013 ; DOI 10.1002/emmm.201202197. [Google Scholar]
- Monje ML, Mizumatsu S, Fike JR, Palmer TD. Irradiation induces neural precursor-cell dysfunction. Nat Med 2002 ; 8 : 955–962. [CrossRef] [PubMed] [Google Scholar]
- Krieglstein K, Zheng F, Unsicker K, Alzheimer C. More than being protective: functional roles for TGF-beta/activin signaling pathways at central synapses. Trends Neurosci 2011 ; 34 : 421–429. [CrossRef] [PubMed] [Google Scholar]
© 2013 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Le TGFb bloque la neurogenèse dans la niche des cellules souches. Les cellules souches neurales de la zone sous-ventriculaire (ZSV) prolifèrent et se différencient donnant naissance successivement à des progéniteurs et des neuroblastes qui migrent dans le bulbe olfactif et, finalement, évoluent en neurones. A. Les cellules souches de la ZSV sont au contact du ventricule latéral ainsi que des microvaisseaux dans des zones dépourvues de péricyte. Les microvaisseaux jouent un rôle majeur dans la neurogenèse car les cellules endothéliales synthétisent des facteurs, comme le PEDF, qui stimulent l’autorenouvellement des cellules souches et servent également « d’échafaudage » pour la migration des neuroblastes [7]. B. Une élévation du TGFβ1 associé aux microvaisseaux est observée après une irradiation ou au cours du vieillissement. Cette augmentation de TGFβ1 altère la neurogenèse en provoquant la quiescence et l’apoptose des cellules souches et des progéniteurs. C. Le blocage pharmacologique du TGFβ1 permet de restaurer la neurogenèse chez des souris irradiées ou âgées [9]. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




