| Issue |
Med Sci (Paris)
Volume 28, Number 6-7, Juin–Juillet 2012
|
|
|---|---|---|
| Page(s) | 633 - 638 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2012286017 | |
| Published online | 16 July 2012 | |
Rhumatisme articulaire aigu
Perspectives
Rheumatic heart disease: future prospects
1
Paris-centre de recherche cardiovasculaire (PARCC), Inserm U970, Paris, France
2
Université Paris-Descartes, Sorbonne Paris Cité, UMR-S970, Paris, France
3
Institut du cœur (ICOR), Maputo, Mozambique
4
Département de cardiologie pédiatrique, hôpital Necker-Enfants malades, Paris, France
5
Département de cardiologie, hôpital européen Georges Pompidou, 56, rue Leblanc 75737 Paris Cedex 15, France
Le rhumatisme articulaire aigu représente un modèle d’auto-immunité acquise liée à la présence d’anticorps dirigés contre l’endocarde valvulaire cardiaque et qui se développent au décours d’une infection pharyngée à streptocoque. Les lésions peuvent évoluer à bas bruit vers des séquelles valvulaires (cardiopathie rhumatismale), parfois sévères et compliquées d’insuffisance cardiaque. Cette pathologie a été éradiquée des pays industrialisés grâce à l’amélioration du niveau de vie et aux programmes de prévention primaire (traitement des angines) et secondaire (antibiothérapie au long cours). Mais elle demeure un problème de santé publique majeur dans les pays en voie de développement. L’utilisation de l’échographie cardiaque a récemment montré son utilité pour détecter les formes mineures de la maladie permettant de traiter précocement les enfants affectés.
Abstract
Acute rheumatic fever develops after an inadequate immune response to throat streptococcal infection that induces the production of antibodies reacting against cardiac endothelial cells. Valve damage may lead to irreversible cardiac valve sequela (rheumatic heart disease) with further evolution towards severe valve dysfunction and heart failure. The disease has been almost eradicated in Western countries with the development of living conditions and prevention policies, including primary prevention (treatment of sore throats) and secondary prevention (long term administration of antibiotics). However, rheumatic heart disease remains a major health problem in developing countries. Recently, echocardiography identified children with mild features of the disease, thereby allowing early treatment.
© 2012 médecine/sciences – Inserm / SRMS
Le rhumatisme articulaire aigu (RAA) demeure un problème majeur de santé publique du fait des séquelles cardiaques fréquentes - cardiopathie rhumatismale (CR) - qui en résultent. La CR est la première cause d’insuffisance cardiaque chez les enfants et les jeunes adultes dans les pays émergents et parmi les populations aborigènes de certains pays développés [1]. L’intérêt scientifique pour le RAA semble avoir diminué dans les pays industrialisés au cours de ces dernières décennies, probablement en raison de la quasi-éradication de la maladie dans ces pays.
Le RAA est un syndrome auto-immun postinfectieux. L’infection est classiquement une angine à streptocoque qui induit chez l’hôte une réaction immunitaire inappropriée. Le RAA peut affecter différents organes et sa présentation clinique est variable. La CR, séquelle de l’atteinte cardiaque inflammatoire (cardite) du RAA, se manifeste par des fuites et/ou des sténoses des valves cardiaques. Le diagnostic est souvent fait lorsque la valvulopathie est déjà évoluée, nécessitant une intervention chirurgicale, le plus souvent inaccessible dans la plupart des pays en voie de développement, alors même que des moyens de prévention existent.
Outre l’amélioration des conditions de vie, l’antibiothérapie prophylactique par la pénicilline (correspondant au traitement de l’angine à streptocoque) permet de réduire l’incidence du RAA et la prévalence de la CR. La prophylaxie secondaire vise à éradiquer le portage chronique de la bactérie après un épisode de RAA afin de limiter la progression vers la CR au cours de réactivations immunologiques répétées. Les politiques de santé publique reposant sur l’éducation de la population et la mise en place de mesures de prévention primaire et secondaire ont eu un impact significatif aussi bien dans les pays émergents que dans les départements et territoires d’outre-mer français [2].
Le dépistage précoce de la maladie est une stratégie attractive car elle permet de traiter les enfants avant l’aggravation des lésions valvulaires caractérisées par l’apparition d’un souffle cardiaque. Dans ce contexte, l’échocardiographie (ultrasons) apparaît comme un outil de dépistage précoce performant de ces lésions valvulaires rhumatismales [3]. Le diagnostic des formes silencieuses (dites infracliniques, sans souffle cardiaque) par l’échographie représente une avancée majeure dans le domaine, alors que les moyens thérapeutiques demeurent inchangés depuis plus d’un demi-siècle.
Physiopathologie du rhumatisme articulaire aigu
Le RAA est la conséquence d’une réaction auto-immune qui survient après une infection pharyngée à Streptococcus pyogenes. Le mimétisme antigénique entre certaines protéines de surface de la bactérie - épitopes spécifiques - et les cellules de l’hôte est à l’origine d’une réaction immunologique croisée survenant sur un terrain génétiquement prédisposé. La pathogénie de la réaction immunologique du RAA est complexe et implique les mécanismes de l’immunité humorale et de l’immunité cellulaire (Figure 1) [4].
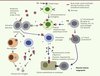 |
Figure 1. Mimétisme moléculaire à l’origine d’une réaction auto-immune contre les cellules valvulaires lors du RAA (premier accès et/ou rechutes). Le mimétisme moléculaire résulte de la similitude existant entre certains antigènes (Ag) du streptocoque (strept.) (protéine M par exemple) et des antigènes tissulaires exprimés par les cellules endothéliales ou les cellules cardiaques (myosine par exemple). Ce mimétisme peut déclencher une réaction immune inappropriée (flèches bleues) soit via l’activation des lymphocytes (Ly) T directement par certains Ag bactériens (1), soit via l’activation de lymphocytes autoréactifs ayant échappé à la sélection thymique (2). Ces Ly migrent vers le tissu cardiaque où ils reconnaissent des antigènes tissulaires partageant des séquences communes avec les Ag bactériens (c’est le cas de la myosine), et induisent une réponse immune inappropriée (4). Ces Ly peuvent aussi pérenniser une réponse humorale croisée (autoanticorps en 3) contre ces antigènes. La réponse auto-immune est amplifiée par la stimulation de la réponse innée par le MBL et par des cytokines sécrétées par les macrophages et les lymphocytes. La réponse immune normale à l’infection est indiquée en pointillés gris (5). |
Certaines souches de Streptococcus pyogenes possèdent les protéines de surface M, T et R impliquées dans l’adhérence de la bactérie aux cellules épithéliales pharyngées. La proximité antigénique des épitopes des protéines M et de plusieurs protéines des cellules cardiaques (myosine, tropomyosine, kératine, laminine, vimentine) permettent ces réactions croisées par l’intermédiaire des cellules présentatrices de l’antigène T [5]. En plus des mécanismes immuns humoral et cellulaire, la protéine mannose (ou mannan) binding lectin (MBL) semble également impliquée [6]. Il s’agit d’une protéine soluble de l’inflammation, aspécifique, capable d’adhérer aux pathogènes, d’induire la phagocytose et d’activer la voie du complément.
Il est vraisemblable qu’une susceptibilité génétique favorise le développement de la maladie [7]. Certaines molécules du système d’histocompatibilité (HLA) responsables de la présentation de l’antigène aux lymphocytes T semblent associées au RAA [8]. Cependant, aucun haplotype spécifique n’a été clairement identifié et les connaissances dans le domaine demeurent encore fragmentaires.
Présentation clinique du rhumatisme articulaire aigu
Le RAA est la traduction clinique de la réaction auto-immune antistreptococcique. La présentation clinique est variable : elle peut se manifester par la combinaison d’une atteinte cardiaque (dite cardite, associant à des degrés divers fuite valvulaire, troubles de la conduction, atteinte péricardique), articulaire (arthrite, arthralgies), cutanée (érythème marginé, nodules sous-cutanés) et neurologique (chorée de Sydenham). S’y associent des signes inflammatoires généraux (fièvre) [9]. Seule la cardite, présente dans 60 % des cas de RAA, peut se compliquer de séquelles valvulaires, définissant ainsi la CR. L’atteinte valvulaire à la phase aiguë est le plus souvent minime à modérée, et les dégâts valvulaires importants sont le plus souvent la conséquence de réactivations auto-immunes répétées.
Épidémiologie
Incidence du rhumatisme articulaire aigu et prévalence de la cardiopathie rhumatismale
Le RAA est avant tout lié aux conditions de vie : alors qu’il est quasiment éradiqué des pays industrialisés depuis plus d’une trentaine d’années, son incidence atteint jusqu’à 250 pour 100 000 habitants chez les populations aborigènes d’Australie. La CR touche encore entre 15 et 20 millions de personnes dans le monde, pour la plupart des enfants et des adultes jeunes vivant dans des pays en voie de développement [10] (Figure 2). Ces chiffres seraient largement sous-estimés selon les études récentes de dépistage utilisant l’échographie (environ 2/3 des enfants auraient des lésions silencieuses, non décelables par l’approche clinique conventionnelle et donc méconnues jusqu’à présent). La prévalence de la CR augmente avec l’âge du fait des expositions cumulées à l’infection au cours de l’enfance et de l’adolescence, avec une prédominance féminine dont les raisons demeurent encore inconnues. Les chiffres les plus élevés concernent l’Afrique sub-saharienne et les populations indigènes d’Australie (la prévalence atteint 50 pour 1 000).
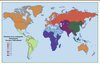 |
Figure 2. Prévalence de la cardiopathie rhumatismale chez les enfants âgés de 5 à 14 ans dans le monde. Les pays marqués d'un cercle gris – Australie et Nouvelle Zélande – ont une prévalence élevée parmi les populations aborigènes (repris de [10], © Lancet Infectious Diseases, avec l’accord du Journal). |
Morbidité et mortalité attribuables
Les valves cardiaques devenues anormales peuvent entraîner des complications de types arythmies, accidents thrombo-emboliques ou endocardite infectieuse, qui peuvent finalement évoluer vers l'insuffisance cardiaque terminale. La CR serait responsable de 200 à 250 000 décès par an [10]. Ces données sont probablement largement sous-estimées en raison de moyens de dépistage et d’outils thérapeutiques limités dans les zones où la CR est endémique. De plus, la maladie dégrade significativement la qualité de vie des sujets atteints, avec un handicap important chez les jeunes adultes en âge de travailler.
Traitement, stratégies de prévention et moyens de dépistage classiques
L’antibiothérapie (essentiellement à base de pénicilline G) est la pierre angulaire du traitement de l’accès aigu de RAA comme de la prévention. Bien qu’aucune thérapeutique anti-inflammatoire n’ait fait la preuve de son efficacité, des anti-inflammatoires stéroïdiens ou non stéroïdiens sont classiquement administrés à la phase aiguë d’un épisode de RAA.
À ce jour, seules les stratégies de prévention ont fait la preuve de leur efficacité. Le déclin du RAA dans les pays industrialisés a été amorcé avant le développement des antibiotiques. En effet, le développement économique survenu lors de la première moitié du xxe siècle a permis une amélioration des conditions de vie et d’hygiène. Cette prévention, dite primordiale, doit être associée aux programmes de prévention primaire et secondaire (Figure 3).
 |
Figure 3. Physiopathologie de la cardiopathie rhumatismale, moyens thérapeutiques actuels et voies de recherche. |
Prévention primaire
Le traitement des pharyngites streptococciques diminuerait l’incidence du RAA. Le traitement recommandé par l’OMS (Organisation mondiale de la santé) est basé sur la pénicilline orale ou intramusculaire [11]. Certaines équipes attribuent un rôle majeur à la prophylaxie primaire pour contrôler la CR. Les preuves de l’efficacité et l’intérêt du rapport coût/bénéfice d’une telle stratégie restent néanmoins controversés. En effet, le portage streptococcique est fréquemment asymptomatique et l’existence de portes d’entrée potentielles non pharyngées, comme la peau, limitent l’efficacité de la prévention primaire [12, 13].
La recherche actuelle se concentre sur le développement d’un vaccin antistreptocoque. Cependant, les explorations concernent essentiellement les souches bactériennes présentes dans certaines régions du monde (Amérique du Nord et Australie). La variabilité géographique des souches et l’implication potentielle d’autres groupes de streptocoques compromettent le succès de ces recherches cliniques [14].
Prévention secondaire
La prophylaxie secondaire repose sur la prévention des rechutes de RAA. L’antibiothérapie régulière au long cours vise à limiter le portage de l’agent pathogène. Il est recommandé d’administrer la pénicilline par voie intramusculaire (et non par voie orale) toutes les 3 à 4 semaines en adaptant les posologies au poids du patient. La durée du traitement dépend de la date de la dernière attaque de RAA, de l’âge du patient et de la sévérité des lésions valvulaires [15]. La prophylaxie secondaire s’est avérée particulièrement efficace lorsqu’elle est encadrée par un suivi à l’aide de registres spécifiques. Ces registres régionaux ou nationaux ont permis d’améliorer la compliance au traitement et de prendre en charge précocement les cas sévères.
L’éducation des acteurs de santé et de la population, associée à la prophylaxie primaire et secondaire, est une stratégie efficace pour contrôler la maladie et entraîner une réduction significative des coûts économiques induits par les formes évoluées de RAA. Contrairement à la prévention primaire, la prévention secondaire a fait la preuve de son efficacité avec un rapport coût/bénéfice intéressant [16]. Débuter un traitement antibiotique chez les enfants ayant eu un épisode de RAA est un enjeu majeur pour assurer le contrôle de la maladie.
Surveillance passive et surveillance active
La surveillance passive repose sur l’enregistrement des patients se présentant spontanément dans les structures de soins lorsque la CR est symptomatique et donc déjà évoluée. Dans la mesure où aucun signe clinique de RAA ne précède le diagnostic de CR dans la moitié des cas, l’OMS et le Conseil de l’Europe préconisent des politiques de surveillance active [11, 17]. Le dépistage de la cardiopathie peut être fait chez les enfants en milieu scolaire ou au sein de la communauté. Les premières campagnes de dépistage reposaient sur des outils diagnostiques peu performants : l’auscultation cardiaque et l’histoire clinique du patient. En effet, la sensibilité et la spécificité de l’auscultation cardiaque sont faibles, même pour des cardiologues expérimentés. Par ailleurs, un autre élément limite l’intérêt de l’approche clinique : l'auscultation se normalise dans environ un tiers des cas de RAA avec cardite dans les mois qui suivent [1].
Dépistage échographique de l’atteinte cardiaque : avantages, inconvénients et incertitudes
Le développement considérable des techniques d’imagerie au cours des vingt dernières années explique que l’échographie soit devenue la modalité de choix pour explorer les valves cardiaques (Figure 4). Les progrès technologiques ont non seulement conduit à l’amélioration de la qualité des images, mais aussi à la miniaturisation des appareils.
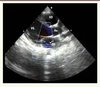 |
Figure 4. Échographie cardiaque transthoracique : vue parasternale grand axe. Jeune garçon de 13 ans [3, 18] dépisté en 2005 lors d’une échographie systématique à l’école (Polana Canico B, Maputo, Mozambique). Il existait une fuite mitrale bien visible en Doppler (flèche), associée à un remaniement des feuillets valvulaires (épaississement du bord valvulaire, remaniement discret de l’appareil sous-valvulaire). Ao : aorte ; OG : oreillette gauche ; VG : ventricule gauche ; VD : ventricule droit (photo reprise de [18], © American heart association, avec l’autorisation de l’éditeur). |
Notre équipe a été amenée à repenser la place de l’échographie dans le dépistage de la CR. L’étude princeps a été conduite dans deux pays dans lesquels le RAA est endémique : le Mozambique et le Cambodge. Les résultats ont mis en évidence la performance de l’échographie dans la détection des lésions valvulaires inaudibles à l’auscultation chez les enfants scolarisés [3] (Figure 5). Le nombre de lésions valvulaires était 3 à 10 fois supérieur à celui détecté par le stéthoscope selon les critères utilisés [18, 19]. Ces données ont ensuite été confirmées par d’autres équipes [20].
 |
Figure 5. Prévalence de la cardiopathie rhumatismale selon le mode de dépistage. Examen clinique versus échographie cardiaque [3] (© New Engand Journal of Medicine, avec l'accord du journal). |
Cependant, la distinction entre une situation variante de la normale et une atteinte rhumatismale minime est parfois subtile. Un consensus a été récemment établi par des experts internationaux, sous l’égide de la World heart federation, qui énonce les critères diagnostiques échographiques de la CR, y compris pour les formes infracliniques [21]. La prévalence de ces lésions minimes détectées à l’échocardiographie était plus élevée chez les enfants issus de groupes socioethniques à risque de RAA, ce qui constitue un argument fort en faveur de leur caractère pathologique (et non physiologique) [22].
Ces premiers résultats doivent faire repenser l’approche de la CR, notamment en termes de stratégie de dépistage et de prévention secondaire précoce dans des pays où la faible progression du niveau de vie rend les préventions primordiale et primaire illusoires [23]. Un dépistage de masse à l’aide d’appareils échographiques ultraportables permettrait de débuter précocement un traitement efficace et peu coûteux et limiterait la progression de la maladie. Pourtant, plusieurs points devront être clarifiés avant de pouvoir généraliser cette stratégie de dépistage de masse : la pertinence de la détection de lésions infracliniques, l’intérêt de la prophylaxie secondaire des cas dépistés très précocement, la manipulation de critères échographiques complexes nécessitant une expertise, et le rapport coût/efficacité [24, 25]. Même s’il semble légitime de traiter par antibiotiques les patients chez lesquels la CR infraclinique est certaine, la prise en charge des enfants dont l’atteinte rhumatismale est jugée comme étant seulement probable reste mal codifiée. La réalisation d’études multicentriques menées par des groupes internationaux semble indispensable afin de répondre à ces questions.
Conclusion
Le RAA demeure un problème majeur de santé publique dans les pays en voie de développement, alors même que des stratégies de prévention efficaces existent. L’échographie est capable d’identifier précocement les lésions valvulaires rhumatismales et pourrait jouer un rôle fondamental dans le dépistage et l’élargissement des mesures de prévention secondaire du RAA dans les régions où la maladie est encore endémique.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Marijon E, Mirabel M, Celermajer DS, Jouven X. Rheumatic heart disease. Lancet 2012 ; 379 : 953–964. [CrossRef] [PubMed] [Google Scholar]
- Bach JF, Chalons S, Forier E, et al. 10-year educational programme aimed at rheumatic fever in two French Caribbean islands. Lancet 1996 ; 347 : 644–648. [CrossRef] [PubMed] [Google Scholar]
- Marijon E, Ou P, Celermajer DS, et al. Prevalence of rheumatic heart disease detected by echocardiographic screening. N Engl J Med 2007 ; 357 : 470–476. [CrossRef] [PubMed] [Google Scholar]
- Guilherme L, Kalil J. Rheumatic fever and rheumatic heart disease: cellular mechanisms leading autoimmune reactivity and disease. J Clin Immunol 2010 ; 30 : 17–23. [CrossRef] [PubMed] [Google Scholar]
- Kaplan MH, Bolande R, Rakita L, Blair J. Presence of bound immunoglobulins and complement in the myocardium in acute rheumatic fever. Association with cardiac failure. N Engl J Med 1964 ; 271 : 637–645. [CrossRef] [PubMed] [Google Scholar]
- Jack DL, Klein NJ, Turner MW. Mannose-binding lectin: targeting the microbial world for complement attack and opsonophagocytosis. Immunol Rev 2001 ; 180 : 86–99. [CrossRef] [PubMed] [Google Scholar]
- Engel ME, Stander R, Vogel J, et al. Genetic susceptibility to acute rheumatic fever: a systematic review and meta-analysis of twin studies. PLoS One 2011 ; 6 : e25326. [CrossRef] [PubMed] [Google Scholar]
- Bryant PA, Robins-Browne R, Carapetis JR, Curtis N. Some of the people, some of the time: Susceptibility to acute rheumatic fever. Circulation 2009 ; 119 : 742–753. [CrossRef] [PubMed] [Google Scholar]
- Special writing group of the Committee on rheumatic rever, endocarditis, and Kawasaki disease of the Council on cardiovascular disease in the young of the American heart association. Guidelines for the diagnosis of rheumatic fever. Jones criteria, 1992 update. JAMA 1992 ; 268 : 2069–2073. [CrossRef] [PubMed] [Google Scholar]
- Carapetis JR, Steer AC, Mulholland EK, Weber M. The global burden of group A streptococcal diseases. Lancet Infect Dis 2005 ; 5 : 685–694. [CrossRef] [PubMed] [Google Scholar]
- WHO. Rheumatic fever and rheumatic heart disease. Report of a WHO expert Consultation. Geneva : WHO, 2001. [Google Scholar]
- McDonald M, Currie BJ, Carapetis JR. Acute rheumatic fever: a chink in the chain that links the heart to the throat? Lancet Infect Dis 2004 ; 4 : 240–245. [CrossRef] [PubMed] [Google Scholar]
- Lennon D, Stewart J, Farrell E, et al. School-based prevention of acute rheumatic fever: a group randomized trial in New Zealand. Pediatr Infect Dis J 2009 ; 28 : 787–794. [CrossRef] [PubMed] [Google Scholar]
- Steer AC, Law I, Matatolu L, et al. Global emm type distribution of group A streptococci: systematic review and implications for vaccine development. Lancet Infect Dis 2009 ; 9 : 611–616. [CrossRef] [PubMed] [Google Scholar]
- WHO. The WHO global programme for the prevention of rheumatic fever and rheumatic heart disease. WHO, 1999. http://whqlibdoc.who.int/hq/2000/WHO_CVD_00.1.pdf. [Google Scholar]
- Steer AC, Carapetis JR. Prevention and treatment of rheumatic heart disease in the developing world. Nat Rev Cardiol 2009 ; 6 : 689–698. [CrossRef] [PubMed] [Google Scholar]
- Council of Europe, Committee of Ministers. Recommendation n° R (94) 11 on screening as a tool of preventive medicine. 1994. http://www1.umn.edu/humanrts/instree/coerecr94–11.html. [Google Scholar]
- Marijon E, Celermajer DS, Tafflet M, et al. Rheumatic heart disease screening by echocardiography: the inadequacy of World Health Organization criteria for optimizing the diagnosis of subclinical disease. Circulation 2009 ; 120 : 663–668. [CrossRef] [PubMed] [Google Scholar]
- Mirabel M, Celermajer DS, Ferreira B, et al. Simplified echo-based approach for rheumatic heart disease screening. Eur Heart J Cardiovasc Imaging 2012 ; 25 mai (online). [Google Scholar]
- Carapetis JR, Hardy M, Fakakovikaetau T, et al. Evaluation of a screening protocol using auscultation and portable echocardiography to detect asymptomatic rheumatic heart disease in Tongan schoolchildren. Nat Clin Pract Cardiovasc Med 2008 ; 5 : 411–417. [CrossRef] [PubMed] [Google Scholar]
- Remenyi B, Wilson N, Steer A, et al. World Heart Federation criteria for echocardiographic diagnosis of rheumatic heart disease-an evidence-based guideline. Nat Rev Cardiol 2012 ; 9 : 297–309. [CrossRef] [PubMed] [Google Scholar]
- Webb R, Gentles T, Stirling J, Wilson N. Echocardiographic findings in NZ children from a low-risk population for acute rheumatic fever: implications for rheumatic heart disease screening. In : 62nd Annual scientific meeting of the Paediatric society of New Zealand. New Plymouth, NZ, 24th November 2010 (abstract). [Google Scholar]
- Marijon E, Ou P, Celermajer DS, et al. Echocardiographic screening for rheumatic heart disease. Bull World Health Org 2008 ; 86 : 84. [CrossRef] [Google Scholar]
- Marijon E, Celermajer DS, Jouven X. Management of patients with subclinical rheumatic heart disease. Int J Cardiol 2009 ; 134 : 295–296. [CrossRef] [PubMed] [Google Scholar]
- Celermajer DS, Chow C, Marijon E, et al. Cardiovascular diseases in the developing world. Prevalences, patterns and the potential of early detection. J Am Coll Cardiol 2012 (sous presse). [Google Scholar]
Liste des figures
 |
Figure 1. Mimétisme moléculaire à l’origine d’une réaction auto-immune contre les cellules valvulaires lors du RAA (premier accès et/ou rechutes). Le mimétisme moléculaire résulte de la similitude existant entre certains antigènes (Ag) du streptocoque (strept.) (protéine M par exemple) et des antigènes tissulaires exprimés par les cellules endothéliales ou les cellules cardiaques (myosine par exemple). Ce mimétisme peut déclencher une réaction immune inappropriée (flèches bleues) soit via l’activation des lymphocytes (Ly) T directement par certains Ag bactériens (1), soit via l’activation de lymphocytes autoréactifs ayant échappé à la sélection thymique (2). Ces Ly migrent vers le tissu cardiaque où ils reconnaissent des antigènes tissulaires partageant des séquences communes avec les Ag bactériens (c’est le cas de la myosine), et induisent une réponse immune inappropriée (4). Ces Ly peuvent aussi pérenniser une réponse humorale croisée (autoanticorps en 3) contre ces antigènes. La réponse auto-immune est amplifiée par la stimulation de la réponse innée par le MBL et par des cytokines sécrétées par les macrophages et les lymphocytes. La réponse immune normale à l’infection est indiquée en pointillés gris (5). |
| Dans le texte | |
 |
Figure 2. Prévalence de la cardiopathie rhumatismale chez les enfants âgés de 5 à 14 ans dans le monde. Les pays marqués d'un cercle gris – Australie et Nouvelle Zélande – ont une prévalence élevée parmi les populations aborigènes (repris de [10], © Lancet Infectious Diseases, avec l’accord du Journal). |
| Dans le texte | |
 |
Figure 3. Physiopathologie de la cardiopathie rhumatismale, moyens thérapeutiques actuels et voies de recherche. |
| Dans le texte | |
 |
Figure 4. Échographie cardiaque transthoracique : vue parasternale grand axe. Jeune garçon de 13 ans [3, 18] dépisté en 2005 lors d’une échographie systématique à l’école (Polana Canico B, Maputo, Mozambique). Il existait une fuite mitrale bien visible en Doppler (flèche), associée à un remaniement des feuillets valvulaires (épaississement du bord valvulaire, remaniement discret de l’appareil sous-valvulaire). Ao : aorte ; OG : oreillette gauche ; VG : ventricule gauche ; VD : ventricule droit (photo reprise de [18], © American heart association, avec l’autorisation de l’éditeur). |
| Dans le texte | |
 |
Figure 5. Prévalence de la cardiopathie rhumatismale selon le mode de dépistage. Examen clinique versus échographie cardiaque [3] (© New Engand Journal of Medicine, avec l'accord du journal). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




