| Issue |
Med Sci (Paris)
Volume 27, Number 6-7, Juin–Juillet 2011
|
|
|---|---|---|
| Page(s) | 585 - 586 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2011276008 | |
| Published online | 01 July 2011 | |
La réactivation par translecture du gène p53 possédant une mutation non-sens induit l’apoptose de cellules cancéreuses
Rescue of nonsense mutated p53 by readthrough leads to apoptosis in cancers cells
1
Université Paris-Sud, Institut de génétique et microbiologie, Université Paris XI, UMR8621, bâtiment 400 Orsay F-91405, France
2
CNRS, Orsay, F-91405 et UPMC- Université Paris 6 Paris, France
Environ 10 % des maladies génétiques humaines sont liées à l’apparition d’un codon stop prématuré dans une séquence codante (mutation non-sens), qui conduit à la synthèse d’une protéine tronquée et éventuellement à la dégradation de l’ARNm par la voie nonsense mediated mRNA decay (NMD) [1]. Depuis une dizaine d’années, une stratégie thérapeutique qui cible l’étape de traduction est explorée. Elle consiste à rétablir la synthèse d’une protéine complète en utilisant des molécules qui favorisent l’incorporation d’un ARN de transfert (ARNt) au niveau de la mutation non-sens (événement appelé translecture). Actuellement, les molécules les plus utilisées pour favoriser la translecture sont les antibiotiques de la famille des aminoglycosides (gentamicine, amikacine, G418, etc.) qui se fixent au niveau du site de décodage du ribosome. Cette approche a déjà été évaluée pour plusieurs maladies génétiques, dont des myopathies et la mucoviscidose [2, 3].
Réactiver un gène suppresseur de tumeur comme stratégie anticancéreuse
La réexpression de la copie sauvage d’un gène suppresseur de tumeur dans une cellule déficiente pour celui-ci permet généralement de limiter la prolifération en induisant l’arrêt du cycle cellulaire ou l’apoptose [4]. Des résultats prometteurs ont été obtenus pour des mutants faux-sens avec des molécules qui permettent de rétablir la conformation correcte de la protéine p53 [5]. Ces molécules ne peuvent pas être utilisées pour des mutations non-sens qui conduisent à la synthèse d’une protéine tronquée. Dans un travail récent, nous avons étudié la possibilité d’utiliser des inducteurs de translecture pour réactiver le gène suppresseur de tumeur p53, le gène le plus fréquemment muté dans les cancers humains [6] (Figure 1).
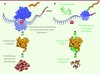 |
Figure 1 La réactivation du gène p53 possédant une mutation non-sens induit l’apoptose de cellules cancéreuses en culture. A. Un codon stop prématuré (mutation non-sens) dans le gène suppresseur de tumeur p53 induit la synthèse d’une protéine p53 tronquée, incapable de limiter la prolifération cellulaire. B. Des inducteurs de translecture, tels que les aminoglycosides, favorisent le passage de codons stop prématurés (événement appelé translecture) et permettent ainsi de synthétiser une protéine p53 entière, capable d’induire l’apoptose de cellules cancéreuses humaines en culture. |
Mesure du taux de translecture de mutations non-sens dans le gène p53
Nous avons d’abord quantifié le taux de translecture de 11 mutations non-sens répertoriées dans le gène p53, en présence d’antibiotiques aminoglycosides. Les 3 mutations non-sens Q192X, R213X et E298X présentaient les plus forts taux de translecture (respectivement 0,7 %, 2,8 % et 0,5 % en présence de gentamicine). Ces taux de translecture semblent modestes, mais sont du même ordre de grandeur que ceux qui ont permis d’observer un bénéfice thérapeutique chez des patients atteints de mucoviscidose traités par la gentamicine [7].
Les aminoglycosides permettent de réexprimer une protéine p53 entière et active
Les effets du traitement par les aminoglycosides ont d’abord été analysés dans la lignée humaine de cancer du sein HDQ-P1 [8], qui possède la mutation présentant le plus fort taux de translecture : R213X. Des expériences de PCR quantitative ont montré que l’ARNm mutant est soumis à la voie NMD. Après traitement de ces cellules par la gentamicine ou par le G418, nous avons observé une stabilisation de l’ARNm mutant jusqu’à un facteur 8. Celle-ci pourrait être due à un effet antagoniste entre la translecture et la reconnaissance de l’ARNm par la voie NMD. De plus, le traitement par les antibiotiques permet de détecter la protéine p53 entière par western blot à un taux de 80 % par rapport à des cellules témoins p53+/+. Grâce à l’utilisation d’un gène rapporteur, nous avons mis en évidence que la protéine p53 réexprimée était transcriptionnellement active. Dans ces expériences, les quantités d’ARNm et de protéine active réexprimée étaient proportionnelles au taux de translecture. Pour les deux autres mutations étudiées (Q192X et E298X), le traitement par les aminoglycosides permet également de réexprimer une protéine p53 entière et fonctionnelle.
Nous avons montré par PCR quantitative que la protéine p53 réexprimée après traitement par le G418 était capable de réguler correctement l’expression de gènes cibles tels que p21, impliqué dans l’arrêt du cycle cellulaire et Bax, impliqué dans l’apoptose. Le traitement par les aminoglycosides de cellules humaines cancéreuses présentant une mutation non-sens dans le gène p53 permet donc de réexprimer une protéine p53 entière et fonctionnelle.
Les aminoglycosides induisent l’apoptose de cellules cancéreuses porteuses d’une mutation non-sens de p53
Nous avons ensuite évalué la répercussion de l’augmentation de translecture de mutations non-sens dans le gène p53 sur la prolifération cellulaire. Cette étude a été réalisée avec les deux mutations qui possèdent les taux de translecture les plus hauts : R213X, Q192X. Pour ces expériences, nous avons utilisé la lignée de cancer du poumon H1299, déficiente pour p53 et qui est sensible à la réintroduction d’un allèle sauvage du gène p53. Cette lignée a été transfectée de manière transitoire avec un vecteur exprimant les ADNc des versions sauvage ou mutantes de p53. La viabilité et le pourcentage de cellules en apoptose ont ensuite été estimés par la technique de cytométrie en flux. Dans ces conditions, lorsque les cellules porteuses d’une mutation non-sens sont exposées au G418, on observe une diminution du nombre de cellules vivantes et une augmentation du pourcentage de cellules en apoptose précoce et tardive à un niveau quasiment identique à celui obtenu lors de la transfection des cellules par l’ADNc p53 sauvage.
En résumé, l’utilisation de molécules qui augmentent la translecture permet de réexprimer une protéine p53 capable de limiter la prolifération cellulaire d’une lignée tumorale humaine en induisant l’apoptose. Les résultats de deux études récentes sur le gène adenomatous polyposis coli interrompu par une mutation non-sens suggèrent fortement que cette stratégie thérapeutique pourrait être élargie à d’autres suppresseurs de tumeur ([9] ; C. Floquet, J.P. Rousset et L. Bidou, communication personnelle). L’induction de la translecture de codons stop prématurés dans des gènes suppresseurs de tumeur pourrait donc représenter une nouvelle stratégie thérapeutique pour certains cancers.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Références
- Camier S, Seraphin B. Détruisez ce message (ARN) après l’avoir lu ! Med Sci (Paris) 2007 ; 23 : 850-6. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Keeling KM, Du M, Bedwell DMMaquat LE, ed. edTherapies of nonsense-associated diseases. Nonsense-mediated mRNA decay. Austin TX : Landes Bioscience, 2006. [Google Scholar]
- Rowe SM, Clancy JP. Pharmaceuticals targeting nonsense mutations in genetic diseases: progress in development. BioDrugs 2009 ; 23 : 165-74. [CrossRef] [PubMed] [Google Scholar]
- Toledo F, Bluteau O, Simeonova I. Réactivation de p53 dans les tumeurs : une stratégie antitumorale prometteuse. Med Sci (Paris) 2007 ; 23 : 565-567. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Bykov VJ, Issaeva N, Shilov A, et al. Restoration of the tumor suppressor function to mutant p53 by a low-molecular-weight compound. Nat Med 2002 ; 8 : 282-288. [CrossRef] [PubMed] [Google Scholar]
- Floquet C, Deforges J, Rousset JP, Bidou L.Rescue of non-sense mutated p53 tumor suppressor gene by aminoglycosides. Nucleic Acids Res 2010 ; 39 : 3350-3362. [Google Scholar]
- Sermet-Gaudelus I, Renouil M, Fajac A, et al. In vitro prediction of stop-codon suppression by intravenous gentamicin in patients with cystic fibrosis: a pilot study. BMC Med 2007 ; 5 : 5. [CrossRef] [PubMed] [Google Scholar]
- Wang CS, Goulet F, Lavoie J, et al. Establishment and characterization of a new cell line derived from a human primary breast carcinoma. Cancer Genet Cytogenet 2000 ; 120 : 58-72. [CrossRef] [PubMed] [Google Scholar]
- Zilberberg A, Lahav L, Rosin-Arbesfeld R. Restoration of APC gene function in colorectal cancer cells by aminoglycoside- and macrolide-induced read-through of premature termination codons. Gut 2010 ; 59 : 496-507. [CrossRef] [PubMed] [Google Scholar]
© 2011 médecine/sciences – Inserm / SRMS
Liste des figures
 |
Figure 1 La réactivation du gène p53 possédant une mutation non-sens induit l’apoptose de cellules cancéreuses en culture. A. Un codon stop prématuré (mutation non-sens) dans le gène suppresseur de tumeur p53 induit la synthèse d’une protéine p53 tronquée, incapable de limiter la prolifération cellulaire. B. Des inducteurs de translecture, tels que les aminoglycosides, favorisent le passage de codons stop prématurés (événement appelé translecture) et permettent ainsi de synthétiser une protéine p53 entière, capable d’induire l’apoptose de cellules cancéreuses humaines en culture. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




