| Issue |
Med Sci (Paris)
Volume 27, Number 1, Janvier 2011
|
|
|---|---|---|
| Page(s) | 19 - 21 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/201127119 | |
| Published online | 10 February 2011 | |
Force de traction à l’interface cellule-matrice extracellulaire et destin des cellules souches mésenchymateuses
Cell-traction mediated configuration of the cell/extracellular-matrix interface plays a key role in stem cell fate
1 École des sciences de l’ingénieur et des sciences appliquées, Université de Harvard, 29 Oxford Street, Cambridge MA 02138, États-Unis
2 Inserm U577, Biomatériaux et réparation tissulaire, Université de Bordeaux 2, 146 rue Léo Saignat, 33076 Bordeaux, France
Les cellules souches, cellules dotées des capacités combinées d’autorenouvellement et de différenciation, sont l’objet de toutes les attentions pour leurs applications en médecine régénératrice. Elles seraient utilisées via des approches de thérapie cellulaire ou d’ingénierie tissulaire pour remplacer ou réparer des tissus ou organes endommagés par une lésion, une maladie ou tout simplement le vieillissement [1]. Parmi les cellules souches adultes, les cellules souches mésenchymateuses (CSM) ont démontré leur propriété de multipotence, c’est-à-dire de se différencier en un certain nombre de cellules spécialisées sous l’action d’inducteurs solubles et/ou des facteurs biochimiques et biophysiques constituant leur microenvironnement [2]. De ce fait, ces cellules souches sont devenues, au cours des dernières années, un modèle cellulaire passionnant au cœur de nombreuses études sur la régénération tissulaire. Identifier, isoler et apprendre à utiliser des cellules souches adultes pour la médecine régénératrice est ainsi devenu un enjeu majeur de la recherche biomédicale [3, 4].
Contrôle du devenir des CSM par les propriétés mécaniques du microenvironnement en conditions 2D et 3D
La démonstration en 2006 par Engler et al. [5] que les propriétés mécaniques des substrats sur lesquels reposent les cellules souches pouvaient orienter la différenciation de ces dernières vers des lignages spécifiques a ouvert la voie à un nombre important d’études portant sur les processus de mécanotransduction au contact de matrices extracellulaires artificielles. L’observation principale de ce travail était l’importance de la rigidité du substrat pour la spécification des CSM vers un lignage ou un autre. Par exemple, les CSM cultivées sur des substrats mous se différenciaient vers un phénotype myogénique alors que les CSM cultivées sur des substrats rigides s’orientaient vers une voie ostéogénique.
Parallèlement, de nombreux travaux publiés au cours de ces dix dernières années ont montré que le comportement des cellules cultivées dans des conditions bi- ou tridimensionnelles était différent. Cuckierman et al. [6] ont ainsi identifié des différences dans les complexes d’adhésion cellulaire mis en jeu dans des environnements 2D et 3D. Une autre observation est la modification des réponses cellulaires à des facteurs de croissance très variées lors du passage d’un environnement 2D à un environnement 3D [2]. Il était donc logique de penser que l’impact des signaux mécaniques sur le devenir des cellules souches encapsulées dans un environnement 3D serait aussi différent de celui qui se produirait dans un environnement 2D.
Des travaux récents menés dans notre laboratoire d’ingénierie cellulaire et tissulaire à l’Université de Harvard ont apporté un nouvel éclairage sur la possibilité de contrôler le devenir des CSM via les propriétés mécaniques d’un microenvironnement cellulaire artificiel 3D (Figure 1) [7]. Nos travaux démontrent l’effet de la rigidité de la matrice extracellulaire sur les liaisons entre les ligands RGD (séquence Arg-Gly-Asp) et les récepteurs intégrines, et, au-delà, sur l’orientation des processus de différenciation cellulaire. Afin d’étudier la sensibilité des populations de CSM vis-à-vis de la rigidité de leur microenvironnement 3D, des matrices extracellulaires synthétiques composées d’hydrogels d’alginate modifiés par couplage covalent de séquences peptidiques Arg-Gly-Asp (RGD) ont été synthétisées. Les paramètres de préparation ont été variés de façon à contrôler à la fois le module d’élasticité (E) - une mesure quantitative de la rigidité de la matrice - et la densité de ligands greffés (Figure 1). Cette étude a révélé que la rigidité de la matrice avait un effet significatif sur le devenir des CSM, montrant une relation biphasique entre la rigidité des matrices et l’engagement ostéogénique, avec un maximum d’efficacité à des valeurs E de 11-30 kilopascals (kPa) (Figure 2 A-C), et un engagement adipogénique pour des matrices plus molles (2,5-5kPa).
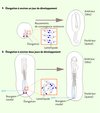 |
Figure 1 Devenir et engagement des cellules souches. Ces événements sont régis par des interactions moléculaires complexes et réciproques entre les cellules et leur microenvironnement mettant en jeu notamment les récepteurs membranaires de type intégrines. Dans le cadre de cette étude, les cellules souches mésenchymateuses de souris ont été encapsulées dans des hydrogels de rigidité différente et présentant différentes densités de ligands peptidiques RGD. Le module d’élasticité influence indirectement la réorganisation et l’agrégation de ces peptides sous l’action des forces contractiles exercées par les cellules, ce qui a pour conséquence d’influencer leur différenciation. |
 |
Figure 2 La configuration de la matrice 3D altère le devenir des CSM. A-C. Coloration in situ montrant l’expression de l’activité de la phosphase alcaline (PAL) (Fast Blue, biomarqueur ostéogénique de couleur bleue) et l’accumulation de lipides neutres (Oil Red O, biomarqueur adipogénique de couleur rouge) après 1 semaine en culture en présence de facteurs ostéogéniques et adipogéniques CSM encapsulées dans différentes matrices polymères. Ces dernières étaient modifiées par des greffes de la séquence peptidique RGD (754 μM) en concentration constante, et présentant différentes rigidités (différentes valeurs de kPa) : alginate-RGD (A), agarose-RGD (B) ou poly (éthylène glycol diméthacrylate)-RGD (C). D. Vue en 3D de Nb (mesure du nombre de liaisons CSM-RGD par cellule obtenue à partir de la technique FRET) en fonction du module d’élasticité (E) et de NRGD/cellule (qui reflète la densité en RGD). Les résultats indiquent qu’un nombre important de cellules de la population naïve des CSM encapsulées dans des matrices de rigidité avoisinant 11-30 kPa produisent, indépendamment de la nature de la matrice polymère, de la phosphatase alcaline (PAL) et de l’ostéocalcine (OCN), deux marqueurs indicatifs de l’ostéogenèse. De plus, la relation biphasique entre Nb et la rigidité a été maintenue lorsque E a été modifiée, suggérant que le nombre de points d’attachement RGD-cellules est aussi un paramètre important corrélé à la spécification ostéogénique (reproduit de la ref [7] avec la permission des auteurs). |
Les liaisons RGD-intégrines, capteurs de la rigidité des matrices extracellulaires tributaires des forces de traction
Après avoir établi le rôle de l’élasticité de la matrice dans la régulation du phénotype des CSM cultivées en 3D, nous nous sommes intéressés aux mécanismes sous-jacents. Ceux-ci pouvaient faire intervenir des variations, entre les différentes matrices synthétisées, dans la concentration locale des petites molécules (notamment les ions calcium utilisés pour réticuler les matrices [Figure 1]), dans la diffusion des morphogènes ou leur accumulation au voisinage des cellules, dans la morphologie cellulaire et/ou nucléaire (comme on pouvait l’observer dans les expériences faites sur des substrats 2D [5]), ou au niveau des liaisons entre les intégrines et les ligands adhésifs RGD greffés sur la matrice. Grâce à l’utilisation d’un modèle expérimental permettant d’isoler les différentes variables, nous avons notamment pu démontrer qu’à l’instar des cellules observées in vivo, les CSM présentent une morphologie ronde et quasi-constante quelle que soit la rigidité des gels d’alginate fonctionnalisés dans lesquels elles sont encapsulées, et nous avons pu identifier le rôle des liaisons RGD-intégrines comme capteurs de la rigidité de ces matrices.
Des premières analyses par ELISA et par Förster resonance energy transfer (FRET) ont montré que dans un environnement 3D, les ligands RGD sont liés principalement aux intégrines de type α5, et que l’évolution du nombre de liaisons RGD-récepteurs α5 par cellule en fonction de la rigidité de la matrice suit aussi une relation biphasique, avec un maximum observé pour une rigidité de 22 kPa, en corrélation avec une spécification de type ostéogénique. Cette relation biphasique étant perdue lorsque les cellules sont traitées avec un inhibiteur de la myosine-II, le rôle de la contractilité cellulaire est alors apparu comme primordial pour la maîtrise des interactions entre peptides et intégrines. De nouvelles observations réalisées par FRET (entre des peptides RGD-FITC [fluoroscéine isothyocyanate] et RGD-TAMRA [tétraméthyl-6-carboxyrhodamine] attachés à différentes chaînes d’alginate [Figure 2D]) ont permis de mettre en évidence que les cellules utilisent leurs forces contractiles pour réorganiser les ligands RGD sous la forme de clusters. Cette réorganisation de la matrice est maximale pour des matrices de rigidité intermédiaire (22 kPa), ce qui suggère que pour des matrices très compliantes, les cellules ne peuvent pas assembler les complexes d’adhésion nécessaires pour exercer les forces de traction alors qu’à l’inverse, dans le cas des matrices rigides, ces forces sont insuffisantes.
En conclusion
Ces résultats démontrent donc que la configuration mécanique et biochimique de la matrice extracellulaire joue un rôle important dans le devenir des cellules souches mésenchymateuses. Une rigidité intermédiaire de matrice extracellulaire autorise les cellules à utiliser les forces de traction mécanique afin de réorganiser et regrouper les peptides disponibles dans leur microenvironnement. Aussi, alors que les cellules sont capables de manipuler et de traiter les signaux dans l’environnement péricellulaire, l’environnement local exerce à son tour une influence sur leur comportement. La rigidité de la matrice extracellulaire influence ainsi le processus de réorganisation des ligands d’adhésion à l’échelle nanoscopique, et en conséquence, les interactions ligands-intégrines. Ces dernières sont tributaires des forces de traction cellulaire et corrélées avec l’engagement des populations de CSM vers des lignages ostéogéniques. Par ailleurs, alors que ces résultats suggèrent que la configuration 3D (rigidité, présentation des ligands adhésifs) de la matrice extracellulaire joue un rôle primordial dans le devenir des cellules souches, celui-ci ne semble pas corrélé à une morphologie particulière, à l’inverse de ce qui se passe dans une configuration 2D.
Ces études démontrent que les relations entre le devenir des CSM et les propriétés mécaniques et biochimiques du microenvironnement cellulaire sont complexes. Il est donc nécessaire de poursuivre l’analyse du contrôle de la différenciation des CSM au contact de matrices extracellulaires artificielles, sachant que la malléabilité de ces dernières peut s’avérer être un outil extrêmement puissant pour obtenir des lignées cellulaires spécialisées et pour le développement clinique des stratégies de médecine régénératrice.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Références
- Svendsen C. Stem cell-based therapeutics. Nat Rev Drug Discov 2010 ; 9 : 83. [Google Scholar]
- Hwang NS, Zhang C, Hwang YS, Varghese S. Mesenchymal stem cell differentiation and roles in regenerative medicine. Wiley Interdiscip Rev Syst Biol Med 2009 ; 1 : 97-106. [CrossRef] [PubMed] [Google Scholar]
- Takahashi T, Kawai T, Ushikoshi H, et al. Identification and isolation of embryonic stem cell-derived target cells by adenoviral conditional targeting. Mol Ther 2006 ; 14 : 673-683. [CrossRef] [PubMed] [Google Scholar]
- Lutolf MP, Hubbell JA. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat Biotechnol 2005 ; 23 : 47-55. [CrossRef] [PubMed] [Google Scholar]
- Engler AJ, Sen S, Sweeny HL, Discher DE. Matrix elasticity directs stem cell lineage specification. Cell 2006 ; 126 : 677-689. [CrossRef] [PubMed] [Google Scholar]
- Cukierman E, Pankov R, Stevens DR, Yamada KM. Taking cell-matrix adhesions to the third dimension. Science 2010 ; 294 : 1708-1712. [Google Scholar]
- Huebsch N, Arany PR, Mao AS, et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat Mat 2010 ; 9 : 518-526. [CrossRef] [Google Scholar]
© 2011 médecine/sciences – Inserm / SRMS
Liste des figures
 |
Figure 1 Devenir et engagement des cellules souches. Ces événements sont régis par des interactions moléculaires complexes et réciproques entre les cellules et leur microenvironnement mettant en jeu notamment les récepteurs membranaires de type intégrines. Dans le cadre de cette étude, les cellules souches mésenchymateuses de souris ont été encapsulées dans des hydrogels de rigidité différente et présentant différentes densités de ligands peptidiques RGD. Le module d’élasticité influence indirectement la réorganisation et l’agrégation de ces peptides sous l’action des forces contractiles exercées par les cellules, ce qui a pour conséquence d’influencer leur différenciation. |
| Dans le texte | |
 |
Figure 2 La configuration de la matrice 3D altère le devenir des CSM. A-C. Coloration in situ montrant l’expression de l’activité de la phosphase alcaline (PAL) (Fast Blue, biomarqueur ostéogénique de couleur bleue) et l’accumulation de lipides neutres (Oil Red O, biomarqueur adipogénique de couleur rouge) après 1 semaine en culture en présence de facteurs ostéogéniques et adipogéniques CSM encapsulées dans différentes matrices polymères. Ces dernières étaient modifiées par des greffes de la séquence peptidique RGD (754 μM) en concentration constante, et présentant différentes rigidités (différentes valeurs de kPa) : alginate-RGD (A), agarose-RGD (B) ou poly (éthylène glycol diméthacrylate)-RGD (C). D. Vue en 3D de Nb (mesure du nombre de liaisons CSM-RGD par cellule obtenue à partir de la technique FRET) en fonction du module d’élasticité (E) et de NRGD/cellule (qui reflète la densité en RGD). Les résultats indiquent qu’un nombre important de cellules de la population naïve des CSM encapsulées dans des matrices de rigidité avoisinant 11-30 kPa produisent, indépendamment de la nature de la matrice polymère, de la phosphatase alcaline (PAL) et de l’ostéocalcine (OCN), deux marqueurs indicatifs de l’ostéogenèse. De plus, la relation biphasique entre Nb et la rigidité a été maintenue lorsque E a été modifiée, suggérant que le nombre de points d’attachement RGD-cellules est aussi un paramètre important corrélé à la spécification ostéogénique (reproduit de la ref [7] avec la permission des auteurs). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




