| Issue |
Med Sci (Paris)
Volume 23, Number 5, Mai 2007
|
|
|---|---|---|
| Page(s) | 466 - 467 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2007235466 | |
| Published online | 15 May 2007 | |
FoxO
Stress ou vie éternelle
FoxO: stress or eternal life
1
Harvard Medical School, Boston MA 02115, États-Unis
2
Karp research building, 1 Blackfan Circle, Room 5007B, Boston MA 02115, États-Unis
La voie de signalisation PI3K/AKT, activée en réponse à l’insuline ou aux facteurs de croissance, permet la régulation de nombreux mécanismes cellulaires physiologiques comme la survie, la prolifération, le métabolisme et la réponse à différents stress. Parmi les nombreuses cibles de cette voie, les facteurs de transcription de la famille FoxO (FoxO1, FoxO3, FoxO4, FoxO6) ont été remarquablement conservés au cours de l’évolution (pour revue voir [1]). En l’absence de stimulation par des facteurs de croissance ou dans des conditions de stress, les facteurs de transcription FoxO se trouvent dans le noyau et entraînent l’expression de gènes impliqués, entre autres, dans l’arrêt du cycle cellulaire et la mort cellulaire (apoptose). En réponse à une stimulation par les facteurs de croissance, la sérine/thréonine kinase AKT phosphoryle directement les facteurs FoxO et entraîne leur exclusion nucléaire et leur dégradation, permettant la survie et la prolifération cellulaires. L’activation anormale de la voie PI3K/AKT a été observée dans de nombreux cancers chez l’homme. Elle résulte de mutations de facteurs directement impliqués dans la voie PI3K/AKT (PTEN [phosphatase and tensin homolog] ou FoxO par exemple), ou de facteurs activant cette voie (exemple : ABL [abelson], FLT3 [récepteur de la cytokine flt3-ligand] ou ALK [anaplastic lymphoma kinase]), fréquemment retrouvés dans les leucémies.
FoxO est nécessaire à la fonction des cellules souches hématopoïétiques
Nous avons récemment identifié un rôle nouveau pour cette voie FoxO dans l’autorenouvellement des cellules souches. Cette fonction a été mise en évidence grâce à l’étude de souris présentant une inactivation conditionnelle des trois facteurs FoxO1, 3 et 4 à l’âge adulte (appelées FoxO1/3/4−/− par la suite) [2, 3]. L’analyse de leur système hématopoïétique, pour lequel l’étude et la purification des cellules souches hématopoïétiques (CSH) par cytométrie en flux et tri cellulaire est bien caractérisée, sera abordée ici (Figure 1).
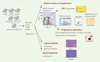 |
Figure 1. L’inactivation des facteurs FoxO entraîne des anomalies multiples des cellules hématopoïétiques. Chez des animaux irradiés transplantés avec des cellules de moelle osseuse sauvage (ligne bleue) ou FoxO1/3/4−/− (ligne rouge), le pourcentage de cellules hématopoïétiques FoxO1/3/4−/− (exprimant le marqueur CD45.2) diminue avec le temps. Les CSH FoxO1/3/4−/− présentent une entrée dans le cycle cellulaire, une mort cellulaire par apoptose et un stress oxydatif plus importants que les CSH sauvages. En dehors de l’augmentation de l’apoptose, ces caractéristiques ne sont pas observées dans les progéniteurs myéloïdes. Les souris FoxO1/3/4−/− présentent fréquemment des syndromes myéloprolifératifs de développement rapide, associé à une splénomégalie, et des lymphomes des cellules T qui se développent avec une latence plus longue. Mx1-Cre : recombinase Cre sous le contrôle du promoteur Mx1. plpC : ARN double brin synthétique activant le promoteur Mx1. |
Alors que les souris inactivées pour un seul des facteurs FoxO ne présentent pas un phénotype clair, suggérant une redondance fonctionnelle de ces facteurs, les souris FoxO1/3/4−/− développent à la fois des anomalies des cellules myéloïdes (syndromes myéloprolifératifs) et des cellules lymphoïdes (lymphomes des cellules T). Cette observation a motivé l’étude des CSH qui sont à l’origine de ces deux types cellulaires. La moelle osseuse des souris FoxO1/3/4−/− contient un nombre de cellules de phénotype LSK (lineage-Sca1+cKit+), enrichies en CSH, plus faible que celui des souris sauvages. Par ailleurs, ces cellules LSK ont des capacités réduites de formation de colonies hématopoïétiques dans des cultures in vitro, et de reconstitution du système hématopoïétique in vivo, dans des expériences de transplantation de moelle totale dans des souris irradiées. Ces résultats indiquent une anomalie fonctionnelle des CSH FoxO1/3/4−/−.
Stress oxydatif exagéré dans les CSH FoxO1/3/4−/−
Pour comprendre l’origine de cette anomalie, le cycle cellulaire, l’apoptose et la réponse aux stress oxydatifs des CSH des souris FoxO1/3/4−/− ont été mesurés. Ces études révèlent une augmentation du nombre de CSH dans la phase active S/G2/M du cycle cellulaire et une modification de l’expression de gènes impliqués dans la régulation du cycle cellulaire (tels que p130/Rb, p16INK4a, p21WAF1/CIP1 ou cycline D2) spécifiquement dans les CSH, mais pas dans les progéniteurs myéloïdes (dérivant directement des CSH). De façon inattendue cependant, un taux d’apoptose plus élevé que dans les cellules sauvages est observé à la fois dans les CSH et les progéniteurs myéloïdes. Par ailleurs, la concentration intracellulaire de radicaux libres ou ROS (reactive oxygen species) est plus élevée dans les CSH FoxO1/3/4−/− que dans les cellules sauvages et une diminution de l’expression de gènes impliqués dans la détoxification des ROS, tels les superoxide dismutases, est observée. Afin de déterminer si l’augmentation du taux de ROS est directement responsable de la diminution du nombre de CSH chez les souris FoxO1/3/4−/−, ces souris ont été traitées de façon journalière avec un agent anti-oxydant (N-acétyl-L-cystéine). Ce traitement entraîne une restauration du nombre, de la fonction et du cycle cellulaire des CSH.
Ces observations suggèrent que l’inactivation des facteurs FoxO entraîne l’entrée des cellules souches dans le cycle cellulaire et l’engagement de la différenciation terminale au détriment de l’autorenouvellement, conduisant à un épuisement du compartiment des CSH. La plupart de ces effets semblent liés à une augmentation du stress oxydatif (ROS) dans les CSH, résultant d’un défaut d’expression de gènes normalement impliqués dans leur détoxication. Ce mécanisme semble dépendre du contexte cellulaire car il n’est pas observé dans les progéniteurs myéloïdes, immédiatement dérivés des CSH. On peut noter que le taux basal de ROS dans les progéniteurs myéloïdes est beaucoup plus élevé que dans les CSH. De façon intéressante, les progéniteurs myéloïdes se différencient naturellement en neutrophiles et monocytes dont le rôle physiologique dans la réponse immunitaire de défense contre les infections, est de produire de grandes quantités de ROS. Le taux basal élevé de ROS dans les progéniteurs myéloïdes pourrait donc résulter d’un équilibre précaire entre la production de ROS à des fins utilitaires et l’effet toxique des ROS sur la survie cellulaire. Cela pourrait expliquer pourquoi les cellules myéloïdes en général ont la durée de vie la plus courte parmi les cellules hématopoïétiques [4].
Perspectives
Ces résultats mettent en perspective d’autres observations similaires rapportées récemment au cours de l’étude de modèles murins d’inactivation du facteur PTEN [5, 6], situé en amont de FoxO dans la voie PI3K/AKT, et du facteur de transcription ATM (ataxia telangiectasia mutated) [7]. Bien qu’aucun lien entre FoxO et ATM n’ait été décrit à ce jour, l’expression d’ATM et d’une de ses cibles, p16INK4a, est modifiée dans les souris FoxO1/3/4−/−. Cela suggère que le facteur ATM est une cible de FoxO. D’autre part, la β-Caténine, un autre facteur impliqué dans la biologie des CSH, pourrait interagir avec les facteurs FoxO [8, 9]. Dans l’ensemble, ces observations suggèrent un lien génétique entre ces différents facteurs (Figure 2) contrôlant l’autorenouvellement des CSH. Cette hypothèse reste cependant à prouver de façon formelle.
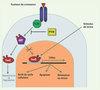 |
Figure 2. La voie PI3K/AKT/FoxO dans les cellules hématopoïétiques. Les facteurs FoxO activent la transcription de nombreux gènes cibles et entraînent l’arrêt du cycle cellulaire, l’apoptose et la résistance au stress en l’absence de facteurs de croissance et en présence de stimulus de stress. En présence de facteurs de croissance, la voie PI3K/AKT est activée, entraîne la phosphorylation des facteurs FoxO et l’inhibition de leur fonction. Le facteur PTEN inhibe l’activation de la voie PI3K/AKT. |
La complexité de la fonction des facteurs FoxO et l’importance du contexte cellulaire sont également mises en évidence par l’augmentation de l’apoptose des progéniteurs myéloïdes en l’absence de différence du taux de ROS, une observation qui reste inexpliquée dans ce modèle. Les facteurs FoxO ont également été impliqués dans les mécanismes de réparation de l’ADN suite à des anomalies génétiques. Leur absence pourrait donc interférer avec les processus de réparation de ces anomalies et induire l’apoptose. L’accumulation de mutations dans des oncogènes ou gènes suppresseurs de tumeurs pourrait également participer à la transformation cancéreuse et expliquer la survenue de syndromes myéloprolifératifs et de lymphomes T chez les souris FoxO1/3/4−/−.
Finalement, on peut noter que le facteur FoxO3 a été impliqué dans le maintien de la quiescence des follicules ovariens [10]. En outre, DAF-16, l’orthologue des facteurs FoxO chez le nématode C. elegans, joue un rôle dans l’entrée et le maintien de l’état dauer et contrôle la durée de vie des vers1 [11, 12]. Ces observations suggèrent donc l’implication des facteurs FoxO dans les mécanismes de maintien de la quiescence et de la longévité des cellules souches en général.
« Ainsi, les recherches sur le phénomène de résistance à l’absence de nourriture, qui conduit les jeunes larves de C. elegans à adopter une voie parallèle de développement appelée dauer larva (de l’allemand dauer, durer), ont permis d’élucider le mécanisme moléculaire de la signalisation par l’insuline et des mécanismes de longévité » (tiré de [11]).
Références
- Brunet A. The multiple roles of FOXO transcription factors. Med Sci (Paris) 2004; 20 : 856–9. [Google Scholar]
- Tothova Z, Kollipara R, Huntly BJ, et al. FOXOs are critical mediators of hematopoietic stem cell resistance to physiologic oxidative stress. Cell 2007; 128 : 325–39. [Google Scholar]
- Paik JH, Kollipara R, Chu G, et al. FOXOs are lineage-restricted redundant tumor suppressors and regulate endothelial cell homeostasis. Cell 2007; 128 : 309–23. [Google Scholar]
- Gougerot-Pocidalo MA, El Benna J, My-Chan Dang P, Elbim C. Quand les polynucléaires neutrophiles attrapent les agents pathogènes dans leurs filets. Med Sci (Paris) 2007; 23 : 464–5. [Google Scholar]
- Zhang J, Grindley JC, Yin T, et al. PTEN maintains haematopoietic stem cells and acts in lineage choice and leukaemia prevention. Nature 2006; 441 : 518–22. [Google Scholar]
- Yilmaz OH, Valdez R, Theisen BK, et al. Pten dependence distinguishes haematopoietic stem cells from leukaemia-initiating cells. Nature 2006; 441 : 475–82. [Google Scholar]
- Ito K, Hirao A, Arai F, et al. Regulation of oxidative stress by ATM is required for self-renewal of haematopoietic stem cells. Nature 2004; 431 : 997–1002. [Google Scholar]
- Reya T, Duncan AW, Ailles L, et al. A role for Wnt signalling in self-renewal of haematopoietic stem cells. Nature 2003; 423 : 409–14. [Google Scholar]
- Essers MA, de Vries-Smits LM, Barker N, et al. Functional interaction between beta-catenin and FOXO in oxidative stress signaling. Science 2005; 308 : 1181–4. [Google Scholar]
- Castrillon DH, Miao L, Kollipara R, et al. Suppression of ovarian follicle activation in mice by the transcription factor Foxo3a. Science 2003; 301 : 215–8. [Google Scholar]
- Libina N, Berman JR, Kenyon C. Tissue-specific activities of C. elegans DAF-16 in the regulation of lifespan. Cell 2003; 115 : 489–502. [Google Scholar]
- Labouesse M. Caenorhabditis elegans. Med Sci (Paris) 2003, 19 : 1171–2. [Google Scholar]
© 2007 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. L’inactivation des facteurs FoxO entraîne des anomalies multiples des cellules hématopoïétiques. Chez des animaux irradiés transplantés avec des cellules de moelle osseuse sauvage (ligne bleue) ou FoxO1/3/4−/− (ligne rouge), le pourcentage de cellules hématopoïétiques FoxO1/3/4−/− (exprimant le marqueur CD45.2) diminue avec le temps. Les CSH FoxO1/3/4−/− présentent une entrée dans le cycle cellulaire, une mort cellulaire par apoptose et un stress oxydatif plus importants que les CSH sauvages. En dehors de l’augmentation de l’apoptose, ces caractéristiques ne sont pas observées dans les progéniteurs myéloïdes. Les souris FoxO1/3/4−/− présentent fréquemment des syndromes myéloprolifératifs de développement rapide, associé à une splénomégalie, et des lymphomes des cellules T qui se développent avec une latence plus longue. Mx1-Cre : recombinase Cre sous le contrôle du promoteur Mx1. plpC : ARN double brin synthétique activant le promoteur Mx1. |
| Dans le texte | |
 |
Figure 2. La voie PI3K/AKT/FoxO dans les cellules hématopoïétiques. Les facteurs FoxO activent la transcription de nombreux gènes cibles et entraînent l’arrêt du cycle cellulaire, l’apoptose et la résistance au stress en l’absence de facteurs de croissance et en présence de stimulus de stress. En présence de facteurs de croissance, la voie PI3K/AKT est activée, entraîne la phosphorylation des facteurs FoxO et l’inhibition de leur fonction. Le facteur PTEN inhibe l’activation de la voie PI3K/AKT. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




