| Issue |
Med Sci (Paris)
Volume 23, Number 4, Avril 2007
|
|
|---|---|---|
| Page(s) | 356 - 358 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2007234356 | |
| Published online | 15 April 2007 | |
TP53 et RB collaborent dans le développement des rétinoblastomes humains
TP53 and RB tumor suppressor pathways collaborate in retinoblastoma genesis
Department of Genetics and Tumor Cell Biology, St. Jude Children’s Research Hospital, Memphis, mail stop 350, 332 North Lauderdale, Memphis, 38105 Tennessee, TN, États-Unis
Les voies régulatrices p16INK4A/CYCLINE D/CDK4-6/pRB (RB, rétinoblastome) et p14ARF/MDM2-MDMX/TP53 (TP53) sont aujourd’hui bien connues pour leur rôle anti-tumoral. Elles induisent l’arrêt du cycle cellulaire, la sénescence ou l’apoptose des cellules cancéreuses [1]. Localisés sur le même locus génomique en 9p21, les deux gènes humains suppresseurs de tumeurs INK4A et ARF ont la caractéristique, quasi-unique chez les eucaryotes, de donner naissance, à partir de promoteurs distincts et de leurs trois exons (exons 1 alternatifs α [pour INK4A] et β [pour ARF], exons 2 et 3 identiques), à deux protéines sans aucune parenté qui se comportent comme des régulateurs négatifs de la prolifération. P16INK4A régule négativement la voie RB tandis que p14ARF permet l’activation de la voie TP53 (Figure 1A). Chez l’homme, dans la plupart des cancers, les voies régulatrices RB et TP53 sont altérées. Ces altérations représentent, par conséquent, une étape importante et peut-être requise, dans le développement tumoral.
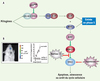 |
Figure 1. A. Représentation schématique des voies régulatrices p16INK4A/CYCLINE D/CDK4-6/pRB et p14ARF/MDM2-MDMX/TP53. Sous l’action de mitogènes, la CYCLINE D est synthétisée et se lie aux kinases CDK4-6. La phosphorylation de RB par CDK4-6 permet la libération des facteurs de transcription E2F du complexe RB/E2F. Les E2F libres activent la transcription de gènes nécessaires à l’entrée en phase S. E2F et MYC induisent p14ARF. P14ARF se lie à MDM2 et MDMX et empêche ces derniers de dégrader TP53. L’accumulation de TP53 induit l’apoptose, la sénescence ou l’arrêt du cycle cellulaire. Nutline-3 inhibe la liaison entre TP53 et MDM2-MDMX. Topotécan permet l’induction de TP53 en provoquant des dommages de l’ADN. B. L’injection subconjunctivale simultanée de Nutline-3 et Topotécan permet une réduction des rétinoblastomes humains. Des cellules de rétinoblastomes humains exprimant constitutivement la luciférase ont été injectées dans les yeux de souris immunodéficientes. Les souris non traitées développent un rétinoblastome, visualisé par la luciférase (photo et cercles noirs sur le graphique de droite) alors que les souris traitées par la Nutline-3 ou le Topotécan développent un rétinoblastome de taille inférieure. L’administration simultanée des deux drogues (cercles ouverts sur le graphique de droite) permet une réduction encore plus importante des rétinoblastomes (photographie donnée par M. Dyer). |
La mutation du gène RB1 conduit à la formation du rétinoblastome, cancer de la rétine de l’enfant [2]. Classiquement, il existe deux types de rétinoblastome : l’un à transmission héréditaire dans lequel l’un des allèles muté est transmis à l’enfant. L’inactivation de l’autre allèle peut conduire à un rétinoblastome multifocal dans lequel les deux yeux sont touchés. L’autre cas, sporadique, dans lequel les deux allèles sont mutés dans le même œil, conduit à un rétinoblastome unilatéral. RB1 fait partie de la famille des protéines pockets qui comprend également p107 et p130. Contrairement à RB1, p107 et p130 ne sont pas mutés dans le rétinoblastome humain. Pour essayer de mieux comprendre ce type de cancer, plusieurs modèles murins ont été développés. Ces modèles reproduisent les caractéristiques de la tumeur humaine, mais nécessitent l’inactivation de deux membres de la famille Rb : Rb et p107. La fréquence et la pénétrance des tumeurs sont fortement augmentées lorsque p53 est également inactivé. Cela suggère que la perte de p53 peut jouer un rôle important dans le développement du rétinoblastome. Cependant, TP53 n’a jamais été trouvé muté dans les retinoblastomes humains. On a donc supposé que la voie TP53 n’était pas requise pour l’inactivation tumorale et que les cellules de la rétine contenant une mutation de RB1 étaient résistantes à l’activité apoptotique de TP53.
Le taux de TP53 dans la cellule est notamment contrôlé par p14ARF et MDM2. P14ARF, exprimée lorsque les signaux prolifératifs sont trop élevés, se lie à MDM2 et MDMX et empêche ces derniers de dégrader TP53 (Figure 1A). MDM2 se lie à TP53 et, grâce à son activité d’ubiquitine-ligase (E3), permet sa dégradation via le protéasome. MDMX (aussi connu sous le nom de MDM4), un autre membre de la famille de MDM2, possède les mêmes caractéristiques que MDM2. Comme MDM2, MDMX est également fréquemment surexprimée dans plusieurs types de tumeurs. Les premières données montrant que la voie p14ARF/MDM2-MDMX/TP53 joue un rôle dans le développement du rétinoblastome proviennent d’une étude récente réalisée par l’équipe du Docteur Michael Dyer [3, 4] (St. Jude Children’s Research Hospital, Memphis, États-Unis). L’analyse de tumeurs humaines (rétinoblastomes) a montré un taux de p14ARF 71 à 500 fois plus important que celui qui est observé dans des rétines fœtales normales. Sachant que la protéine TP53 est fonctionnelle dans le rétinoblastome, il était logique de penser qu’un taux aussi important de p14ARF conduirait à une stabilisation de TP53 permettant ainsi un arrêt du cycle cellulaire ou l’apoptose des cellules rétiniennes tumorales. Cependant, la protéine TP53 n’est pas du tout stabilisée dans ces tumeurs. Cela suggérait donc fortement qu’il devait y avoir un autre gène dans la voie TP53 dont l’expression devait être altérée. Des analyses par arrayCGH (comparative gene hybridization) sur des tumeurs humaines ont montré que MDMX est amplifié (3/7). Cette amplification est corrélée à une augmentation de l’ARN et de la protéine MDMX. Par analyse FISH (fluorescent in situ hybridization), 32 tumeurs sur 49 (65 %) montrent des copies supplémentaires de MDMX et 5 tumeurs sur 49 (10 %) de MDM2. Cela suggérait que l’hyper-expression de MDMX et de MDM2 induit une dégradation de TP53 dans les cellules tumorales, même en présence d’un taux élevé de p14ARF, qui serait par conséquent insuffisant pour la séquestration complète de MDMX et MDM2. En effet, la surexpression de MDMX, dans des cellules de rétine de souris nouveau-nées invalidées pour Rb et p107, induit la prolifération et la survie des cellules rétiniennes mais également l’apparition de rétinoblastomes, dont l’agressivité est comparable à celle des tumeurs provenant des souris invalidées pour p107, Rb et p53. De plus, la surexpression de MDMX et l’inactivation de RB1 dans des cellules de rétines normales humaines induisent l’organisation des cellules en rosettes comparables à celles qui sont observées dans les rétinoblastomes humains.
L’équipe du Dr M. Dyer a également montré qu’en aval de MDMX, la réponse aux dommages à l’ADN faisant intervenir TP53 est bien fonctionnelle dans les rétinoblastomes. En effet, l’irradiation des cellules tumorales ou leur traitement par Topotécan [5], agent chimio-thérapeutique inhibiteur de la topoisomérase I, permet l’induction de TP53 et, par conséquent, l’apoptose. Cette apoptose est accrue par l’inactivation de MDMX. Le traitement associant la Nutline-3, petite molécule inhibitrice de la liaison entre TP53 et MDMX, et Topotécan tue les cellules de rétinoblastomes. De plus, dans un modèle de transplantation de cellules de rétinoblastomes humains chez la souris, l’injection simultanée par voie sous-conjonctivale de ces deux drogues permet une réduction des rétinoblastomes, sans effet secondaire contrairement à l’utilisation de ces deux drogues par voie systémique (Figure 1B). Cette découverte de l’équipe de M. Dyer permet d’envisager un traitement des patients par injection sous-conjonctivale de Topotécan et Nutline-3. Ce type d’administration pourrait permettre d’obtenir de très bons résultats sur la régression du rétinoblastome, et surtout, d’éviter les profonds effets secondaires induits par les chimiothérapies.
Remerciements
Nous remercions Michael Dyer pour nous avoir donné la Figure 1B. Olivier Ayrault est financé par la Fondation pour la Recherche Médicale (09/05-09/06) et par le Gephardt Endowed Fellowship-Signal Transduction (09/06-09/08). Frédérique Zindy voudrait remercier très sincèrement le professeur Gérard Buttin pour son support moral tout au long de sa carrière scientifique. Martine F. Roussel est financée par the NIH CA-96832, Core Grant CA-21765, the Children’s Brain Tumor Foundation (CBTF) et the Pediatric Brain Tumor Foundation (PBTF), the American-Lebanese Syrian Associated Charities (ALSAC) and St. Jude Children’s Research Hospital.
Références
- Sherr CJ, McCormick F. The RB and p53 pathways in cancer. Cancer Cell 2002; 2 : 103–12. [Google Scholar]
- Classon M, Harlow E. The retinoblastoma tumour suppressor in development and cancer. Nat Rev Cancer 2002; 2 : 910–7. [Google Scholar]
- Dyer MA, Rodriguez-Galindo C, Wilson MW. Use of preclinical models to improve treatment of retinoblastoma. PLoS Med 2005; 2 : e332. [Google Scholar]
- Laurie NA, Donovan SL, Shih CS, et al. Inactivation of the p53 pathway in retinoblastoma. Nature 2006; 444 : 61–6. [Google Scholar]
- Laurie NA, Gray JK, Zhang J, et al. Topotecan combination chemotherapy in two new rodent models of retinoblastoma. Clin Cancer Res 2005; 11 : 7569–78. [Google Scholar]
© 2007 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. A. Représentation schématique des voies régulatrices p16INK4A/CYCLINE D/CDK4-6/pRB et p14ARF/MDM2-MDMX/TP53. Sous l’action de mitogènes, la CYCLINE D est synthétisée et se lie aux kinases CDK4-6. La phosphorylation de RB par CDK4-6 permet la libération des facteurs de transcription E2F du complexe RB/E2F. Les E2F libres activent la transcription de gènes nécessaires à l’entrée en phase S. E2F et MYC induisent p14ARF. P14ARF se lie à MDM2 et MDMX et empêche ces derniers de dégrader TP53. L’accumulation de TP53 induit l’apoptose, la sénescence ou l’arrêt du cycle cellulaire. Nutline-3 inhibe la liaison entre TP53 et MDM2-MDMX. Topotécan permet l’induction de TP53 en provoquant des dommages de l’ADN. B. L’injection subconjunctivale simultanée de Nutline-3 et Topotécan permet une réduction des rétinoblastomes humains. Des cellules de rétinoblastomes humains exprimant constitutivement la luciférase ont été injectées dans les yeux de souris immunodéficientes. Les souris non traitées développent un rétinoblastome, visualisé par la luciférase (photo et cercles noirs sur le graphique de droite) alors que les souris traitées par la Nutline-3 ou le Topotécan développent un rétinoblastome de taille inférieure. L’administration simultanée des deux drogues (cercles ouverts sur le graphique de droite) permet une réduction encore plus importante des rétinoblastomes (photographie donnée par M. Dyer). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




